离体培养藏红花细胞合成的藏红花色素稳定性
2015-11-11扶文君袁丽红
扶文君,袁丽红
(南京工业大学 生物与制药工程学院,江苏 南京 211800)
离体培养藏红花细胞合成的藏红花色素稳定性
扶文君,袁丽红
(南京工业大学 生物与制药工程学院,江苏 南京 211800)
研究pH、温度、光照、氧化剂、还原剂、食品添加剂和金属离子对离体培养的藏红花细胞合成的藏红花色素稳定性的影响,并与藏红花柱头色素进行比较。结果表明:藏红花细胞合成的色素与柱头色素均为水溶性色素,呈亮黄色,对食品添加剂(食盐、柠檬酸、蔗糖、苯甲酸钠)和H2O2表现出良好的稳定性。与柱头色素相比,藏红花细胞合成的色素对强酸(pH 1)、高温(80、100℃)和光照(日光灯光、紫外光)表现出更好的稳定性,对VC和Cu2+(0.001 mol/L)的稳定性略差。稀碱溶液(0.47 mol/L Na2CO3、0.1 mol/L NaOH)、Na2SO3、Fe2+(0.050 mol/L)和Fe3+能使细胞合成的色素色强增强。
藏红花;藏红花色素;离体培养;稳定性
藏红花(Crocus sativus L.)又名番红花、西红花,为鸢尾科植物,由于藏红花柱头中主要成分藏红花苷(crocin)具有较好的水溶性和极强的着色力,藏红花醛(safranal)具有独特的香味,因此,藏红花可作为珍贵的调味剂、香料和染料[1-2]。近年来,研究人员通过医药学研究发现藏红花在抗肿瘤[3]、免疫调节[4]、治疗心脑血管系统疾病[5]和抗抑郁[6]等方面亦具有良好功效。
植物细胞培养技术的建立和发展为解决藏红花资源短缺提供了一条有效途径。国内外已开展藏红花细胞培养生产藏红花色素的研究,并取得了一定进展。陈书安、Dufreshe等[7]和孟风来等[6-8]对藏红花细胞的悬浮培养进行了研究,发现培养20 d后细胞生物量为12.3g/L(以细胞干质量计),28 d藏红花素含量和产量分别为95.8mg/g和0.92g/L。Dufresne等[7]利用藏红花细胞葡萄糖基转移酶(glucosyltransferase)进行藏红花酸(crocetin)糖基化,在培养12 d的100mL细胞培养物中加入30mg藏红花酸,发现培养4 d可转化形成9mg/g藏红花酸糖酯。
藏红花色素在贮存中受到环境中温度、pH和光照等因素的干扰,直接影响色素的药用价值。而藏红花色素的主要成分为藏红花苷、藏红花苦素、藏红花醛和一些类胡萝卜素类物质。其中,类胡萝卜素因具有不稳定性,而能发生直接化学氧化降解、光氧化降解和热氧化降解[9]。在自然界中植物代谢产物糖基化现象普遍存在,通过糖基化化合物由非结合态转化为结合态,可使稳定性增强[10]。
以藏红花球茎和幼芽为外植体诱导获得了性状优良的细胞系[11],在此基础上对细胞性状进行调控并建立了藏红花细胞悬浮培养体系,通过培养条件优化和添加诱导子[12]等措施,发现藏红花细胞表现出稳定的色素合成能力。为评价离体培养藏红花细胞合成的色素的应用潜力,本实验系统研究pH、温度、光照、氧化剂、还原剂、食品添加剂以及金属离子对其稳定性的影响,并与柱头色素进行比较,以期为该色素资源的开发利用提供依据。
1 材料与方法
1.1 材料
藏红花球茎愈伤组织(橙黄色,质地疏松、不透明),由笔者所在实验室诱导和筛选。藏红花干柱头,购于上海崇明岛。
1.2 试剂
NaOH、Na2CO3、H2O2、Na2SO3、VC、CuCl2、FeCl3、FeSO4、Na2HPO4、甲醇、乙醇、乙醚、三氯甲烷、环己烷、浓盐酸、食盐、柠檬酸、蔗糖和苯甲酸钠等,均为市售分析纯。
1.3 仪器设备
BS-224S型电子天平,德国赛多利斯科学仪器有限公司;FreeZone 2.5型冻干机,美国Labconco公司;UV-2800型紫外可见分光光度计,尤尼科(上海)仪器有限公司;PHS-3C型pH计,上海精科仪器有限公司;电热恒温水浴锅和光照培养箱,上海博迅有限公司仪器设备厂。
1.4 方法
1.4.1 藏红花细胞培养合成藏红花色素
将MS培养基上(附加2mg/L萘乙酸(NAA)、0.5mg/L 6-苄基嘌呤(6-BA)、30g/L蔗糖、6.5g/L琼脂,灭菌前调pH 6.0~6.1)培养30 d的藏红花细胞接种于1/2 B5培养基(大量元素减半,附加2mg/L吲哚乙酸(IAA)、0.5mg/L 6-BA、20g/L蔗糖,灭菌前调pH 6.0~6.1),接种量为100mL培养基接种15g细胞,(21±0.5)℃振荡培养28~30 d后收获,转速为150r/min。收获的细胞培养物于4℃、8 000r/min离心15min,用去离子水洗涤2次,收获细胞并冻干。
1.4.2 色素溶解性的测定
分别称取等量冻干细胞和柱头于5mL容量瓶中,加入蒸馏水、无水甲醇、体积分数50%甲醇、无水乙醇、体积分数50%乙醇、乙醚、三氯甲烷、环己烷、0.1 mol/L NaOH、0.47 mol/L Na2CO3和 0.1 mol/L HCl等溶剂,观察色素在不同溶剂中的溶解性及溶液颜色。
1.4.3 色素母液配制
分别称取一定量冻干细胞和干柱头于容量瓶中,加蒸馏水浸提48 h后过滤并定容至1 L,即得色素母液。
1.4.4 色素光谱特性的测定
测定色素母液在200~600 nm的紫外-可见吸收光谱。
1.4.5 pH对色素稳定性的影响
取5mL细胞合成的色素母液和柱头色素母液,分别加入5mL pH 3、5和7的0.1 mol/L柠檬酸-0.2 mol/L Na2HPO4缓冲液,pH为9的0.05 mol/L硼砂-0.2 mol/L硼酸缓冲液,pH为 11的 0.1 mol/L NaOH-0.05 mol/L Na2HPO4缓冲液及0.1 mol/L HCl,混匀,静置2 h后观察颜色并在440 nm处测吸光值;以加入5mL蒸馏水作对照。
1.4.6 温度对色素稳定性的影响
取等体积的细胞合成的色素母液和柱头色素母液,分别置于20、40、60、80和100℃的恒温水浴锅中加热1 h,在440 nm处测吸光值。
1.4.7 光照对色素稳定性的影响
取等体积的细胞合成的色素母液和柱头色素母液,分别放置于光照培养箱(光照强度15 000 lx)、避光和紫外灯(15 W)一定时间,在440 nm处测吸光值。
1.4.8 氧化剂对色素稳定性的影响
取5mL细胞合成的色素母液和柱头色素母液,分别加入5mL 0.33、0.66、0.99 mol/L H2O2溶液,室温下放置2 h后在440 nm处测吸光值;以加入5mL蒸馏水作对照。
1.4.9 还原剂对色素稳定性的影响
取5mL细胞合成的色素母液和柱头色素母液,分别加入5mL 0.2、0.4、0.6和0.8g/L Na2SO3溶液,1、2和3g/L VC溶液,室温下放置2 h,在440 nm处测吸光值;以加入5mL蒸馏水作对照。
1.4.10 食品添加剂对色素稳定性的影响
取5mL细胞合成的色素母液和柱头色素母液,分别加入5mL 10、20、30和40g/L食盐溶液,5、10、15和20g/L柠檬酸溶液,20、40、60和80g/L蔗糖溶液,0.5、1.0、1.5和2.0g/L苯甲酸钠溶液,室温下放置2 h,在440 nm处测吸光值;以加入5mL蒸馏水作对照。
1.4.11 金属离子对色素稳定性的影响
取5mL细胞合成的色素母液和柱头色素母液,分别加入5mL 0.001、0.005、0.01、0.05 mol/L CuCl2、FeCl3和FeSO4溶液,室温下放置2 h,在440 nm处测吸光值;以加入5mL蒸馏水作对照。为消除Fe3+颜色的影响,以相应浓度的FeCl3溶液做参比。
1.4.12 数据分析
1.4.5~1.4.11试验色素稳定性以色素残存率表示;上述所有试验结果均为3次重复实验所得的平均值。
2 结果与讨论
2.1 色素的溶解性
2.2 色素的光谱特性
藏红花细胞合成的色素和柱头色素在紫外区和可见光区均有吸收,但二者吸收特征具有一定差异(图1)。由图1可知:细胞合成的色素在紫外区吸收很强,并且明显强于可见光区的吸收,在280和330 nm有2个显著的吸收特征峰,在400~500 nm可见光区也有吸收,但由于多个吸收峰的重叠未表现出显著的吸收特征峰,且呈现出宽的吸收特征,吸收则随波长的减少吸收增强。柱头色素有3个吸收特征峰,分别为254、330和440 nm。此外,二者都有末端吸收。
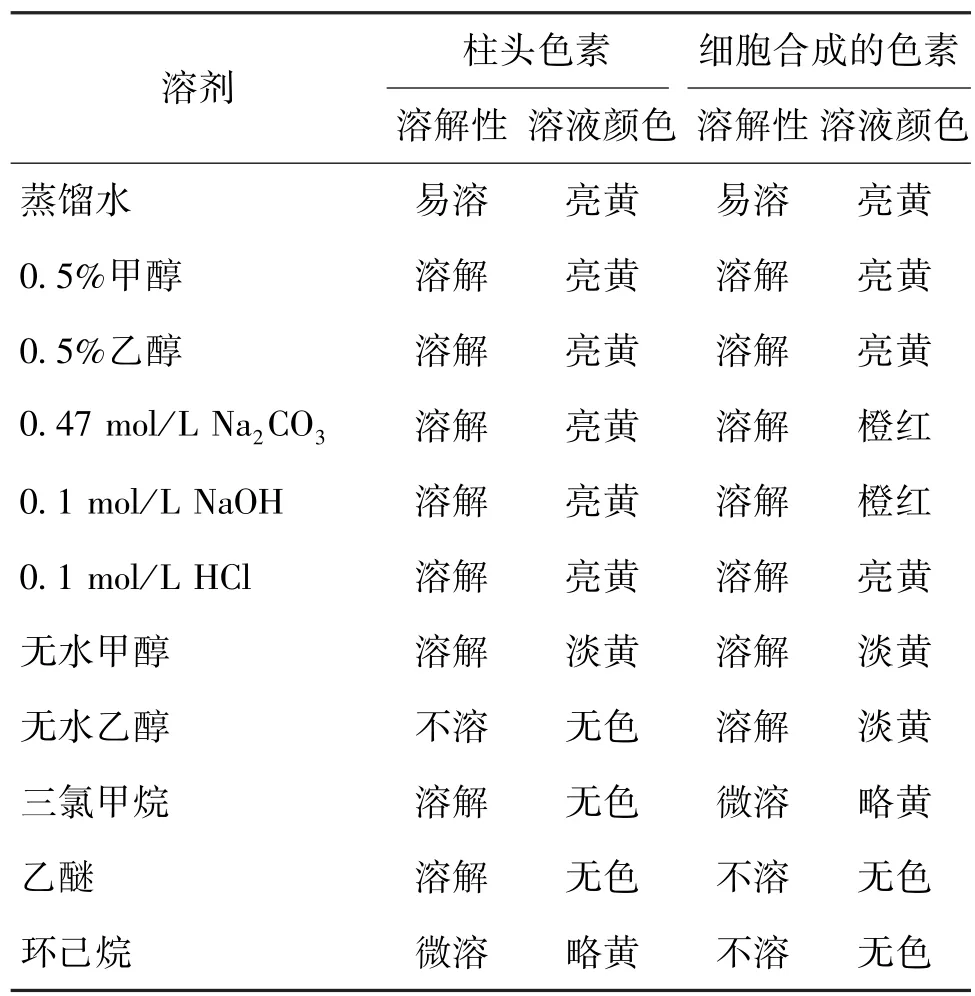
表1 藏红花色素的溶解性Table 1 The solubilities of pigments in different solvents
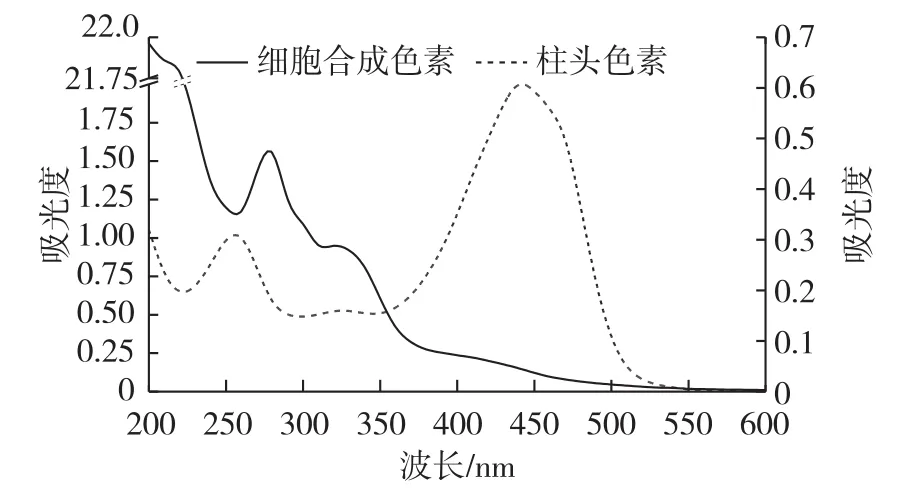
图1 藏红花色素的紫外-可见吸收光谱Fig.1 UV-Vis absorption spectra of pigments
藏红花苷在可见光区和紫外区均有吸收特征峰。糖酯键使藏红花苷在260 nm处具有第一个吸收带;全反式类胡萝卜素类化合物使其在400~470 nm处具有第二个吸收带,最大吸收波长为440 nm;全顺式结构使其在328 nm处具有第三个吸收带[13]。本实验中藏红花细胞合成的色素与柱头色素在上述3个波长段均有吸收,含有主要物质藏红花苷,但细胞合成的色素的紫外吸收很强。可见,藏红花细胞合成的色素可能较天然色素成分更复杂,色素中除了含有主要物质藏红花苷外,还含有其他紫外吸收物质,与天然藏红花色素成分存在差异。
2.3 pH对色素稳定性的影响分析
图2为pH对2种色素稳定性影响的结果。从图2可以看出,在不同pH溶液中2种色素稳定性具有一定差异。在pH为1时细胞合成的色素的色素残存率为90.0%,柱头色素残存率只有45.2%,说明细胞合成的色素在pH为1时的稳定性优于柱头色素。在pH 3~11范围内柱头色素比较稳定,色调均为亮黄色。柯贵珍[13]报道了在pH为11、12溶液中天然藏红花色素溶液吸光度明显增加的现象,而本研究中柱头色素在碱性条件下比较稳定,但未表现出增色现象,这可能与藏红花柱头的来源(产地、质量)有关。细胞合成的色素在pH为1~5范围内比较稳定,色调为亮黄色,但在中性到碱性条件下具有显著的增色效应,并且增色效应随碱性的增强而增强,在pH=7的缓冲液中呈橙黄色,在pH为9或11缓冲液中呈橙红色。
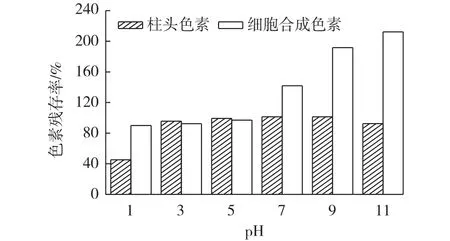
图2 pH对色素稳定性的影响Fig.2 Effects of pH on stabilities of pigments
2.4 温度对色素稳定性的影响分析
(1)由四川省发改委统筹协调编制天然气分布式能源规划。各地市政府在全省“十三五”能源发展规划和相关政策指导下依据当地城市总体规划、供热规划、热力电力需求、资源禀赋、环境约束等条件,因地制宜、统筹谋划、科学编制各地天然气分布式能源建设规划并报省发改委审批。
温度对2种色素稳定性的影响,结果见图3。从图3可以看出:温度对2种色素的稳定性影响不同。20~60℃柱头色素残存率变化不大,具有一定的热稳定性,但随温度的升高,80和100℃色素残存率明显下降。高丽等[14]也报道了栀子黄色素(主要成分为藏红花苷)具有一定耐热性。细胞合成的色素随温度的升高色强增强,100℃色素残存率为115.9%。说明高温对藏红花细胞合成的色素具有明显的增色作用。
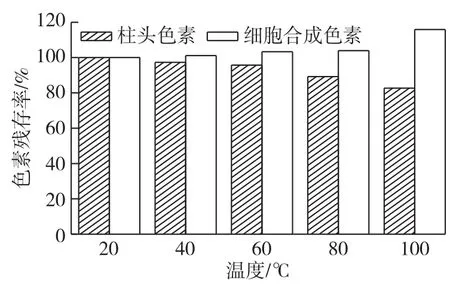
图3 温度对色素稳定性的影响Fig.3 Effects of temperature on stabilities of pigments
2.5 光照对色素稳定性的影响分析
光照对色素稳定性的影响,结果见图4。从图4(a)可以看出:在日光灯光照下,柱头色素对光极不稳定,褪色严重,放置 3 d后色素残存率只有12.8%;细胞合成的色素在放置11 d过程中色素残存率呈逐渐下降趋势,但变化幅度不大,未见明显褪色现象,11 d后色素残存率仍达78.6%。说明细胞合成的色素对光的稳定性明显优于柱头色素。
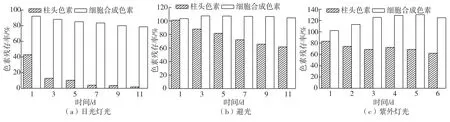
图4 光照对色素稳定性的影响Fig.4 Effects of light on stabilities of pigments
从图4(b)可以看出:在避光条件下,柱头色素残存率逐渐下降,但较日光灯光照下稳定,11 d色素残存率仍有61.6%。细胞合成的色素变化不大,且色强略有增强,11 d后色素残存率为104.5%,说明在避光条件下细胞合成的色素稳定性优于柱头色素。
从图4(c)可以看出:在紫外光照射下,柱头色素残存率呈逐渐下降趋势,变化没有日光灯光照下明显,但比避光条件下变化幅度大,6 d后色素残留率为62.1%;而细胞合成的色素放置3 d后色强明显增强,色素残存率为125.5%,之后变化幅度不大,6 d后色素残留率为124.9%。可见,细胞合成的色素对紫外光亦表现出良好的稳定性。
2.6 氧化剂和还原剂对色素稳定性的影响分析
图5为氧化剂和还原剂对2种色素稳定性的影响结果。从图5(a)可以看出:加入H2O2后,2种色素残存率略有下降,但加大浓度后2种色素均表现出良好的稳定性,加入0.99 mol/L H2O2后细胞合成的色素与柱头色素的色素残存率仍达90.9%和 91.4%。从图5(b)、5(c)可以看出:还原剂Na2SO3和VC对2种色素的稳定性影响不同。Na2SO3和VC对柱头色素稳定性没有明显影响,但Na2SO3对藏红花细胞合成的色素具有显著的增色作用,并且增色效应随Na2SO3浓度提高而增强;VC使细胞合成的色素的色素残存率有一定降低,并且在1~3g/L实验浓度范围内色素残存率基本一致,说明还原剂对细胞合成的色素稳定性影响与还原剂种类有一定关系。
2.7 食品添加剂对色素稳定性的影响分析
图6为食品添加剂对2种色素稳定性的影响结果。由图6可知:食盐、柠檬酸、蔗糖和苯甲酸钠对细胞合成的色素和柱头色素稳定性影响不大,2种色素对4种食品添加剂均表现出良好的稳定性。
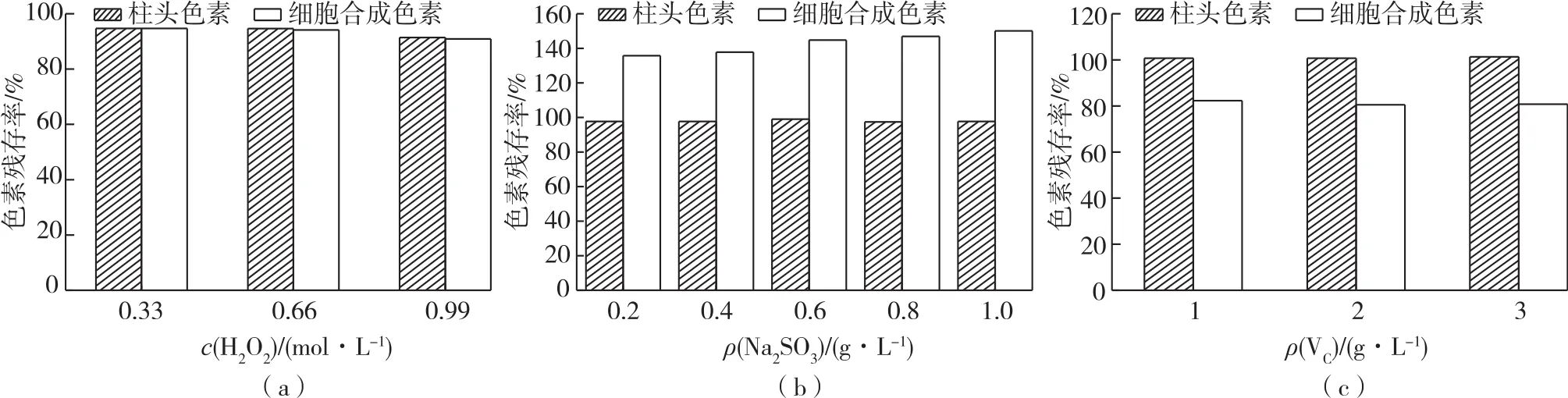
图5 氧化剂和还原剂对色素稳定性的影响Fig.5 Effects of oxidant and reductant on stabilities of pigments
2.8 金属离子对色素稳定性的影响
图7为金属离子对2种色素稳定性的影响结果。由图7可知:Cu2+、Fe2+、Fe3+对2种色素稳定性影响具有一定差异。Cu2+对柱头色素的影响不大,残存率基本不变,在98.0%~102.0%范围。细胞合成的色素在低浓度的Cu2+(0.001 mol/L)溶液中色强下降,色素残留率为86.0%,但在0.005、0.010和0.050 mol/L Cu2+溶液中表现出良好稳定性,色素残存率为 94.2%~99.2%。在 0.001、0.005和0.010 mol/L Fe2+溶液中,2种色素表现出良好的稳定性;但在高浓度Fe2+(0.050 mol/L)溶液中,2种色素色强都明显增强,细胞合成的色素与柱头色素的色素残存率分别为159.8%和138.6%。柱头色素对Fe3+极不稳定,色素色强明显下降,色素残存率为18.9%~35.2%。但细胞合成的色素对Fe3+表现很好的稳定性,且具有极强的增色效应,增色效应随Fe3+浓度提高而增强,色素残存率为152.5%~175.2%。
高丽等[14]、郝金声等[15]分别研究了 Cu2+对栀子黄色素和密蒙花黄色素稳定性的影响,发现色素的吸光值随Cu2+浓度增加而增加,并未表现出本实验中低浓度Cu2+对色素影响的效应。因此关于低浓度Cu2+对细胞合成的藏红花色素稳定性影响的原因有待进一步探讨。
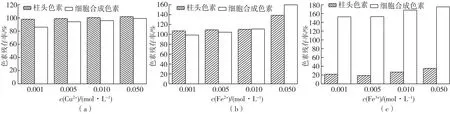
图7 金属离子对色素稳定性的影响Fig.7 Effects of metal ions on stabilities of pigments
3 结论
藏红花柱头色素对pH 3~11碱性溶液、H2O2、Na2CO3、VC、食盐、柠檬酸、蔗糖、苯甲酸钠、Cu2+和Fe2+(0.001、0.005、0.010 mol/L)稳定性较好,但对pH 1、高温(80、100℃)、光照(日光灯光、紫外灯光)和Fe3+稳定性差。
与藏红花柱头色素相比,离体培养藏红花细胞合成的色素在pH 1、高温(80、100℃)、光照(日光灯光、紫外灯光)条件下的稳定性更佳。细胞合成的色素在稀碱(0.47 mol/L Na2CO3、0.1 mol/L NaOH)、Na2SO3、Fe2+(0.05 mol/L)和Fe3+溶液中色强增强,对VC和Cu2+(0.001 mol/L)的稳定性略差。说明离体培养细胞合成的藏红花色素表现出更加优良的稳定性,尤其对强酸、高温和光照的表现更佳,可为该色素的应用提供一定的依据和帮助。
[1]杨英,赵焕君.中药藏红花的研究进展[J].中医药学刊,2006, 24(12):2324-2325.
[2]Escribano J,Alonso G L,Coca Prados M,et al.Crocin,safranal and picrocrocin from saffron(Crocus sativus L.)inhibit the growth of human cancer cells in vitro[J].Cancer Letters,1996,100:23-30.
[3]Escribano J,Diaz M J M,Riese H H,et al.In vitro activation of macrophages by a novel proteoglycan isolated from croms of Crocus sativus L.[J].Cancer Letters,1999,144:107.
[4]陈琼,顾仁樾,周端.藏红花对冠心病心绞痛患者血流变学的作用[J].辽宁中医杂志,1997,24(8):372-373.
[5]Noorbala A A,Akhondzadeh S,TahmacebiPour N,et al.Hydroalcoholic extract of Crocus sativus L.versus flouxetine in the treatmentof mild moderate depression:a double-blind,randomized pilot trial[J].Journal of Ethnopharmacology,2005,97:281-284.
[6]陈书安,王晓东,袁晓凡,等.藏红花细胞悬浮培养动力学研究[J].生物技术通报,2011(4):102-105.
[7]Dufresne C,CormierF,Dorion S,etal.Glycosylation of encapsulated crocetin by a Crocus sativus L.cell culture[J]. Enzyme and Microbial Technology,1999,24:453-462.
[8]孟凡来,赵昶灵,段丽斌,等.高等植物类胡萝卜素的生物降解途径研究进展[J].中国农学通报,2013,29(24):143-150.[9]赵明强,丁家宜.植物培养物对外源化合物的糖基化[J].药学实践杂志,2000,5(18):340-342.
[10]袁丽红,陆玉婷,黄晶.藏红花愈伤组织诱导和褐化抑制[J].南京工业大学学报:自然科学版,2009,31(6):21-26.
[11]孙镇,袁丽红,吴频梅.诱导子对藏红花悬浮培养细胞生产藏红花色素的影响[J].生物加工过程,2013,11(3):18-23.
[12]Cossignani L,Urbani E,Simonetti M S,ea al.Characterisation of secondary metabolites in saffron from central Italy(Cascia, Umbria)[J].Food Chemistry,2014,143:446-451.
[13]柯贵珍.天然植物染料藏红花对真丝织物染色[J].丝绸,2010(12):4-6.
[14]高丽,邓青云,姜益泉,等.栀子黄色素提取及其稳定性的研究[J].中国酿造,2012,31(5):16-179.
[15]郝金声,寿庆华,王超英.天然食用密蒙花黄色素的研究[J].天然产物研究与开发,1994,6(2):21-32.
(责任编辑 周晓薇)
Stabilities of saffron pigments produced by in vitro cell culture of Crocus sativus L.
FU Wenjun,YUAN Lihong
(College of Biotechnology and Pharmaceutical Engineering,Nanjing Tech University,Nanjing 211800,China)
The effects of pH,temperature,light,oxidant,reductant,food additives and metal ions on the stabilities of saffron pigments produced by Crocus sativus cells were investigated,and their stabilities were also compared with those of pigments from saffron stigma.The results showed that they were all watersolubleand bright yellow.They were stable to food additives and H2O2.Compared with saffron stigma pigments,saffron pigments produced by cell culture were more stable to strong acid(pH 1),high temperature(80℃,100℃)and light(incandescent light,UV),and less stable to VCand Cu2+(0.001 mol/L).The coloring power of saffron pigments produced by cell culture could be increased by dilute alkaline solutions(0.47 mol/L Na2CO3,0.1 mol/L NaOH),Na2SO3,Fe2+(0.050 mol/L)and Fe3+.
Crocus sativus L.;saffron pigments;in vitro culture;stabilities
Q943.1
A
1672-3678(2015)02-0041-06
10.3969/j.issn.1672-3678.2015.02.008
2014-04-08
扶文君(1990—),女,江苏宜兴人,硕士研究生,研究方向:植物细胞工程;袁丽红(联系人),教授,E-mail:yuanlihong@njtech.edu.cn
