中国楤木根皮多糖超声提取工艺及含量测定
2015-11-11侯宏红王一峰曹家豪李筱姣
侯宏红,王一峰,赵 博,靳 洁,曹家豪,李筱姣
(西北师范大学 生命科学学院,甘肃 兰州 730070)
中国楤木根皮多糖超声提取工艺及含量测定
侯宏红,王一峰,赵 博,靳 洁,曹家豪,李筱姣
(西北师范大学 生命科学学院,甘肃 兰州 730070)
为了筛选超声提取中国楤木根皮粗多糖的工艺,以中国楤木根皮多糖得率为衡量指标,采用水提醇沉法,对中国楤木根皮粗多糖超声提取工艺中提取时间、提取温度、超声功率、料液比4个因素用正交设计法进行优化研究。结果表明:中国楤木根皮粗多糖超声提取最佳工艺为温度70℃,料液比1∶30(g/mL),提取时间80min,超声功率100 W,此工艺下多糖得率为11.13%。该方法提取的多糖测得稳定性、重现性均良好。所得到的优化提取工艺准确可靠,保证了中国楤木根皮多糖的有效提取。
超声提取;中国楤木;多糖;正交试验
中国楤木(Aralia chinensis L.),五加科(Aralia)植物,又名鹊不踏、虎阳刺、海桐皮、鸟不宿等[1],药食两用,野生资源丰富,分布比较广泛,黄淮流域、东南及西南地区都有发现[1]。中国楤木具有悠久的药用和食用历史,以根皮和茎皮入药,具祛风解毒、活血止痛、补气安神的功效。研究表明,植物多糖在调节免疫、抑制肿瘤、降血糖、降血脂、抗病毒、抗衰老、抗氧化作用等方面均有显著活性[2]。楤木属植物可用于治疗急慢性肝炎、糖尿病、风湿腰腿痛、跌打损伤、无名肿毒、风湿性关节炎、胃炎等病症[3-5]。
近年来,楤木属植物的化学成分和药理活性研究取得很大进展,其化学成分主要有:多糖类、皂苷类、黄酮类、挥发油类、醌类、生物碱类、香豆素类等[6],对其多糖提取工艺研究报道甚少。宁德利等[7]用紫外分光光度法对长白楤木根、茎、叶中多糖的含量做了测定,测得三年生植株含糖量9.09%。刘艳等[8]测得四川楤木3批根皮、茎皮、叶、嫩芽中多糖平均含量分别为2.93%、1.90%、0.41%和2.01%;蔡静等[9]通过对飞天蜈蚣七(太白楤木)多糖热水提取工艺路线系统研究,在最佳条件下,多糖提取率为3.16%。
笔者拟采用超声波水提醇沉法,建立正交试验模型优化中国楤木根皮多糖(Aralia chinensis polysaccharide,ACP)提取工艺,筛选出ACP最优的提取条件。利用超声波所产生强烈的振动匀化效果及空化作用将植物细胞壁打破,通过加强植物细胞内的多糖分子传质作用,来加速多糖溶于溶剂中的速率,预期缩短提取时间、降低提取温度,为更好地开发利用中国楤木根皮多糖提供一定的理论依据。
1 材料与方法
1.1 材料与仪器
中国楤木根皮,采自甘肃徽县;60g/mL的苯酚(AR,用80%现配),天津市大茂化学试剂厂;无水乙醇(AR),天津市福晨化学试剂厂;无水葡萄糖标准品(AR),上海广诺化学科技有限公司;浓硫酸(AR),兰州万科玻化仪器有限公司。
KQ-250DE型台式数控超声提取仪,昆山超声仪器厂;JJ-1型增力电动搅拌器、JAR-6型数显磁力搅拌水浴锅,金坛市杰瑞尔电器有限公司;Allegra 64R型台式高速冷冻离心机,普瑞麦迪实验室技术有限公司;WGL-230B型电热鼓风干燥箱,天津市泰斯特仪器有限公司;BS223S型电子精密天平,北京塞多利斯仪器系统有限公司;U-2000型分光光度计,优尼科仪器有限公司;RE-52AA型旋转蒸发仪,上海亚荣生化仪器厂;SHB-Ⅲ型循环水式真空泵,上海比朗仪器有限公司;LGJ-18S型冷冻干燥机,北京松源华兴科技发展有限公司。
1.2 实验方法
1.2.1 中国楤木根皮多糖的提取
水提醇沉多糖:将中国楤木根皮置于40℃烘箱中烘24 h,在粉碎机中粉碎,称取10.00g(共9份),分别放于烧杯中并加入一定量的蒸馏水浸泡1 h后补入蒸馏水,在超声波中,用不同温度、不同功率、不同时间提取2次。提取过程辅以机械搅拌,过滤,将2次滤液合并进行减压浓缩至一定体积,浓缩液中加入无水乙醇,使乙醇体积分数达80%,放置24 h,4 000r/min离心,将所得沉淀在冷冻干燥机中真空冷冻干燥,即得中国楤木根皮粗多糖。
1.2.2 葡萄糖标准曲线绘制
精密称取无水葡萄糖标准品0.020g,用蒸馏水溶解,定容至250mL容量瓶中,摇匀,分别吸取0.2、0.3、0.4、0.5、0.6、0.7、0.8和0.9mL于10mL的带塞试管中,各以蒸馏水补至1.0mL,然后加入0.5mL苯酚(60g/L)及5.0mL浓H2SO4,混匀,在80℃水浴中加热30min,然后置于冷水浴中冷却至室温,以1.0mL蒸馏水按同样显色操作做空白对照,在490 nm处测吸光度[10-11],以吸光度A490为纵坐标,葡萄糖质量浓度ρ为横坐标,绘制标准曲线,并做线性回归,得回归方程。
1.2.3 多糖含量的测定
精确称取干燥至恒质量的各种工艺制备的中国楤木根皮粗多糖25mg,置于250mL的容量瓶中,加蒸馏水溶解并稀释至刻度,摇匀,制得0.1mg/mL的多糖样品液,精密移取各样品液1.0mL,按照1.2.2项下的操作方法测定中国楤木根皮多糖的吸光度,代入回归方程,计算多糖含量,并计算多糖提取得率。多糖提取得率计算见式(1)。

1.2.4 正交设计表
根据单因素试验,影响中国楤木根皮超声水提醇沉多糖提取率的主要因素有提取时间、提取温度、超声功率、料液比等。试验中不考虑因子间的交互作用,以 L9(34)正交表进行试验设计,见表1[12]。并以粗多糖得率作为衡量提取效率的客观指标,优选最佳提取工艺。
1.2.5 超声法提取多糖的稳定性试验和精密度试验
用移液枪吸取质量浓度为0.1mg/mL最优工艺条件下提取所得的多糖样品溶液1mL,按照1.2.2项下的操作方法,每15min测1次吸光度,持续2 h,检验方法的稳定性;连续测5次吸光度,检验此方法的精密度。
2 结果与讨论
2.1 葡萄糖标准曲线的绘制
按照1.2.2的操作,以葡萄糖标准溶液的质量浓度ρ(μg/mL)为横坐标,吸光度 A490为纵坐标,绘制葡萄糖标准曲线,得回归方程为A490=0.004ρ+ 0.147,R2=0.989。这表明在16~72 μg/mL浓度范围内,葡萄糖标准曲线线性关系良好,可用于样品液的测定。
2.2 单因素实验结果
2.2.1 料液比对多糖提取得率的影响
精确称取烘干粉碎后的中国楤木根皮各10.00g于烧杯中,加入蒸馏水,使料液比分别达1∶20、1∶30、1∶40、1∶50和1∶60g/mL,在超声功率为100 W,温度为80℃条件下按照1.2.1的提取方法各浸提60min,然后按照1.2.2项下标准曲线绘制的操作方法,测其吸光度,并代入回归方程计算多糖得率,结果见图1。

图1 料液比对中国楤木根皮多糖提取得率的影响Fig.1 Effects of ratio of material on polysaccharide yield of the root bark from Aralia chinensis
由图1可知:随料液比的增加,中国楤木多糖得率呈现先增加后减小的趋势。料液比为1∶40g/mL时,多糖得率达到最大值。说明适量的水溶剂有利于多糖的溶出,但溶剂过多或过少均不利于多糖的溶出。这是因为,料液比低时,多糖溶解不充分,得率较低;随着料液比的增加,多糖充分溶胀,有利于多糖的溶出,使得率增加,但是,料液比过大,加大了后续提取过程中的浓缩困难程度,使浓缩时间增加,必然使多糖在浓缩过程中有较多损失,反而使多糖得率下降[13]。因此,选1∶40g/mL为最佳料液比。
2.2.2 提取时间对多糖提取率的影响
精确称取烘干粉碎后的中国楤木根皮各10.00g于烧杯中,加入蒸馏水,使各自料液比达1∶40g/mL,在功率为100 W、80℃条件下,按照1.2.1的提取方法分别浸提20、35、50、65和80min。按照1.2.2项下标准曲线绘制的操作方法,测其吸光度,并代入回归方程计算多糖得率,结果见图2。
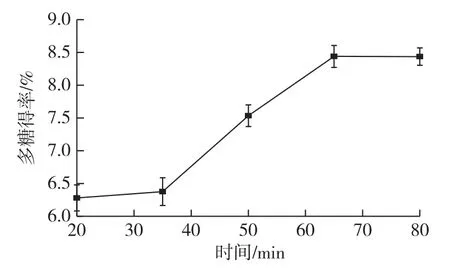
图2 提取时间对中国楤木根皮多糖提取得率的影响Fig.2 Effects of extraction times on polysaccharide yield of the root bark from Aralia chinensis
由图2可知:随着提取时间的增加,多糖得率也在增加,在20~35min时,多糖得率增加缓慢,在35~65min时,多糖得率增加显著,说明在此范围多糖溶出较多。但在65~80min时,多糖得率不再改变。多糖的溶出需要一定的时间,随着时间的增加,多糖的溶出量也增加,当达到一个最佳时间后,多糖已完全溶出,不再随时间的增加而增加。因此,选最佳提取时间为65min。
2.2.3 温度对多糖提取率的影响
精确称取烘干粉碎后的中国楤木根皮各10.00g于烧杯中,加入蒸馏水,使各自料液比达1∶40g/mL,在功率为100 W,温度分别为40、50、60、70和80℃条件下按照1.2.1的提取方法各浸提65min。按照1.2.2项下标准曲线绘制的操作方法,测其吸光度,并代入回归方程计算多糖得率,结果见图3。

图3 提取温度对中国楤木根皮多糖提取得率的影响Fig.3 Effects of extraction temperature on polysaccharide yield of the root bark from Aralia chinensis
由图3可知:多糖得率随着提取温度的增加而增加。在50~70℃时,多糖得率增长明显;在70~80℃时,多糖得率基本保持不变;在80~90℃时,多糖得率稍有下降。这是由于温度升高,分子运动加强,有利于多糖溶出,但是温度过高可能对多糖的结构有所损伤,导致多糖得率反而下降。为了节省能源和延长超声提取仪的使用寿命,所以选70℃为最佳提取温度。
2.2.4 功率对多糖提取率的影响
精确称取烘干粉碎后的中国楤木根皮各10.00g于烧杯中,加入蒸馏水,使各自料液比达1∶40g/mL,在温度为70℃,功率分别为60、70、80、90和100 W条件下,按照1.2.1的提取方法各浸提65min。按照1.2.2项下标准曲线绘制的操作方法,测其吸光度,并代入回归方程计算多糖得率,结果见图4。

图4 超声功率对中国楤木根皮多糖提取得率的影响Fig.4 Effects of ultrasonic power on polysaccharide yield of the root bark from Aralia chinensis
由图4可知:随着超声提取功率的增加,多糖得率也在增加,在60~90 W增加较明显,90~100 W增加较平缓。考虑本实验所用超声提取仪最大功率为100 W,为了减少对超声提取仪的损耗,选90 W为最佳提取超声功率。
2.3 正交试验结果与分析
以多糖提取率为响应值,以提取时间、提取温度、超声功率、料液比这4个因素进行的L9(34)正交试验设计及结果见表1,极差分析和方差分析见表2和表3。
由表2和表3可知,在不考虑交互作用情况下,各因素对提取率的影响顺序(从大到小)依次为提取时间、提取温度、超声功率、料液比。以多糖得率为衡量指标,由表1分析可知:最优工艺组合为A3B2C1D3,即提取时间为 80min,提取温度为 70℃,料液比为1∶30g/mL,超声功率100 W,在此条件下,多糖得率为11.194%。由表3方差分析可知:楤木根皮多糖超声提取法的因素对结果均有一定影响,时间和温度影响较大,具有显著差异性。
在最优工艺条件下做3次平行验证试验,取多糖得率平均值,结果见表4。

表1 正交试验设计及结果Table 1 The orthogonal experiment designs and results
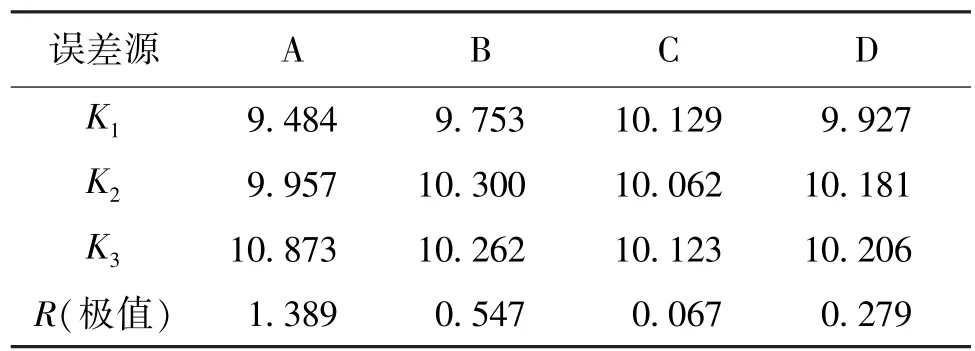
表2 极差分析Table 2 The range analysis
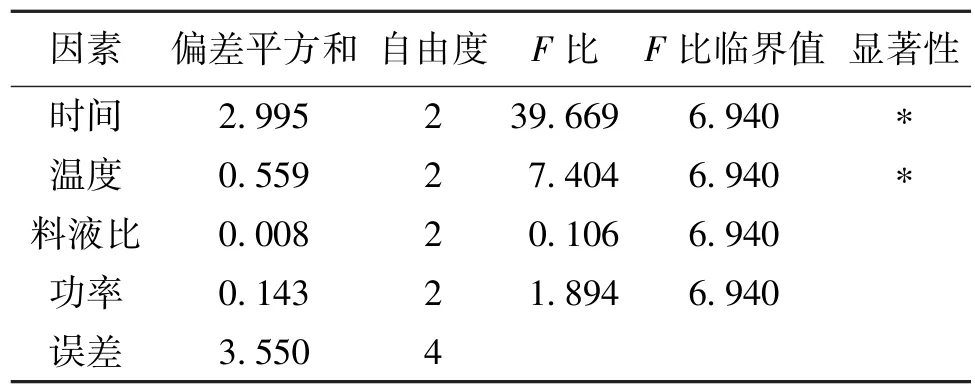
表3 方差分析Table 3 The variance analysis

表4 平行试验结果Table 4 Results of parallel test
由表4可知,在最优工艺条件下,多糖得率平均值为11.13%。
2.4 超声提取多糖的稳定性和精密度的测定
超声提取中国楤木根皮多糖的稳定性试验结果如表5所示,精密度测定如表6所示。

表5 稳定性试验结果(n=6)Table 5 Results of the stability test(n=6)

表6 精密度试验结果(n=5)Table 6 Results of the precision test(n=5)
由表5的标准偏差(RSD)为1.433%(n=6),可以推断此方法的稳定性较好。
由表6的标准偏差(RSD)为0.304%(n=5),可以确定此方法的精密度较高。
3 结论
以中国楤木根皮多糖得率为衡量指标,采用水提醇沉法,在单因素试验的基础上,选择提取时间、提取温度、超声功率、料液比为影响因素,用正交设计法进行优化研究。结果表明,超声法提取中国楤木根皮多糖的最佳工艺为提取时间为80min,提取温度为70℃,料液比为1∶30(g/mL),超声功率100 W。按最佳工艺提取中国楤木根皮多糖平均得率为11.13%,此工艺条件下,提取的中国楤木多糖的稳定性、重现性均良好。利用此方法提取多糖的工艺简单,多糖得率较高,可为中国楤木资源的进一步开发和利用提供一定的科学依据。
[1]中国科学院中国植物志编辑委员会.中国植物志:第54卷[M].北京:科学出版社,1978.
[2]彭会军,邹群.植物多糖的生物活性研究进展[J].西北药学杂志,2008,23(6):406-408.
[3]王忠壮,胡晋红.中国楤木属植物的生物学研究及应用[M].上海:第二军医大学出版社,2001.
[4]姜鸑,姜新.中国楤木属植物研究现状与展望[J].河北农业科学,2008,12(5):87-90.
[5]郑玲玲,装凌鹏.中国楤木属植物研究进展[J.中国民族医药杂志,2010(6):57-59.
[6]雒羽.飞天蜈蚣七中有效成分的提取纯化工艺及其应用研究[D].西安:西北大学,2012.
[7]宁德利,阮洪生,韩承伟,等.紫外分光光度法测定长白中国楤木根、茎、叶中多糖含量[J].黑龙江八一农垦大学学报,2009,21(3):67-69.
[8]刘艳,田吉,何兵,等.四川楤木根茎叶嫩芽中多糖含量的紫外分光光度法测定[J].时珍国医国药,2011,22(7):1653-1654.
[9]蔡静.飞天蜈蚣七多糖提取纯化工艺、结构及抗氧化活性研究[D].西安:西北大学,2011.
[10]包淑云,赵志刚,陈靠山,等.超声波提取棉花根多糖的工艺研究[J].时珍国医国药,2013,24(1):118-119.
[11]刘延吉,李峰,郭迎春,等.苯酚-硫酸法测长白楤木根中多糖的含量[J].安徽农业科学,2006,34(5):830;856.
[12]尹龙萍,邓毅,贾伟,等.山豆根粗多糖最优化提取工艺研究[J].中药材,2007,30(3):351-353.
[13]Wang Junlong,Zhang Ji,Wang Xiaofang,et al.A comparison study on microwave-assisted extraction of Artemisia sphaerocephala polysaccharides with conventional method:molecule structure and antioxidant activities evaluation[J].Int J Biol Marchomol,2009,45:483-492.
[14]陈文燕,林燕.超声波辅助提取杨桃叶多糖的工艺研究[J].现代食品科技,2013,29(5):1100-1102.
[15]Li Pengwei,Zhang Jingya,Tong Yan,et al.Study on extraction process of polysaccharides from Chrysanthemum[J].Chin Food Sci,2012,1(1):17-19.
[16]Ye Chun,Han Na,Teng Fukang,et al.Extraction optimization of polysaccharides of Schisandrae Fructus and evaluation of their analgesic activity[J].Int J Biol Macromol,2013,57:291-296.
[17]Zhu C,Liu X.Optimization of extraction process of crude polysaccharides from pomegranate peelbyresponsesurface methodology[J].Carbohydr Polym,2013,92(2):1197-1202.
[18]Zhang J,Wang H,Xue Y.Cardioprotective and antioxidant activities of a polysaccharide from the root bark of Aralia elata(Miq.)seem[J].Carbohydr Polym,2013,93(2):442-448.
[19]Choi R J,Shin E M,Jung H A,et al.Inhibitory effects of kaurenoic acid from Aralia continentalis on LPS-induced inflammatory response in RAW264.7 macrophages[J]. Phytomedicine,2011,18(8/9):677-682.
(责任编辑 荀志金)
Ultrasonic extraction and determination of polysaccharides from Aralia chinensis L.root
HOU Honghong,WANG Yifeng,ZHAO Bo,JIN Jie,CAO Jiahao,LI Xiaojiao
(College of Life Sciences,Northwest Normal University,Lanzhou 730070,China)
To optimize ultrasonic extraction of polysaccharides from the root of Aralia chinensis L..The polysaccharide yield of the root bark of A.chinensis was used to measure the extraction efficacy.Water extraction was followed by alcohol precipitation.Four factors including time,temperature,ultrasonic power and solid-liquid ratio were optimized by orthogonal design method.The yield of A.chinensis L.root polysaccharides was 11.13%under the optimum extracting conditions:ratio of solid to liquid 1∶30(g/mL),80min,70℃,ultrasonic power 100 W.The polysaccharides extracted was stable.And the method is accurate,reliable and reproducible.The developed extraction process under optimized condition makes effective extraction of polysaccharide from the root bark of Aralia chinensis feasible.
ultrasonic extraction;Aralia chinensis;polysaccharides;orthogonal experiment
R286
A
1672-3678(2015)02-0019-00
10.3969/j.issn.1672-3678.2015.02.004
2014-10-08
甘肃省自然科学基金(1208RJZA-126);兰州市科技局技术支撑项目(2013-4-89)
侯宏红(1989—),女,甘肃天水人,硕士研究生,研究方向:植物化学;王一峰(联系人),教授,E-mail:wangyifeng6481@aliyun.com
