白色LED复合光谱对4种淡水微藻的影响
2015-11-11陈晓娣韩萍芳
陈晓娣,吴 洁,邓 芸,朱 凯,韩萍芳,顾 军
(1.南京工业大学 生物与制药工程学院,江苏 南京 211800;2.南京大学 昆山创新研究院,江苏 昆山 215347;3.南京大学 物理学院,江苏 南京 210093)
白色LED复合光谱对4种淡水微藻的影响
陈晓娣1,2,吴 洁1,2,邓 芸2,3,朱 凯2,3,韩萍芳1,顾 军2,3
(1.南京工业大学 生物与制药工程学院,江苏 南京 211800;2.南京大学 昆山创新研究院,江苏 昆山 215347;3.南京大学 物理学院,江苏 南京 210093)
利用光效高、耗能小的LED光谱作为光源培养微藻能够降低微藻培养的成本,促进微藻培养实现工业化。比较了6种已市场化的,具有不同光强、不同光谱组成的白色LED复合光谱(1号,光强2 162 lx;2号,光强2 227 lx;3号,光强2 794 lx;4号,光强4 587 lx;5号,光强5 356 lx;6号,光强6 244 lx)对4种淡水微藻生长情况和叶绿素含量的影响。结果发现:四尾栅藻在5号光源下,有最大生物质质量浓度和比生长速率,分别为2.89 g/L和0.32 g/(L·d)(以细胞干质量计);钝顶螺旋藻在4号光源下,有最大生物质质量浓度和比生长速率,分别为5.05 g/L和0.33 g/(L·d);布朗葡萄藻在6号光源下,有最大生物质质量浓度和比生长速率,分别为1.22 g/L和0.25 g/(L·d);而集胞藻在光强较小的光源下生长较好,当光强为2 162 lx时,生物质质量浓度和比生长速率分别为3.05 g/L和0.22 g/(L·d)。在光强较低的情况下,光质的红蓝比对四尾栅藻和布朗葡萄藻的生长没有显著影响(p<0.05);与蓝光相比,红光更利于集胞藻和钝顶螺旋藻的生长,分别在红蓝比(R/B)为11.7的1号光源和4号光源下有最大藻细胞密度3.05和5.05 g/L。四尾栅藻、钝顶螺旋藻和布朗葡萄藻的单位水体内叶绿素含量与比生长速率成正比,而单位质量干藻细胞内的叶绿素含量随光强的增大而有所降低。
白色LED复合光谱;微藻;生物质质量浓度;比生长速率;叶绿素含量
微藻生物能源是一种具有发展潜力的、可再生的生物质能源,但是微藻培养成本高,这是限制其大规模培养的主要因素之一[1-3]。微藻是一种光能自养型生物,光照是其生长的主要能量来源之一[4]。光的性质,如光波长和光密度对微藻的生长速率和光合色素的合成有很大的影响[5]。
与普通的荧光灯相比,LED具有光波段窄、光效率高、寿命长和能耗小等特点,作为一种新型节能光源,研究其对微藻生长和生理特性的影响受到越来越多的关注[6-15]。苗洪利等[6]以纤细角毛藻和亚心形扁藻为研究对象,发现LED集成光源作为微藻生长的照明光源比荧光灯更有优势。Fu等[7]发现在其他因素最优时,660 nm的LED灯比680 nm的 LED灯更有利于促进小球藻(Chlorella vulgaris)生长。毛安君等[8]发现海生小球藻和等鞭金藻在饱和光强以下,生长速率随着光强的增大而增大,并且不同颜色的LED光对同一种藻的饱和光强不同。徐明芳等[9]发现LED集成光电板辐射红光及红、蓝组合双波长光比白色日光灯组更适合钝顶螺旋藻的生长,包括细胞干质量、叶绿素、藻胆蛋白的增加。然而,他们的研究基本上偏重于单色LED光谱或者单纯的双色LED光谱对微藻生长的影响,而微藻作为一个生命体,不同波谱范围的光对其生理特性都有一定的影响,如:波长为280~315 nm的光对微藻形态与生理过程的影响极小;315~400 nm的光能够影响叶绿素的吸收以及光周期效应;在400~520 nm(蓝)时,叶绿素与类胡萝卜素吸收比例最大,对光合作用影响最大;在520~610 nm(绿)时,色素的吸收率不高;在610~720 nm(红)时,叶绿素吸收率低,但是对光合作用与光周期效应有显著影响;在720~1 000 nm时,吸收率低,刺激细胞延长,影响微藻繁殖[16]。白色LED复合光谱波长范围广,可能更利于微藻生长,因此研究白色复合光谱对微藻的影响也非常重要。
本文选择已市场化的6种白色LED复合光谱为4种淡水微藻生长提供光源,研究不同光强、不同光谱组成对微藻生长和叶绿素含量的影响,为提高光源利用效率、降低微藻光照成本提供数据支持。
1 材料和方法
1.1 藻种
实验藻种为四尾栅藻(Scenedesmus quadricanda)、集胞藻(Synechocystis sp.PCC6803)、钝顶螺旋藻(Spirulina platensis)和布朗葡萄藻(Botryococcus braunii),均购于中国科学院水生生物研究所藻种库。
1.2 培养基与培养条件
四尾栅藻、集胞藻和布朗葡萄藻均采用BG-11标准培养液[17],钝顶螺旋藻采用 Spirulina培养液[18]。取100 mL培养液于250 mL锥形瓶中,初始接种密度为OD680≈0.1,培养温度为27℃,光暗周期为12 h:12 h。每个实验组设置3个平行试验,每组培养瓶置于单独的长方体小格中,光源位于瓶正上方4 cm处,每天定时摇瓶数次(为保证结果的可靠性,每次取样时在同一个瓶子内的3个不同地方取样,得到的实验结果的误差均小于0.005)。所有的实验结果取平均值。
1.3 光源
实验所用光源为6种复合LED光谱,光谱的性质使用钢质测光积分球(远方公司,SIS-2-2.0 m),以蓝光芯片和Yaga荧光粉为激发光源测定,结果见表1。
1.4 测量方法
1.4.1生物量的测定
根据文献[19]的方法,并加以改进:将藻液超声均质后,用紫外分光光度计测定其在680 nm处的光密度值(OD680),并根据光密度与干质量(dry cell wight,DCW)(以1 g干细胞质量计)的相关关系,把光密度换算成藻细胞干质量X(g/L)。4种藻种的光密度与藻细胞干质量的关系分别见式(1)~(4)。


表1 白色LED复合光谱的主要性质Table 1 Characteristics of LEDs
1.4.2 比生长速率μ的测定
用比生长速率来表示藻类的生长变化,见式(5)。
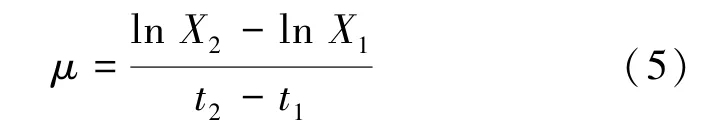
式中:X1、X2分别为培养时间为t1、t2时的藻细胞生物量。
1.4.3 叶绿素含量
采用分光光度法测定叶绿素含量[20],取定量的藻液离心浓缩后,加入体积分数为90%的丙酮,在组织研磨器中充分研磨,在3 400 r/min下离心10 min,将上清液倒入10 mL容量瓶中。重复1~2次,使沉淀为白色为止。再用90%的丙酮定容。测定上清液在663和645 nm处的吸光度A,用90%的丙酮做空白。根据Arnon[21]计算公式:

式中:ρa、ρb和ρT分别为叶绿素a、叶绿素b和总叶绿素的质量浓度,mg/L;A663和A645为上清液在663和645 nm处的吸光度;N为稀释倍数。
1.5 数据分析
试验获得的原始数据经Excel 2007处理后,使用Origin 8.1(美国Origin Pro公司)作图;方差分析使用SPSS 13.0(美国SPSS公司),用Duncan新复极差法进行多重比较。
2 结果与讨论
2.1 白色LED复合光谱对4种微藻生物量的影响
实验开始时,微藻在每个LED光谱下的生长状态相同,由于布朗葡萄藻的生长较慢,当其达到稳定期时,其余的3种微藻已趋于衰亡期,此时停止培养,培养周期为21 d。当温度、pH和底物浓度不是限制因素时,6种白色LED复合光谱对4种微藻的生物量和比生长速率的影响,结果如图1和图2所示。
由图1可知:在微藻生长的延滞期内,6种光源对微藻生长的影响差别不明显,但是从对数生长期开始,不同光源对4种淡水微藻生物量的影响区别较显著。四尾栅藻、集胞藻和钝顶螺旋藻在不同的光源下都能够生长,但是不同光源下的生长曲线不同;而布朗葡萄藻只能利用光强较大的4、5和6号光源进行光合作用,在其他的光源作用下的生物量变化不明显。
因为不同微藻生长周期不同,故取4种微藻对数生长期的比生长速率来比较不同光源对4种微藻生长的影响(图2)。
由图2可知:四尾栅藻在1、2和3号光源下对数生长期的比生长速率没有显著差异性(p>0.05),分别为0.12、0.12和0.14 g/(L·d),说明在光强较低的情况下,光强是四尾栅藻生长的最大限制因素,光谱的红蓝比对四尾栅藻的比生长速率影响不大。随着光强的增大,四尾栅藻在5号光源下的比生长速率达到最大(0.32 g/(L·d)),且与前4个光源下的生长速率相比,差异极显著(p<0.05),随着光强的继续增大,6号光源下的生长速率却比5号光源降低0.05 g/(L·d);说明四尾栅藻的饱和光强在5 356 lx左右,超过饱和光强后,生长速率反而降低。
集胞藻对光源的适应性较强,在这6种光源下都能生长。集胞藻在1号光源下的生长情况最好,生物质质量浓度和比生长速率分别为3.05 g/L和0.21 g/(L·d);而2号光源下生长最差,生物质质量浓度和比生长速率分别为为 2.30 g/L和 0.13 g/(L·d),说明光质是集胞藻生长的最大限制因素,红光能够促进集胞藻生长。随着光强的增大,集胞藻的比生长速率有所下降,说明集胞藻适合在光强较小的光源下生长。
钝顶螺旋藻在不同光源下的比生长速率差异极显著(p<0.05)。其在1号光源下的生物质质量浓度和比生长速率分别为 2.23 g/L和 0.14 g/(L·d),都高于2号光源下的结果(1.65 g/L和0.10 g/(L·d))。这与徐明芳等[9]得到的实验结果一致,说明钝顶螺旋藻在红光下生长较好。随着光强的增大,钝顶螺旋藻在4号光源下达到最大生物质质量浓度和比生长速率(5.05 g/L和 0.33 g/(L·d)),随着光强继续的增大,生物质质量浓度和比生长速率却有所下降,这可能有两方面的原因:已经达到钝顶螺旋藻的最大饱和光强,随着光强增大,生物质质量浓度和比生长速率下降[22];光质对钝顶螺旋藻的影响大于光强的影响[23]。
布朗葡萄藻的生长情况与光强的大小有一定的相关性。在光强较小的前3个光源下生长变化不明显,培养21 d后其生物质质量浓度仍然很低,分别为0.13、0.13和0.17 g/L(图1),随着光强的增大,其生物质质量浓度和比生长速率都增大,6号光源的生物质质量浓度和比生长速率比4号和5号光源分别大0.56 g/L、0.09 g/(L·d)和0.37 g/L、0.03 g/(L·d)。本文选择的6种光源均未达到其饱和光强。
2.2 白色LED复合光谱对4种微藻叶绿素含量的
影响
光是植物生长的主要环境因素之一,不仅为植物光合作用提供所需的能量,而且触发植物形态变化、质体分化、新陈代谢等重要反应[24-25]。植物色素能够吸收光能产生一系列的生化反应,但是不同植物色素吸收的波长不同[26]。6种白色LED复合光谱对4种微藻叶绿素(Chl)a、叶绿素b和总量的影响见表2。

图1 6种白色LED复合光谱下的微藻的生长曲线Fig.1 Growth curves of microalgae under different LED
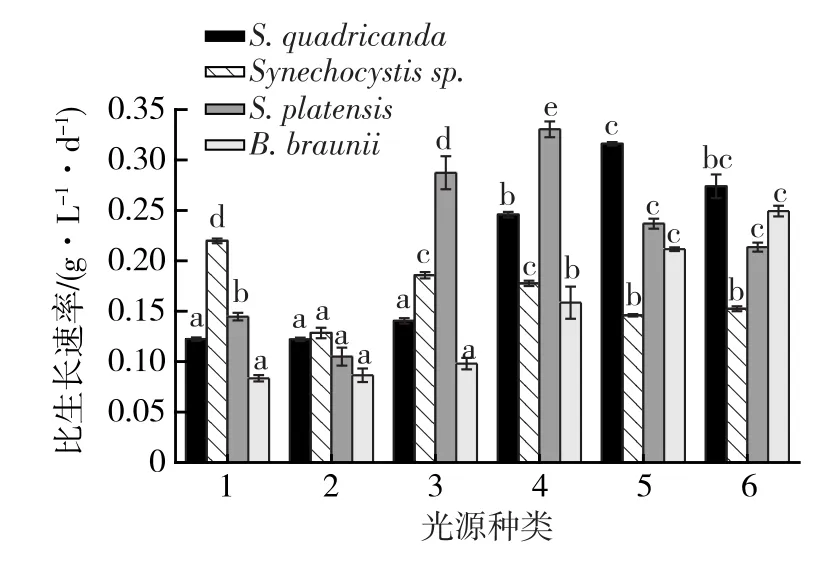
图2 4种微藻在不同光源下对数生长期的比生长速率Fig.2 Growth rates of microalgae under different LED

表2 不同白色LED复合光源对微藻单位水体内叶绿素含量的影响Table 2 Effects of LED on the chlorophyll content of microalgae mg/L
由表2可知:单位水体内不同白色LED复合光谱下的4种微藻的叶绿素a、b和总叶绿素的含量不同。四尾栅藻在5号光源下的叶绿素量最高(10.27 mg/L);钝顶螺旋藻在4号光源下叶绿素量最高(15.81 mg/L);布朗葡萄藻在6号光源下叶绿素量最高(9.11 mg/L);而集胞藻在各个光源下的叶绿素量都较低。因为集胞藻的个体较小(3~5 μm),镜检不能判断是否破碎,研磨的时候可能破碎率偏低,从而造成叶绿素量较低,不能够完全反映其真实的叶绿素量。故集胞藻的叶绿素含量本文不再讨论,需要用别的检测方法,如流式细胞术等[27]确定破碎率。
与生长速率相对应,布朗葡萄藻单位水体内的叶绿素含量在所选用光强范围内,一直随着入射光强的增大保持上升趋势。四尾栅藻和钝顶螺旋藻在入射光强小于饱和光强时,叶绿素含量随着光强的增大而增多,四尾栅藻在6号光源下叶绿素含量开始下降,钝顶螺旋藻的叶绿素含量从5号光源开始下降。叶绿素含量随着光照强度的增加呈低—高—低的趋势,这种现象与欧阳峥嵘等[28]和严美姣等[29]的报道结果一致。欧阳峥嵘等[28]分析,这是因为藻类对光照强度有一个饱和点,低于光饱和点,随着光强的增加,藻类的光合速率加快;超过光饱和点,藻类的光合速率不再增加,甚至减弱、停止。布朗葡萄藻的叶绿素量在所选用光强范围内一直保持上升趋势,可能是因为所选的6种光源均未达到其饱和光强。单位水体叶绿素含量的变化与藻类密度或生物量的变化紧密相关:在不同的白色LED复合光谱下,3种微藻的叶绿素量与其生长速率成正比,生长速率越快,叶绿素含量越高。刘青等[30]也报道了相似的结果。
由于单位水体内微藻的叶绿素含量受微藻密度影响,因此将之换算成单位生物量的微藻的叶绿素含量,见图3,由此反映单位质量藻体的叶绿素量。布朗葡萄藻的单位藻细胞干质量的叶绿素含量最高,而钝顶螺旋藻含量最低。除了钝顶螺旋藻,其他2种藻在2号光源下的叶绿素含量高于1号光源,这可能是因为2号光源中蓝光的比例大于1号光源,而在蓝光下,叶绿素的吸收比例较大[30-32]。之后随着光强的增大,布朗葡萄藻单位生物量的叶绿素含量反而降低,其他2种微藻的叶绿素含量变化不明显。这是因为光强对于微藻光合活力的影响主要是通过影响藻胆体捕光色素的合成及其构成比例来实现的。曾文炉等[31]发现耐强光的盐泽螺旋藻品系3F,在强光下其叶绿素和藻胆蛋白的含量呈下降趋势,胡萝卜素和β-胡萝卜素含量也有所降低。对比在1号和2号光源下3种微藻的叶绿素量可以发现:四尾栅藻和布朗葡萄藻在红蓝比为3.4时,单位藻细胞干质量的叶绿素量较高,说明叶绿素的合成受到蓝光的促进,在红光下合成较少[30-32]。而却在红蓝比为11.7的1号光源下钝顶螺旋藻的叶绿素量较高,与徐明芳等[9]研究结果一致。这可能是因为螺旋藻光合色素的吸收区主要在红光区,光合效率较高,产生的光合产物多。而Miguel等[33]对红光促进螺旋藻生长作用的机制提出了不同的解释:红光环境下,螺旋藻细胞中的藻蓝叶黄素量下降而β-胡萝卜素上升,后者可以吸收300~500 nm的光波,从而有助于保护叶绿素a在高光强下免受氧化;而在弱光照条件下,β-胡萝卜素则主要发挥其作为辅助色素的功效,专职于捕获光能并将其有效地传递给叶绿素a。
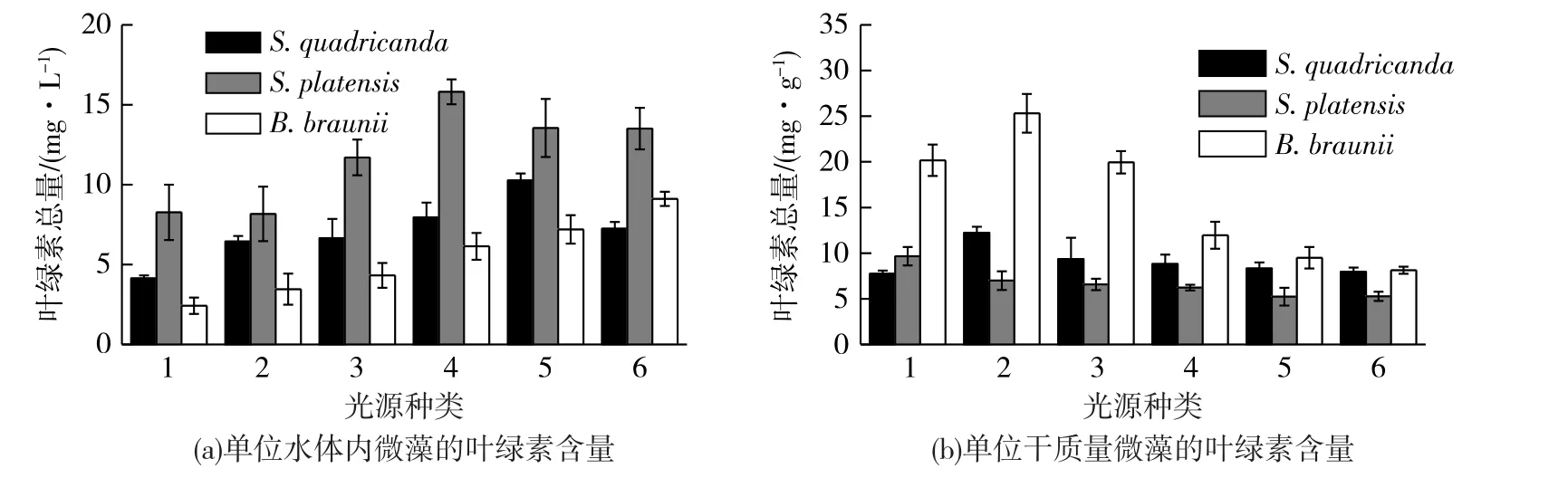
图3 不同光源下微藻的叶绿素总量Fig.3 Chlorophyll content of microalgae under different LEDs.The error bars represent the standard deviation of the triplicate samples.
3 结论
四尾栅藻、集胞藻和钝顶螺旋藻能够利用所选的6种白色LED复合光谱生长,而布朗葡萄藻只能利用4、5和6号光源生长,其他光源下基本不生长。不同的光谱对微藻的生物量、比生长速率以及叶绿素含量的影响也不相同:四尾栅藻和钝顶螺旋藻的生物量和比生长速率在未达到饱和光强前,随着光强的增大而增大;超过饱和光强后,随着光强的增大,比生长速率降低。布朗葡萄藻对光强很敏感,只能利用光强较大的光源生长,所测试6种光源均未达到其饱和光强。集胞藻在弱光下比生长速率较大,生物量积累较多。4种微藻对光强大小的需求顺序为布朗葡萄藻、四尾栅藻、钝顶螺旋藻和集胞藻。在光强较小的情况下,光质的红蓝比对四尾栅藻和布朗葡萄藻的生长没有影响,而红光能够促进集胞藻和钝顶螺旋藻生长。
四尾栅藻、钝顶螺旋藻和布朗葡萄藻单位水体的叶绿素含量与它们的生长速率趋势一致:对光照强度有一个饱和点,低于光饱和点,随着光强的增加,叶绿素含量增加;超过光饱和点,叶绿素含量有所下降。布朗葡萄藻单位藻细胞干质量下的叶绿素含量最高,而钝顶螺旋藻的叶绿素含量最低。四尾栅藻和布朗葡萄藻在2号光源下的叶绿素含量高于1号光源,是因为其光合色素受到蓝色光的促进,在红蓝比低的光源下叶绿素吸收比例较高;而钝顶螺旋藻的叶绿素含量在红光下较高,是因为螺旋藻光合色素的吸收区主要在红光区,光合效率较高,产生的光合产物多。
[1]高春芳,余世实,吴庆余.微藻生物柴油的发展[J].生物学通报,2011,46(6):1-5.
[2]邹树平,吴玉龙,杨明德,等.微藻的综合开发利用[J].水产科学,2007,26(3):179-181.
[3]胡洪营,李鑫,于茵,等.藻类生物质能源[M].北京:科学出版社,2011.
[4]Hsieh C,Wu W.A novel photobioreactor with transparent rectangular chambers for cultivation of microalgae[J].Biochem Eng J,2009,46(3):300-305.
[5]Mata T M,Martins A N A,Caetano N S.Microalgae for biodieselproduction and other applications:a review[J].Renew Sustain Energy Rev,2010,14(1):217-232.
[6]苗洪利,周晓光,刘逢学,等.LED光谱对纤细角毛藻和亚心形扁藻生长的影响[J].光学学报,2010,30(4):1101-1105.
[7]Fu W,Gudmundsson O,Feist A M,et al.Maximizing biomass productivity and cell density of Chlorella vulgaris by using lightemitting diode-based photobioreactor[J].J Biotechnol,2012,161(3):242-249.
[8]毛安君,王晶,林学政,等.光谱对小球藻和等鞭金藻生长的影响[J].光谱学与光谱分析,2008,28(5):991-994.
[9]徐明芳,李贻玲.钝顶螺旋藻在LED光电板式光生物反应器中的培养研究[J].海洋科学,2001,25(2):42-45.
[10]苗洪利,孙丽娜,田庆震,等.LED单色光谱及复合光谱对赤潮优势种中肋骨条藻生长的作用[J].中国海洋大学学报:自然科学版,2011,41(10):107-110.
[11]闫新房,丁林波,丁义,等.LED光源在植物组织培养中的应用[J].中国农学通报,2009,25(12):42-45.
[12]Fu W,Gudmundsson O,PagliaG,etal.Enhancementof carotenoid biosynthesis in the green microalga Dunaliella salina with light-emitting diodes and adaptive laboratory evolution[J]. Appl Microbiol Biotechnol,2013,97(6):2395-2403.
[13]Lamb J J,Eaton-Rye J J,Hohmann-Marriott M F.An LED-based fluorometer for chlorophyll quantification in the laboratory and in the field[J].Photosyn Res,2012,114(1):59-68.
[14]Chen Y,Lee M.Double-powerdouble-heterostructure lightemitting diodes in microalgae, Spirulina platensis and Nannochloropsis oculata,culture[J].J Marine Sci Technol,2012,20(2):233-236.
[15]刘春朝,刘瑞,王锋.微藻培养过程的光特性研究进展[J].生物加工过程,2011,9(6):69-76.
[16]潘瑞炽.植物生理学[M].北京:高等教育出版社,2004:58-63.
[17]Stanier R Y,Kunisawa R,Mandel M,et al.Purification and properties of unicellular blue-green algae(Order chroococcales)[J].Bacteriol Rev,1971,35(2):171-205.
[18]Aiba S,Ogawa T.Assessment of growth yield of a blue-green alga:Spirulina platensis,in axenic and continuous culture[J].J General Microbiol,1977,102:179-182.
[19]Leduy A,Therien N.Cultivation of Spirulina maxima in an annular photo-chemical reactor[J].Can J Chem Eng,1979,57(4):489-495.
[20]国家环境保护总局,水和废水监测分析方法编委会.水和废水监测分析方法[M].4版.北京:中国环境科学出版社,2002.
[21]Arnon D I.Copper enzymes in isolated chloroplastspolyphenoloxidase in beta-vulgaris[J].Plant Physiol,1949,24(1):1-15.
[22]汪世中.优化钝顶螺旋藻生物量生长条件的研究[J].郑州轻工业学院学报,1992,7(1):47-51.
[23]张爱琴,姜泉,谢小军,等.不同光质对钝顶螺旋藻生长和放氧放氢活性的影响[J].植物生理学通讯,1989(4):23-26.
[24]顾雪松,陈章良,朱玉贤.光敏色素与光调控[J].植物学报,1997,39(7):675-681.
[25]王铭,李涛,李爱芬,等.光照、温度和pH对雨生红球藻光合特性的影响[J].水生生物学报,2009,33(3):400-405.
[26]褚四敏,陈敏洁,贾文姝,等.光质对植物组织培养的影响[J].安徽农业科学,2011,39(2):665-666.
[27]于洋,孔繁翔,王美林,等.应用流式细胞技术研究铜对藻细胞膜完整性及脂酶活性的影响[J].应用与环境生物学报,2006,12(5):706-709.
[28]欧阳峥嵘,温小斌,耿亚红,等.光照强度、温度、pH、盐度对小球藻(Chlorella)光合作用的影响[J].武汉植物学研究,2010,28(1):49-55.
[29]严美姣,王银东,胡贤江.光照对小球藻、斜生栅藻生长速率及叶绿素含量的影响[J].安徽农学通报,2007,13(23):27-29.
[30]刘青,张晓芳,李太武,等.光照对4种单胞藻生长速率、叶绿素含量及细胞周期的影响[J].大连水产学院学报,2006,21(1):25-30.
[31]曾文炉,丛威,蔡昭铃,等.螺旋藻的营养方式及光合作用影响因素[J].植物学通报,2002,19(1):70-77.
[32]王伟.光质对中华盒形藻生长及生化组成的影响[J].武汉植物学研究,1999,17(3):197-200.
[33]Miguel O,Eirik O D.Effects of light intensity and quality on the growth rate and photosynthetic pigment content of Spirulina platensis[J].J Appl Phycol,1990,2:97-104.
(责任编辑 荀志金)
Effects of LEDs on cultivation of four species of freshwater microalgae
CHEN Xiaodi1,2,WU Jie1,2,DENG Yun2,3,ZHU Kai2,3,HAN Pingfang1,GU Jun2,3
(1.College of Biotechnology and Pharmaceutical Engineering,Nanjing Tech University,Nanjing 211800,China;
2.Kunshan Innovation Institute of Nanjing University,Kunshan 215347,China;3.Physics School,Nanjing University,Nanjing 210093,China)
Using LED that has the high efficient of light and low energy lose as light source can decrease the cost of microalgae cultivation and promote the industrialization.We compared the influence on the growth of four microalgae under six market-oriented white composite LED light that have different intensity and spectrum.The six light source are No.1 with 2 162 lx,No.2 with 2 227 lx,No.3 with 2 794 lx,No.4 with 4 587 lx,No.5 with 5 356 lx,and No.6 with 6 244 lx.Under No.5 source of light,Scenedesmus quadricanda has the greatest biomass concentration about 2.89 g/L and the ratio of growth about 0.32 g/(L·d)(dry cell weights);Spirulina platensis has the same type of values showed respectively about 5.05 g/L and 0.33 g/(L·d)under the No.4 source of light.Under the No.6 source of light,Botryococcus braunii has the greatest biomass concentration of 1.22 g/L and the ratio of growth of0.25 g/(L·d),while the growth of Synechocystis sp.PCC 6803 is better under less light intensity No.1 light source,the biomass concentration is 3.05 g/L and the ratio of growth is 0.22 g/(L·d).Under the situation of lower light intensity,the Red/Blue value of light has no obvious effect on the growth of Scenedesmus quadricanda and Botryococcus braunii.(P<0.05).Comparing to blue light,red light is better for the growth of Synechocystis sp.PCC 6803 and Scenedesmus quadricanda.With the No.1 and No.4 light source which Red/Blue is 11.7,the greatest cell density is 3.05 g/L and 5.05g/L.The ratio between chlorophyll per water and the rate of growth is positive in Scenedesmus quadricanda,Spirulina platensis and Botryococcus braunii,but the contents of chlorophyll in dry weight parts per algae have the negative relationship with the intensity of light.
LED;microalgae;biomass;growth rates;chlorophyll content
Q945
A
1672-3678(2015)01-0094-07
10.3969/j.issn.1672-3678.2015.01.016
2013-08-07
江苏省自然科学基金(BK2012218);昆山市可持续发展实验区建设科技专项(KS1204)
陈晓娣(1988—),女,河南郑州人,硕士研究生,研究方向:微藻生物技术;韩萍芳(联系人),教授,E-mail:hpf@njtech.edu.cn
