干燥工艺对锁掷酵母中类胡萝卜素的影响
2015-11-11李海伟张方方王昭舜张伟国
李海伟,钱 和,张方方,王昭舜,韩 梅,綦 超,张伟国
(1.江南大学 食品学院,江苏 无锡 214122;2.泰州圣泰科红外科技有限公司,江苏 泰州 225300;3.江南大学 工业生物技术教育部重点实验室,江苏 无锡 214122)
干燥工艺对锁掷酵母中类胡萝卜素的影响
李海伟1,钱 和1,张方方1,王昭舜2,韩 梅3,綦 超1,张伟国3
(1.江南大学 食品学院,江苏 无锡 214122;2.泰州圣泰科红外科技有限公司,江苏 泰州 225300;3.江南大学 工业生物技术教育部重点实验室,江苏 无锡 214122)
以玉米浆为培养基生产锁掷酵母,对干燥后锁掷酵母的质量进行研究,比较不同干燥方式对锁掷酵母中类胡萝卜素以及干酵母粉亮度值L、红色值a、黄色值b的影响。结果表明:冷冻干燥能较好地保持锁掷酵母中的类胡萝卜素,并且对其酵母粉的L、a、b值影响较小。选择-70℃冷冻干燥,干酵母粉的L、a、b值分别为64.55、18.44和32.71,类胡萝卜素的保持率达到88.87%。
玉米浆;锁掷酵母;干燥工艺
鲜酵母的干燥是酵母产品生产过程中非常重要的一个环节,干燥的温度、方法直接影响产品的干燥速率及质量。最适宜的干制工艺条件是在干燥过程中所用的干燥条件能符合最高技术经济指标的标准,即:干燥时间最短、能耗最低和产品的质量最高[1]。锁掷酵母的干制也是如此。假如干燥方法选择不当或干燥过程中温度过高、干燥速度太快,酵母细胞受损害的程度越大,产品的质量就越差,酵母中类胡萝卜素的损失就较大。
类胡萝卜素是一类呈橙红色、红色或黄色的多烯类化合物,它广泛存在于植物和微生物中,是一种非常强的抗氧化剂,可以有效地清除氧自由基,它不仅具有转化维生素A的生物活性,同时还具有预防癌症和心血管疾病等多种生理功能[2-4],在食品工业、医药工业、饲料和养殖业方面得到广泛的应用。类胡萝卜素的结构中含有共轭双键,对环境条件特别敏感,许多生物、物理和化学的因素都会影响类胡萝卜素的稳定性[5]。
酵母的干燥设备有滚筒式干燥机、流化床干燥设备、喷雾干燥装置和箱式干燥器等。目前,酵母工业的干燥一般采用流化床干燥设备[6]:发酵液经过真空吸滤后的鲜酵母经挤压机挤压成条状,直接进入干燥器干燥。滚筒式干燥机对酵母醪的含水量要求不高,操作简单方便。箱式干燥器适合小型生产且对酵母粉要求不高的情况。喷雾干燥要求发酵液含干物质在25%~30%(质量分数)及以上,有时需要使用刮板式真空蒸发器将发酵液浓缩。
笔者采用真空干燥、冷冻干燥、热风干燥、红外干燥、微波干燥和喷雾干燥加工锁掷酵母,以类胡萝卜素含量和干燥后产品的亮度值(L)、红色值(a)、黄色值b值为其质量指标,采用高效液相色谱(HPLC)法测定类胡萝卜素含量,TC-PG型全自动色差计测定产品的L、a、b值,比较不同干燥方法对锁掷酵母质量的影响。
1 材料与方法
1.1 材料和试剂
菌种:锁掷酵母(Sporidiololus pararoseus),笔者所在实验室成员分离并保藏。
β-胡萝卜素(标准品),Sigma公司;葡萄糖(食品级),苏州通都晟精细化工有限公司;玉米浆(食品级),上海缘肽生物技术有限公司;KH2PO4(AR),江苏科伦多食品配料有限公司;MgSO4·7H2O(AR),上海牧泓实业有限公司;乙腈(色谱纯)、酵母膏(BR),国药集团化学试剂有限公司;
1.2 设备与仪器
DHP030型恒温培养箱、ZK-82B型真空干燥箱、WBG-600A型微波干燥试验装置、电热鼓风干燥箱,上海试验仪器厂;LGJ-18冷冻干燥机,北京四环科学仪器厂;红外干燥箱,泰州圣泰科红外科技有限公司;SD-1000压力式喷雾干燥器,埃朗科技国际贸易(上海)有限公司;KH-3HMON微波干燥杀菌机,山东科弘微波有限公司;TC-PG型全自动色差计,北京光学仪器厂生产;分析天平,上海天平仪器厂;高效液相色谱仪,美国安捷伦公司。
1.3 培养基
斜面活化培养基(g/L):蛋白胨10,葡萄糖21,酵母膏9,琼脂15;NaOH溶液调pH 6.0,121℃灭菌20 min。
种子培养基(g/L):玉米浆 19,葡萄糖 31,MgSO4·7H2O 0.5,KH2PO41;NaOH溶液调pH 6.0,葡萄糖115℃灭菌15 min,其他121℃灭菌20 min。
液态发酵培养基(g/L):玉米浆21,葡萄糖85,MgSO4·7H2O 0.5,KH2PO41,(NH4)2SO45;NaOH溶液调pH 6.0,葡萄糖115℃灭菌15 min,其他121℃灭菌20 min。
1.4 锁掷酵母菌体的获得
液态深层发酵培养(5 L发酵罐):发酵罐中装液量2.0 L,接种量5%,通风1 L/min,流加50%氨水控制pH,通过流加消泡剂消泡,根据溶氧需求适当调节转速,在(28±1)℃条件下培养60~72 h。
1.5 干燥工艺
1.5.1 真空干燥条件
真空干燥温度为40℃、真空度为0.1 MPa,干燥至含水率小于等于10%。
1.5.2 红外干燥条件
红外干燥温度为40℃、辐射距离为14 cm,干燥至含水率小于等于10%。
1.5.3 鼓风干燥条件
热风干燥温度为40℃,风速为2.3 m/s,干燥至含水率小于等于10%。
1.5.4 微波干燥条件
微波干燥温度为40℃,干燥至含水率小于等于10%。
1.5.5 冷冻干燥条件
冷冻干燥冷阱温度为-70℃,真空度为0.1 MPa,干燥至含水率小于等于10%。
1.5.6 喷雾干燥条件
进风口温度为150℃,出风口温度为40℃,流速0.2 L/h,干燥至含水率小于等于10%。
1.6 样品及标准品的制备
1.6.1 标准品制备
准确称取1.000 0 g的β-胡萝卜素标准品,用色谱级丙酮定容至1 L,配制成质量浓度为1 g/L的原液,分别稀释成质量浓度为 0.05、0.15、0.25、0.35和0.45 g/L的标准液,摇匀,用0.45 μm微孔滤膜滤过,弃去初滤液,取续滤液,即得标准品溶液,4℃保存备用。
1.6.2 类胡萝卜素粗提液的提取及供试品溶液的制备
发酵液离心(6 000 r/min、15 min),获得菌体,蒸馏水洗涤2次并离心(6 000 r/min、15 min),将洗涤后的锁掷酵母保存一部分,剩余的分别进行真空干燥、冷冻干燥、鼓风干燥、红外干燥、微波干燥和喷雾干燥(干燥至含水率小于等于10%),将洗涤后的锁掷酵母和干燥后样品配制成100 g/L的菌悬液,用2 mol/L的HCl进行酸热破壁,离心弃上清液获得破壁粗菌体,丙酮萃取得类胡萝卜素粗提液。将上述类胡萝卜素粗提液摇匀,用0.45 μm微孔滤膜滤过,弃去初滤液,取续滤液,即得供试品溶液,4℃保存备用。
1.7 分析方法
1.7.1 酵母水分含量测定
水分含量测定采用GB/T 5009.3—2003方法。
1.7.2 加标回收率
加标回收率就是在测定样品的同时,于一样品的子样中加入一定量的标准物质进行测定,将其测定结果扣除样品的测定值,而得到加入标准物质的回收率。其计算公式:

1.7.3 色泽的测定
利用TC-PG型全自动色差计,测定锁掷酵母的色泽参数[7-11]。分别测定鲜酵母初始色泽参数L0、a0、b0值和脱水后酵母的L、a、b值。每个处理的样品重复测定3次,色差仪的3个读数分别具有不同的功能。L(或L0)值反映的是颜色的明亮程度,0表示的是黑色,100表示的是白色。a(或a0)值反映的是红色或绿色物质的浓度,a(或a0)>0表示的是颜色偏红,a(或a0)<0表示的是颜色偏绿。b(或b0)值反映的是橙色或蓝色物质的浓度,b(或b0)>0表示的是颜色偏橙,b(或b0)<0表示的是颜色偏蓝;按式(2)~式(3)计算干酵母的色差值ΔE和色度ΔC。
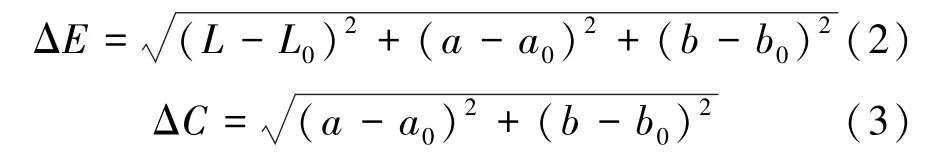
1.7.4 类胡萝卜素的测定
采用反相高效液相(RP-HPLC)法,定量定性分析β-胡萝卜素。色谱柱Nova-Pak-C18柱(5 μm,3.9 mm×150 mm);流动相V(乙腈)∶V(甲酸)∶V(二氯甲烷)=5∶1∶1;进样量10 μL;检测波长470 nm;流速1.0 mL/min;柱温25℃[12]。
类胡萝卜素的损失率=(1-η1/η2)×100% (4)式中:η1、η2表示干燥后、干燥前锁掷酵母中类胡萝卜素的质量分数,mg/g。
2 结果与讨论
2.1 β-胡萝卜素标准品溶液回归方程
取质量浓度为0.05、0.15、0.25、0.35和0.45 g/L的5个β-胡萝卜素标准液,每个质量浓度的进样体积为10 μL,重复3次,峰面积取平均值。然后,以β-胡萝卜素标准品溶液的质量浓度(g/L)为横坐标x,以其峰面积积分值为纵坐标y作线性回归,得回归方程为 y=81 571 040x-3 004 686.4(R2=0.999 7,n=3),表明β-胡萝卜素的进样量质量浓度在0.05~0.45 g/L范围内与峰面积线性关系良好。
2.2 精密度试验
取质量浓度为0.45 g/L的β-胡萝卜素标准液,进样体积为10 μL,重复进样5次,记录峰面积积分值,计算相对标准偏差(RSD)为1.35%,表明精密度良好。
2.3 稳定性试验
取质量浓度为0.45 g/L的β-胡萝卜素标准液,每隔一定时间进样,重复进样5次,5次峰面积的RSD为2.77%,证明样品含量在12 h内稳定性良好。
2.4 重现性试验
取同一份样品,按照前述方法操作,制备5份待测溶液,测定峰面积积分值并计算β-胡萝卜素的含量,测得RSD为2.23%,结果表明该试验方法的重现性良好。
2.5 回收率试验
取与重现性试验用的同一批样品,按照前述方法操作,制备7份待测溶液,分别精确加入β-胡萝卜素标准品。然后,分别进行测定,计算含量,其β-胡萝卜素平均加标回收率为99.62%,RSD 1.18%,测定结果如表1所示。
2.6 样品的测定
取实验待测样品A(鲜酵母)、B(冷冻干燥)、C(喷雾干燥)、D(真空干燥)、E(红外干燥)、F(微波干燥)和G(热风干燥),依上述方法制成实验待测样品溶液。在上述色谱条件下进样、测定每克干菌体中β-胡萝卜素的质量,结果见表2。
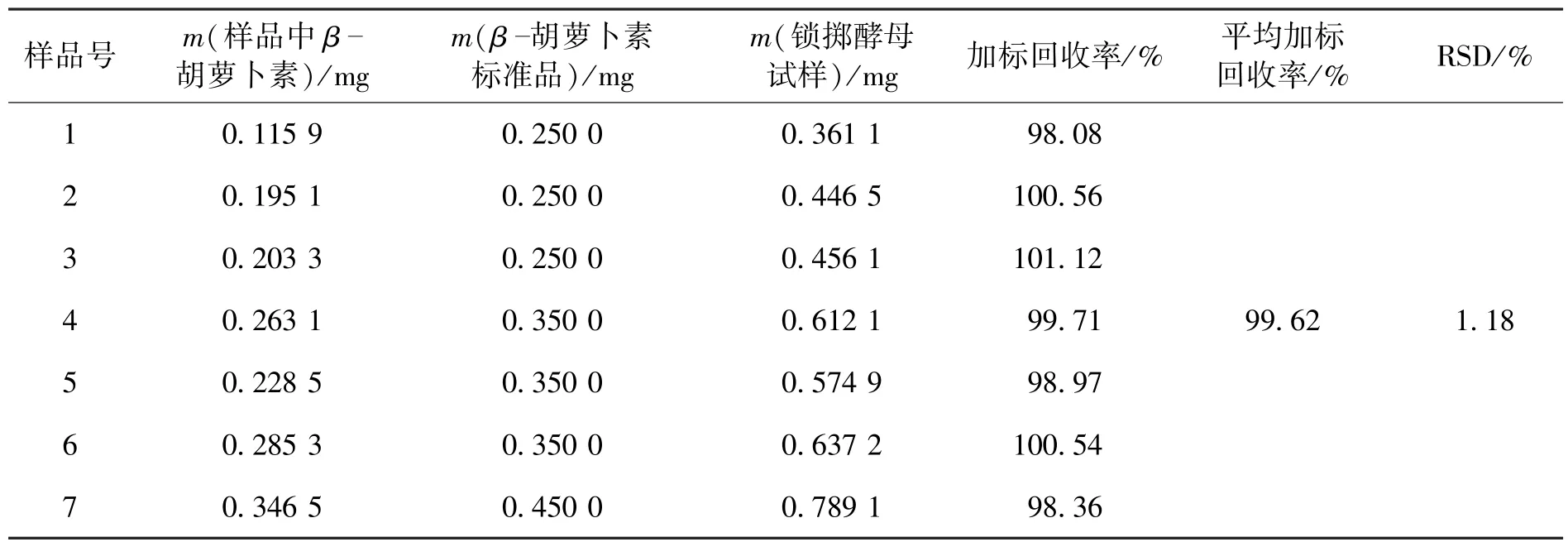
表1 回收率测定结果Table 1 Recovery of RP-HPLC assay
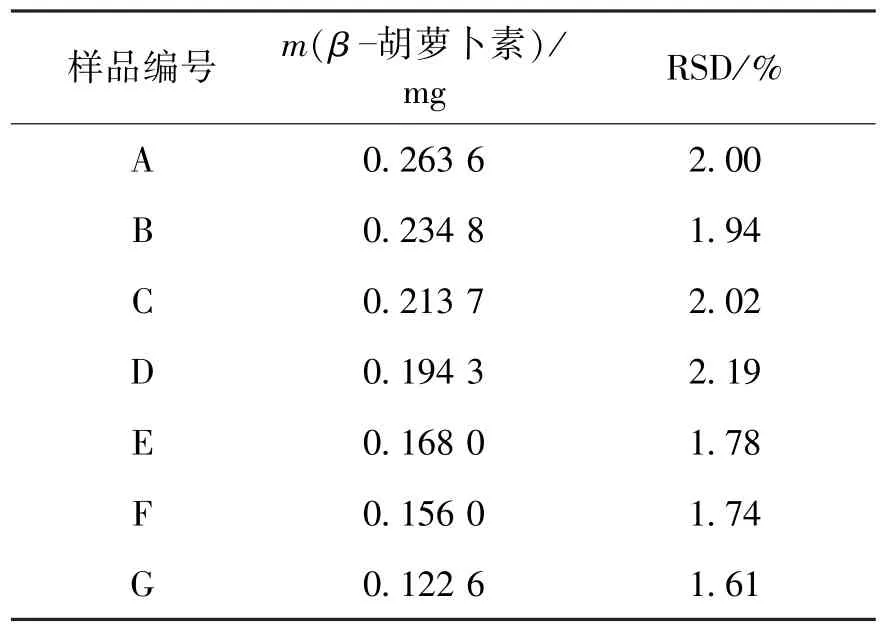
表2 样品中β-胡萝卜素的测定(n=3)Table 2 Determination of β-carotene in samples(n=3)
2.7 干燥方式对锁掷酵母中类胡萝卜素的影响
鲜锁掷酵母经真空干燥、冷冻干燥、鼓风干燥、红外干燥、微波干燥和喷雾干燥后,分别取适量的样品复水后进行酸热破壁,提取类胡萝卜素,然后用高效液相法测定β-胡萝卜素含量,用面积归一法计算出类胡萝卜素总含量。不同干燥方式对锁掷酵母中类胡萝卜素总含量的影响如图1所示。
由图1可知,本实验所设定的干燥方式均会引起锁掷酵母中类胡萝卜素含量的减少。其中,冷冻干燥对锁掷酵母类胡萝卜素含量的影响最小,其损失率仅为 11.13%,原因是冷冻干燥是在低温(-70℃)、负压的条件下进行的,且干燥时间短,干燥过程中样品几乎没有和O2接触,所以冷冻干燥对类胡萝卜素的破坏作用较小;热风干燥对锁掷酵母中的类胡萝卜素的影响最大,原因可能是热风干燥的干燥时间长,且是在和空气接触的条件下干燥的,所以其损失率达到46.78%。经不同干燥方法干燥后的锁掷酵母中类胡萝卜素含量的差异显著,即不同干燥方式对锁掷酵母中类胡萝卜素含量的影响差别较大,这表明在酵母干制时干燥方式的选择比较重要,选择适宜的干燥方式不仅可以提高产品的质量,还可以缩短干燥时间,从而提高经济效益。
冷冻干燥对锁掷酵母中类胡萝卜素的损失较小,但是冷冻干燥的设备价格较昂贵且耗能较大;虽然喷雾干燥的损失率比冷冻干燥的高,但是喷雾干燥的设备价格较低廉且耗能较少、效率高。
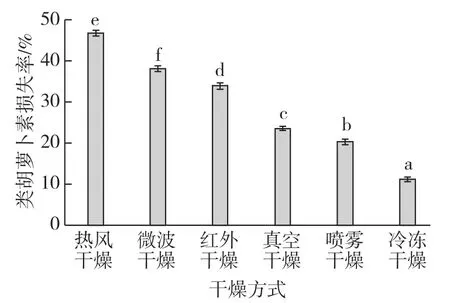
图1 干燥方式对锁掷酵母中类胡萝卜素的影响Fig.1 Effects of different drying methods on the carotenoids of S.pararoseus
2.8 不同干燥方式对锁掷酵母外观指标的影响
颜色是关系到干燥后酵母中类胡萝卜素含量的重要的质量指标,同时也是干燥产品的一个重要的物理性质指标,它在一定程度上反映了干制加工过程中物料的化学和营养成分变化的程度,物料受加工程度越高,原料的色差值越大。不同干燥方式对锁掷酵母颜色指标的影响如表3所示。

表3 不同干燥方法对酵母粉颜色参数的影响Table 3 Effects of different drying methods on the chroma parameters of S.pararoseus
从表3可以看出,各种方法干燥锁掷酵母的L、a和b值不同。但是经冷冻干燥产品的色差值ΔE和色度ΔC是最小的,和新鲜的原料最接近。同时也可以看出,热风干燥、微波干燥、红外干燥、真空干燥、喷雾干燥和冷冻干燥样品的ΔE值是依次减小的。锁掷酵母经不同干燥方法干燥后,其L值差异显著;微波干燥和红外干燥对干锁掷酵母a值的影响差异不显著;红外干燥和真空干燥对干锁掷酵母b值的影响差异不显著。在热风干燥中,由于存在O2和较多的水分,氧化反应十分容易发生;而在喷雾干燥和真空干燥中,O2很少,氧化较轻;冷冻干燥过程中原料几乎与O2隔绝,其干燥而得的产品氧化最轻。另外各种方法干燥至终点时所需的时间也不一样,即不同干燥方法的脱水速率不一样,因此色值的变化很不仅与氧化有关,还有可能与其他方面有关,如在干燥过程中的收缩以及反射的特性等[13]。不同干燥方式产品实物的色泽差异如图2所示。
3 结论
通过试验可以发现,不论采用何种方式干燥处理,均会使锁掷酵母中类胡萝卜素含量减少。相比之下,冷冻干燥方式优于其他干燥方式,其处理的锁掷酵母中类胡萝卜素的损失率最低。在干燥过程中类胡萝卜素的损失途径与机制尚不明确,可能由于类胡萝卜素分子结构中存在共轭双键,共轭双键的个数决定了类胡萝卜素的颜色以及吸收光谱,共轭双键对许多环境因素是敏感、不稳定的;O2是影响类胡萝卜素损失的重要因素,类胡萝卜素的异构化和自动氧化可导致类胡萝卜素VA的活性损失,造成干燥产品的色泽变化。冷冻干燥虽然对锁掷酵母中的类胡萝卜素影响较小,但是其成本过高且不能满足大规模工业化生产。因此,成本低廉、高效节能的干燥方式有待进一步研究开发。

图2 不同干燥方式的干燥产品对比Fig.2 S.pararoseus of product with different drying methods
[1]师建芳,刘清,谢奇珍,等.新型混流式粮食干燥机的应用[J].农业工程学报,2011,27(增刊2):15-19.
[2]Wang WeiJie,Xu ChangJie.Natural carotenoid biosynthesis and biotechnological applications[J].Chin J Cell Biol,2006,28:839-843.
[3]Rock C L,Carotenoids:biology and treatment[J].Pharmacol Ther,1997(75):185-197.[4]Lomnitsky L,Grossman S,Bergman M,et al.In vitro and in vivo effects of beta-carotene on rat epidermal lipoxygenases[J].Int J Vitamin Nutrition Res,1997,67:407-414.
[5]李福枝,刘飞,曾晓希,等.天然类胡萝卜素的研究进展[J].食品工业科技,2007,28(9):227-232.
[6]马兴周,邓春明.流化床型式在酵母干燥中的对比分析[J].广西轻工业,2010(12):3-4.
[7]张长新.HunterLab色差仪:食品颜色的有效测量工具[J].食品安全导刊,2009(3):43.
[8]Jin Z,Hsieh F,Huff H E.Extrusion cooking of corn meal with soy fiber,salt,and sugar[J].Cereal Chem,1994,71(3):227-234.
[9]Altan A,McCarthy K L,Maskan,M.Evaluation of snack foods from barley-tomato pomace blends by extrusion processing[J].J Food Eng,2008,84(2):231-242.
[10]曹新志,明红梅,陈永京.微波和红外干燥对胡萝卜品质的影响[J].四川理工学院学报:自然科学版,2009,22(1):59-61.
[11]张智勇,孙辉,王春,等.利用色彩色差仪评价面条色泽的研究[J].粮油食品科技,2013,21(2):55-58.
[12]韩梅,葛向阳,钱和,等.锁掷酵母高产类胡萝卜素的发酵条件的研究[J].食品工业科技,2011,32(12):239-242.
[13]Sapers D M,Douglas J.Analysis of the association of official agricultural chemists[M].10th ed.Gaithersbury:Association of Offical Analytical Chemists(SCAOAC),1987.
(责任编辑 管 珺)
Effects of drying technique on carotenoids of Sporidiololus pararoseus
LI Haiwei1,QIAN He1,ZHANG Fangfang1,WANG Zhaoshun2,HAN Mei3,QI Chao1,ZHANG Weiguo3
(1.School of Food science and Technology,Jiangnan University,Wuxi 214122,China;2.Taizhou Senttech Technology Group,Taizhou 225300,China;3.The Key Lab of Industrial Biotechnology of the Ministry of Education,Jiangnan University,Wuxi 214122,China)
We cultured Sporidiololus pararoseus(S.pararoseus)by using corn steep liquor culture medium,and studied the effects of different drying technique on the carotenoids contents and bright value(L),red value(a),yellow value(b)value of S.Pararoseus.The vacuum freeze-drying method could well keep the carotenoids contents of dry S.Pararoseus,and have minimal effect on L,a,b value. Carotenoids were kept up to 88.87%,and the bright value(L),red value(a),yellow value(b)value were 64.55,18.44 and 32.71 when S.Pararoseus was dried at-70℃ by vacuum freeze-drying.
corn steep liquor;Sporidiololus pararoseus;drying technique
TS201.1
A
1672-3678(2015)01-0089-05
10.3969/j.issn.1672-3678.2015.01.015
2013-09-28
国家科技支撑计划(2012BAD36B02);江苏高校优势学科2012年江苏省产学研创新项目(BY2012063);“十二五”科技支撑计划建设工程(2011BAD011302-1)
李海伟(1987—),男,河南周口人,硕士研究生,研究方向:天然色素;钱 和(联系人),教授,E-mail:amtf168@126.com
