毒死蜱和阿特拉津对鲤肝脏的影响
2015-11-11
毒死蜱和阿特拉津对鲤肝脏的影响
韩英1,郝其睿1, 2,魏菁3,赵荣伟1,牟振波2,徐革锋2,刘洋2
(1.东北农业大学动物科学技术学院,哈尔滨150030;2.中国水产科学研究院黑龙江水产研究所,哈尔滨150070;3.大连出入境检验检疫局,辽宁大连116600)
摘要:探讨阿特拉津(Atrazine,ATR)、毒死蜱(Chlorpyrifos,CPF)及其混合物对鲤(Cyprinus carpio L.)肝脏和血液相关指标的影响。将实验鲤分别暴露于不同浓度的阿特拉津、毒死蜱及其混合物中,并分别于175、350和525 d采集其肝组织、血液等样品。结果表明,阿特拉津和毒死蜱在鲤肝组织中均有残留,残留量随暴露时间及浓度的增加而降低;与对照组比较,各染毒组碱性磷酸酶、谷丙转氨酶及血糖水平显著升高,总蛋白、白蛋白水平下降,抗氧化能力下降,且毒死蜱与阿特拉津混合后毒性作用更强,说明两者的毒性有叠加作用;染毒后,肝脏ER-α和VTG-II基因表达水平升高。结果显示,鲤肝脏对阿特拉津和毒死蜱有较强的代谢能力,阿特拉津和毒死蜱在鲤肝脏无富集作用;阿特拉津和毒死蜱使鲤肝功能受损,抗氧化能力降低;ER-α和VTG-II基因的高调表达显示出阿特拉津和毒死蜱对鲤亦有环境雌激素作用。
关键词:阿特拉津;毒死蜱;鲤;肝脏
网络出版时间2015-3-13 15:21:00
[URL]http://www.cnki.net/kcms/detail/23.1391.S.20150313.1521.006.html
韩英,郝其睿,魏菁,等.毒死蜱和阿特拉津对鲤肝脏的影响[J].东北农业大学学报, 2015, 46(3): 67-73.
三氮嗪类除草剂阿特拉津(莠去津)和有机磷类杀虫剂毒死蜱(乐斯本)是现代农业生产中广泛应用的农药,通过淋溶、径流等方式进入水域影响水生生物生活及生存,尤其是鱼类。阿特拉津影响动物生殖功能,被世界野生动物基金会(WWF)列为环境激素物质[1]。毒死蜱普遍使用,是目前应用最广泛的5种杀虫剂之一[2]。雌激素受体ER能与雌激素特异性结合,多种环境激素对雌激素受体具有内分泌干扰效应,可诱发动物和人体出现发育异常、生殖障碍、代谢紊乱等症状[3]。卵黄蛋白原VTG是卵生脊椎动物特有蛋白,VTG在鱼体内异常诱导,反映生物体受到内分泌干扰物时的综合压力,导致生物体正常发育受影响[4]。
阿特拉津和毒死蜱对鲤毒性研究已有报道[5-6],但有关这两种农药在肝脏中残留及其对相关基因表达研究未见报道。试验以鲤为供试动物,旨在探讨ATR和CPF单一及联合暴露对鲤肝功能及抗氧化性的影响、在肝脏残留情况,及与性腺发育有关的雌激素受体基因ER-α和卵黄蛋白原基因VTG-II mRNA表达等,为水环境保护奠定基础。
1 材料与方法
1.1试剂及仪器
1.1.1主要试剂
毒死蜱和阿特拉津均购于Sigma公司,纯度分别为98.0%和99.5%。碱性磷酸酶测定试剂盒、谷丙转氨酶测定试剂盒、考马斯亮兰蛋白测定试剂盒、白蛋白测定试剂盒、血糖浓度测定试剂盒、溶菌酶测定试剂盒、谷胱甘肽还原酶测定试剂盒和总抗氧化能力测定试剂盒均购自南京建成生物工程研究所。
1.1.2主要仪器
TU-1900双光束紫外可见分光光度计,安捷伦气象色谱7890a,RT-PCR仪等。
1.2试验用鱼的驯养及暴露环境
1.2.1试验用鱼的驯养
试验动物为健康普通鲤,2011年3月购自于黑龙江省某渔场,体重(36±3.73)g·尾-1。在经过曝气的自来水中暂养15 d后攻毒。试验用水pH为(7.4±0.2),总硬度为225 mg·L-1,溶解氧>7 mg·L-1,水温为(20±1)℃,每日光照周期保持为12 h。
1.2.2试验分组与暴露环境
根据邢厚娟所测定的阿特拉津、毒死蜱单一以及二者混合液(阿特拉津和毒死蜱质量比为1ϑ1混合)对鲤的96h-LC50值(2.142、0.582和0.565 mg·L-1)[1],取每种毒物LC50值的1/5 LC50、1/50 LC50依次分为高、低两个浓度组,即阿特拉津低浓度组AD(4.28 μg·L-1)和阿特拉津高浓度组AG (42.8 μg·L-1),毒死蜱低浓度组DD(1.16 μg·L-1)、高浓度组DG(11.6 μg·L-1),毒死蜱和阿特拉津混合液低浓度组HD(1.13 μg·L-1)、高浓度组HG (11.3 μg·L-1)共6个处理组,另设空白对照组KB和丙酮溶剂对照组BT(在配制时,以浓度<0.05%的丙酮为助溶剂),每个处理组设一平行,每组放鱼30尾。
为保证毒物浓度,每隔1 d更换毒液,试验期间定时定量喂食。暴露期为525 d,每175 d采样一次,每次采样分别从各处理组随机抽取10尾试验鱼用于试验指标检测。
1.3常规指标测定
1.3.1肝脏农药残留检测
肝组织农药残留含量测定,由哈尔滨市农业科学院水产分院协助完成。检测使用安捷伦气象色谱7890a,具有操作简单、分析速度快、分离效能高、灵敏度高、应用范围广特点。气相色谱法普遍用于环境残留的三氮苯类农药的检测,该检测限为0.001 μg·mL-1。
1.3.2血液指标检测
1.3.2.1血清的制备
尾静脉采血,采集量为4~5 mL·尾-1,置于高压灭菌后离心管中,静置待其凝固后,4℃3 000 r·min-1离心10 min,得到上清液即为血清,将其吸出分装备用。
1.3.2.2指标测定
血清碱性磷酸酶、谷丙转氨酶、总蛋白、白蛋白、血糖、谷胱甘肽还原酶和总抗氧化能力测定按试剂盒使用说明的要求标准操作,测定吸光度并计算含量。
1.4 ER-α和Vtg-IImRNA在肝脏的表达
1.4.1引物的设计、合成与实时PCR扩增
采用Trizol法抽提鲤肝脏组织中的总RNA,以20 μL反应体系反转录成cDNA,应用引物设计软件(Oligo 6.22)设计实时荧光定量PCR引物(见表1)。荧光定量PCR反应采用TransStartTMGreen qPCR SuperMix荧光染料,反应体系为20 μL。每个样品做3个平行。
反应条件为:95℃预变性30 s,95℃变性15 s,60℃退火30 s,40个循环。反应获得的扩增曲线和溶解曲线应用软件进行分析。标准梯度的制备:标号5个1.5 mL的离心管,每个管中加入灭菌水8 μL,取模板2 μL一号管混匀,即为5倍稀释,再取出2 μL加入到二号管中,依次稀释至25、125、625和3 125倍备用。

表1 目的基因的引物序列及片段长度Table 1 Primer sequence and amplification length of destination fragment
1.4.2 ER-α和Vtg-II基因mRNA表达的相对差异分析
各试验组均做3个重复,样品5倍梯度稀释后利用软件构建基因扩增的标准曲线。进行ER-α和Vtg-ⅡmRNA表达相对定量分析,以β-actin为内参基因。计算采用PfaffL法[7],计算公式如下:
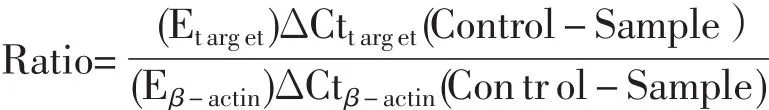
其中,E=10(-1/slope)
ΔCttarget(Control-Sample)为目的基因在对照组Ct值与试验组Ct之差;ΔCtβ-actin(Control-Sample)为β-actin在对照组Ct值与试验组Ct之差。
1.5数据处理
应用GraphPad Prism 5软件进行统计学分析,所有数据通过单方差分析进行评估,应用Tukey法多重比较分析其数据的差异性。分析后各处理组结果均表示为“平均数(Mean)±标准差(SD)”形式。P<0.05表示为显著性差异。
2 结果与分析
2.1阿特拉津和毒死蜱在鲤肝脏中的残留
对175、350和525 d阿特拉津单一与毒死蜱联合暴露组鲤肝脏中阿特拉津的残留量进行检测。
2.1.1肝脏中阿特拉津的残留
KB组和BT组鲤肝脏均未检测到阿特拉津;各处理组肝脏内均有阿特拉津残留,随处理时间延长而下降,各组差异显著(P<0.05);单一和联合处理高浓度组较低浓度组肝脏中阿特拉津残留呈显著升高趋势(P<0.05);联合处理组阿特拉津残留量显著低于单一处理组(P<0.05)(见表2)。
2.1.2肝脏中毒死蜱的残留
对175、350和525 d毒死蜱单一及与阿特拉津联合暴露组肝脏中毒死蜱残留量进行检测。KB组和BT组鲤肝脏均未检测到毒死蜱;各处理组肝脏内均有毒死蜱残留,并随处理时间延长而下降,各组差异显著(P<0.05);单一和联合处理高浓度组较低浓度组肝脏中毒死蜱残留呈显著升高趋势(P< 0.05);联合处理组阿特拉津残留量显著低于单一处理组(P<0.05)(见表2)。
2.2鲤血清中碱性磷酸酶和转氨酶的活性
2.2.1鲤血清中碱性磷酸酶的活性
与KB组、BT组相比,各处理组碱性磷酸酶浓度均显著升高(P<0.05)。各处理组间碱性磷酸酶浓度变化不显著(见表3)。
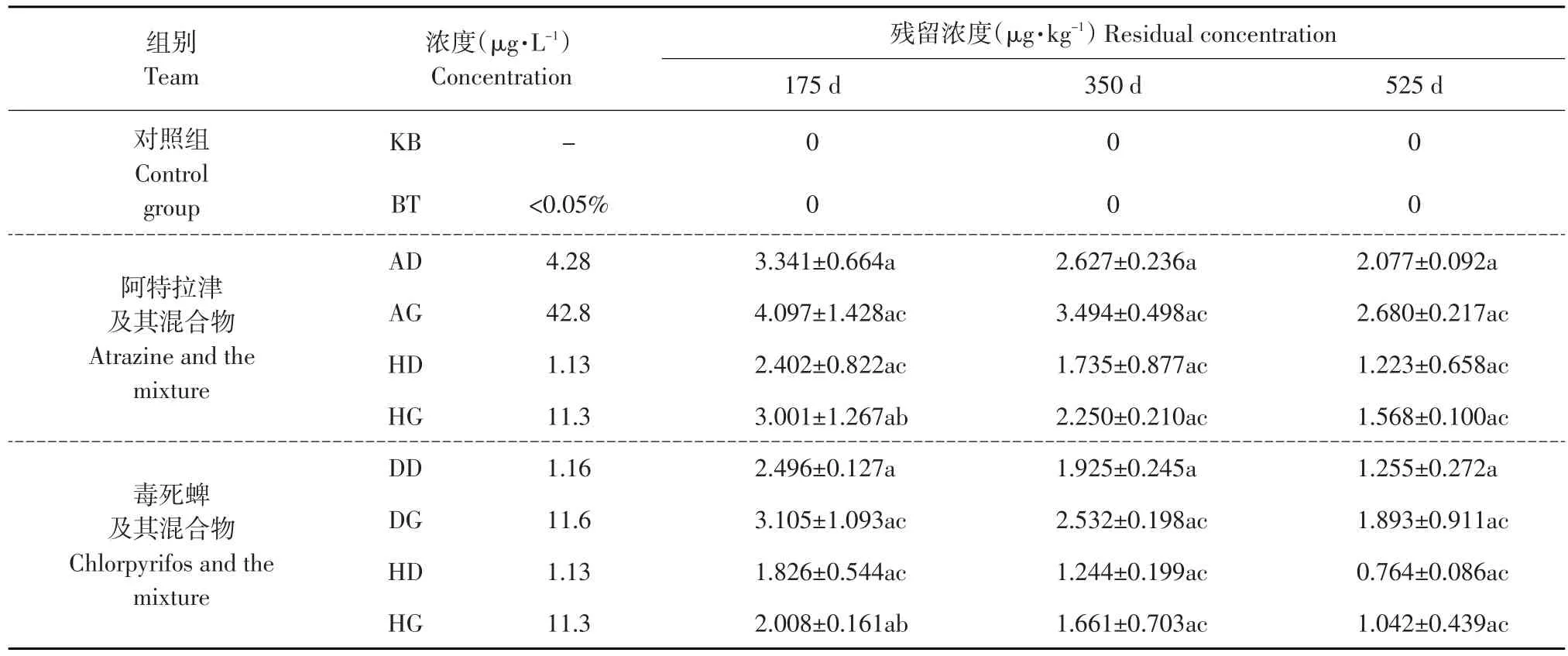
表2 不同浓度阿特拉津、毒死蜱及其混合物在鲤肝脏中的残留Table 2 Detection results of the residue of atrazine, chlorpyrifos and the mixture with different concentrations in common carp's liver

表3 不同浓度阿特拉津、毒死蜱及其混合物对鲤血液指标的影响Table 3 Effects of atrazine, chlorpyrifos and their mixture with different concentration on blood indicators in carp's serum
2.2.2鲤血清中谷丙转氨酶的活性
与KB组、BT组相比,除AD组外,其他各处理组谷丙转氨酶含量显著升高(P<0.05)。各组内比较显示,各高浓度组与低浓度组差异显著(P<0.05)(见表3)。
2.3鲤血清中总蛋白、白蛋白和血糖的含量
2.3.1鲤血清中总蛋白的含量
与KB组、BT组相比,除AD组外,其他各处理组总蛋白含量显著降低(P<0.05);各处理组间总蛋白含量变化不显著(见表3)。
2.3.2鲤血清中白蛋白的含量
与KB组、BT组相比,除AD组外,其他各处理组白蛋白含量显著下降(P<0.05);AD组与AG组无显著差异,其他各高浓度组与低浓度组差异显著(P<0.05)(见表3)。
2.3.3鲤血清中血糖的浓度
与KB组、BT组相比,AD组、AG组和DD组血糖浓度无显著差异,其他各处理组显著升高(P< 0.05);HD组与HG组差异显著(P<0.05),其他各高浓度组与低浓度组无显著差异(见表3)。
2.4鲤血清中各抗氧化指标测量
2.4.1鲤血清中谷胱甘肽还原酶的含量
与KB组、BT组相比,各处理组谷胱甘肽还原酶含量显著下降(P<0.05);HD组与HG组差异显著(P<0.05),其他各高浓度组与低浓度组无显著差异。
2.4.2鲤血清中总抗氧化能力的测量
与KB组、BT组相比,各处理组抗氧化能力显著下降(P<0.05);AD组与AG组无显著差异,其他各高浓度组与低浓度组差异显著(P<0.05)(见表3)。
2.5 ER-α mRNA和VTG-II mRNA在不同染毒组肝组织中的表达比较
ER-α mRNA在肝组织平均表达水平为阿特拉津处理组(A)、阿特拉津与毒死蜱混合处理组(H)、毒死蜱处理组(D)依次递减,各组均高于空白对照组(C),差异显著(P<0.05)。
VTG-II mRNA在肝组织平均表达水平A、H、D依次递减,各组均高于C,差异显著(P<0.05)(见图1、2)。
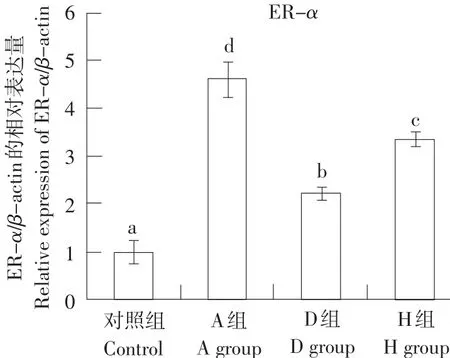
图1 ER-α mRNA在肝组织中的表达情况Fig. 1 Expression of ER-α mRNA in liver tissue
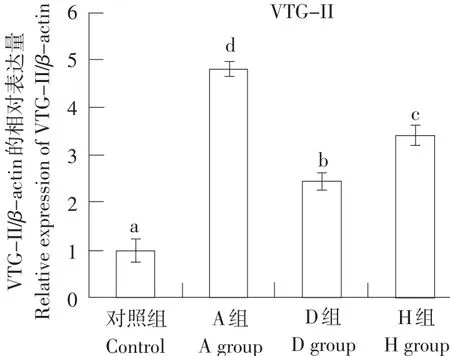
图2 VTG-II mRNA在肝组织中的表达情况Fig. 2 Expression of VTG-II in liver tissue
3 讨论与结论
3.1阿特拉津和毒死蜱在鲤肝组织的残留
水体中残留农药可通过鱼类体表、呼吸道和摄食等方式在体内蓄积,出现生物富集现象[8]。不同农药在体内代谢机制和降解能力不同,残留情况也不同。试验结果显示,在阿特拉津、毒死蜱及混合暴露后,鲤肝脏组织中阿特拉津、毒死蜱残留量随着时间逐渐降低。原因可能与阿特拉津、毒死蜱结构特性导致其与组织的亲和性较差有关,鱼体通过细胞色素P450酶系等途径可将其转化、降解,并随着时间的推移,肝脏应激适应能力逐步增强。结果说明,鲤肝脏对阿特拉津和毒死蜱有较强代谢能力,阿特拉津和毒死蜱在鲤肝脏无富集作用。
3.2阿特拉津和毒死蜱单一及其混合液对鲤血清相关指标的影响
3.2.1对碱性磷酸酶和转氨酶的影响
碱性磷酸酶作为血清酶的一种与机体生长相关的调控酶,催化磷酸单酯水解,促使磷酸集团发生转移和代谢[9]。试验发现,阿特拉津和毒死蜱单一及混合使用均能使鲤碱性磷酸酶活性升高。碱性磷酸酶升高,在鱼类临床表现为肝损伤。结果与以往有关阿特拉津会抑制斑马鱼碱性磷酸酶的活性不同[10],其原因是否与鱼类种类属性有关有待于进一步研究。
谷丙转氨酶是一种在动物线粒体中广泛存在氨基转移酶,在体内蛋白质代谢过程中发挥重要作用。当机体处于正常生理状态下,血清中谷丙转氨酶含量很低,当受到外源因素或者其他致病因素作用发生损伤时,血清中谷丙转氨酶活性会出现一次性或持续性升高[11-12]。阿特拉津和毒死蜱对鱼类毒性极强,对肝脏组织也具有很严重的毒害和损伤作用[13]。
3.2.2对血清蛋白水平和血糖含量的影响
试验结果显示,阿特拉津、毒死蜱及其混合液对鲤血清中总蛋白和白蛋白水平具有抑制作用,这与王希英研究结果一致[14]。鲤血清中总蛋白和白蛋白水平降低主要原因是:阿特拉津与毒死蜱使鲤肝脏作为毒物代谢的靶器官受损伤,抑制总蛋白和白蛋白合成;试验药物导致机体发生一系列应激反应,对蛋白质合成具有抑制作用;阿特拉津和毒死蜱造成肾脏损伤,使肾脏滤过作用受损和减弱,导致部分蛋白随尿液流失;慢性中毒使鲤的消化吸收能力下降,影响血液中总蛋白和白蛋白水平。
阿特拉津和毒死蜱对鲤血糖浓度具有升高作用,这与潘春记等研究结果一致[15]。染毒后鲤血糖升高,是机体应激反应结果。3.2.3对抗氧化能力的影响
谷胱甘肽还原酶作为体内一种具有抗氧化能力酶,能够维持生物膜完整和功能的稳定,达到清除体内超氧化物自由基的目的,有延缓机体衰老和预防疾病发生等诸多能力。谷胱甘肽还原酶对于鲤机体自身抗氧化能力方面具有重要作用[16-17]。
超氧阴离子自由基使神经细胞不能正常生长,降低ATP酶活性和膜脂流动性,导致细胞总羰基、过氧化脂质含量和核DNA单链断裂现象增加,说明机体对自由基清除能力能够反映抗氧化能力的强弱[18]。试验结果显示,阿特拉津、毒死蜱单一及混合使用后降低鲤抗氧化能力,主要是由于农药导致肝损伤,体内产生过多自由基,导致氧化损伤。
3.2.4阿特拉津和毒死蜱单一及混合用药毒性的比较
试验结果显示,毒死蜱对鲤的毒性强于阿特拉津,而阿特拉津与毒死蜱混合用药较两者单一使用毒性更强,使鲤肝损伤加重,抗氧化能力进一步下降,即阿特拉津与毒死蜱对鲤的毒性有叠加作用。
3.3阿特拉津和毒死蜱单一及联合慢性暴露后对鲤肝脏ER-α和VTG-II表达的影响
α型雌激素受体(ER-α)通路是雌激素作用的主要途径。ER-α属于核内受体超家族,通常情况下,受体以二聚体的形式与雌激素结合,启动雌激素应答元件(Estrogen responsive elements,EREs)转录,实现雌激素作用[19]。雌激素应答元件包括卵黄蛋白原(VTG)基因、ER基因、绒毛膜促性腺激素基因(Choriogenin gene)等基因[20]。研究发现,阿特拉津具有环境雌激素效应,研究主要集中在两栖动物的蛙类和哺乳动物的鼠类[21-22]。试验结果显示,鲤肝脏中ER-α和VtgII这两个与卵巢发育有关的基因表达均在一定程度上被诱导。本试验前期组织学研究表明,阿特拉津和毒死蜱能够促进鲤卵巢的发育而抑制精巢发育,说明与其他动物一样,阿特拉津和毒死蜱对鲤亦具有雌激素作用[23],作用机制有待于进一步研究。
阿特拉津和毒死蜱单一及联合慢性暴露,能引起鲤肝脏损伤及抗氧化系统的异常;两种农药在鲤肝脏组织中均有残留,随时间变化而降低,表明鲤肝脏对阿特拉津和毒死蜱有较强降解能力,在肝脏内无富集;两种农药均使鲤肝脏中ER-α和Vtg-II mRNA表达量增加,有类雌激素作用。
[参考文献]
[1]邢厚娟.阿特拉津和毒死蜱单一及联合暴露对鲤鱼毒理作用的研究[D].哈尔滨:东北农业大学, 2010.
[2]秦正红,乐卫东.自噬—生物学与疾病[M].北京:科学出版社, 2011.
[3]志生,张靖,张丰,等. ER-α和ER-β介导的有机磷农药雌激素效应差异分析[J].环境科学学报, 2012, 32(12): 3006-3014.
[4]王琪.环境激素对鱼类生殖影响生物检测方法的建立[D].兰州:甘肃农业大学, 2008.
[5]Filipov N M, Stewart M A, Carr R L, et al. Dopaminergic toxicity of the herbicide atrazine in rat striatal slices[J]. Toxicology, 2007,
Han Ying, Hao Qirui, Wei Jing, et al. Effect of atrazine and chlorpyrifos on common carp's liver[J]. Journal of Northeast Agricultural University, 2015, 46(3): 67-73. (in Chinese with English abstract)
Effect of atrazine and chlorpyrifos on common carp's liver
/HAN Ying1, HAO Qirui1,2, WEI Jing3, ZHAO Rongwei1, MOU Zhenbo2, XU Gefeng2, LIU Yang2(1. School of Animal Sciences and Technology, Northeast Agricultural University, Harbin 150030, China; 2. Heilongjiang Fisheries Research Institute, Chinese Academy of Fishery Sciences, Harbin 150070, China; 3. Entry-Exit Inspection and Quarantine Bureau, Dalian Liaoning 116600, China)
Abstract:In this study our purpose is to discuss the effects of atrazine and chlorpyrifos and their mixture to related index of common carp's liver and blood. Exposeed experimental carps respectively in atrazine, chlorpyrifos and their mixture of different concentrations, and collected samples of common carp's liver and blood at 175, 350 and 525 d. Results showed that both atrazine and chlorpyrifos had residual in common carp's liver and the residual quantity reduced with the exposure time and the concentration increasing. Compared to the control group, the alkaline phosphatase, glutamic-pyruvic transaminase and blood glucose levels of each infected group had significant rise, while the total protein and albumin levels declined. Moreover, the toxicity of the mixture of atrazine and chlorpyrifos was stronger than that prior to the blending, which illustrated the toxicity of the two have superposition. After infected, the expression level of ER-α and VTG-II in liver went up. The experimental results expressed that thebook=46,ebook=68common carp's liver had strong metabolic capability to atrazine and chlorpyrifos and the two had no concentration in common carp's liver. Atrazine and chlorpyrifos caused the function of commone carp's liver damaged and reduced its antioxidant capacity. The high expression levels of ER-α and VTG-II showed that atrazine and chlorpyrifos had environmental estrogen effects to common carp as well.
Key words:atrazine; chlorpyrifos; common carp; liver
作者简介:韩英(1963-),女,教授,博士,博士生导师,研究方向为鱼类遗传育种与繁殖。E-mail: hanying_606@163. com
基金项目:黑龙江省自然科学基金面上项目(AC200934);黑龙江博士后资助项目(LRB10-633)
收稿日期:2014-03-31
文章编号:1005-9369(2015)03-0067-07
文献标志码:A
中图分类号:S965.116
