旋毛虫Hsp70与Ts87融合蛋白的构建表达及鉴定*
2015-11-10诸欣平
孙 靓 孙 青 房 磊 杨 静 顾 园 毕 阔 诸欣平
(首都医科大学基础医学院人体寄生虫学教研室,北京 100069)
旋毛虫病是一种人兽共患的寄生虫病,人或动物通过生食或半生食含旋毛虫囊包幼虫的猪肉或其他肉类而感染。旋毛虫病呈世界性分布,在欧洲、北美洲、阿根廷、老挝、中国等地都有流行(Pozio, 2007;Murrelletal., 2011; Feidasetal., 2014)。我国是世界上受旋毛虫病危害较严重的国家之一,近年来由于生食、涮、烤等食肉方式的多样化,加之人们越来越多地尝试食用野生动物肉类,使得我国旋毛虫病发病率呈上升趋势(Murreletal., 2011; 鱼艳荣等,2013; 刘明远等,2014)。因此预防和控制旋毛虫病的传播和流行是一个亟待解决的问题,而目前尚无十分有效的预防旋毛虫病的疫苗问世。
本课题组的前期研究发现,从旋毛虫成虫cDNA表达文库中筛选得到的排泄分泌蛋白rTs87有着较好的免疫原性。通过肌注rTs87蛋白与佐剂的混合物可诱小鼠体产生体液和细胞免疫反应,通过灌胃的方式可诱导产生粘膜免疫反应,并且以其制备DNA疫苗的肌幼虫减虫率可达40%以上(Yangetal., 2010; Yangetal., 2013)。旋毛虫热休克蛋白70(Ts-Hsp70)是我们从旋毛虫成虫cDNA表达文库中克隆表达的另一种蛋白,我们的前期研究也发现该蛋白为可溶蛋白,可以通过活化树突状细胞(DC)诱导机体产生较强的抗旋毛虫感染的免疫保护作用(Wangetal., 2009; Fangetal., 2014)。然而,单一蛋白免疫的效果并不十分理想。
融合蛋白是将两个或多个基因通过DNA重组的技术相连接,获得具有多种蛋白质功能的表达产物(Schmidt, 2013)。由于其相对分子质量较大,抗原表位多,更容易诱导较强烈的免疫反应(Chengetal., 2014; Pieczykolanetal., 2014)。同时,联合使用两种或多种蛋白疫苗,可以发挥协同促进功能产生更好的免疫效果(Juteletal., 2014)。为研制更为有效的抗旋毛虫感染的疫苗,本研究将旋毛虫Ts-Hsp70与Ts87基因连接重组,诱导表达融合蛋白,并进行鉴定,为研制更高效的旋毛虫疫苗奠定了基础。
1 材料与方法
1.1 实验材料
1.1.1实验动物:BALB/c雌性小鼠,6~8周龄,购自中国军事医学科学院。
1.1.2旋毛虫虫株:ICR鼠传代保存的黑龙江猪源旋毛虫Trichinellaspiralis。
1.1.3质粒与菌株:质粒pET-28a(+)和E.coli菌株BL21(DE3)、DH5α由本室保存。
1.1.4主要试剂:Taq酶、限制性内切酶、DNA连接酶,购自Takara生物有限公司;卡那霉素购自北京华美生物工程有限公司;IPTG购自Sigma公司;His-Bind试剂盒、Protein Refolding试剂盒购自Novagen公司;His标签鼠源单抗购自冠星宇科技有限公司;辣根过氧化物酶(HRP)标记羊抗小鼠IgG二抗购自美国LI-COR公司。
1.2 实验方法
1.2.1重组质粒构建:实验室前期已成功构建pET-28a(+)/Ts-Hsp70和pET-28a(+)/Ts87质粒(杨静等, 2003; Wangetal., 2009)。以pET-28a(+)/Ts-Hsp70为模板,以L1: 5′-G C G G A T C C A T G G T C G G T C G A G A AT-3′ (BamHⅠ),R1: 5′-G C G A A T T C C A G T T C A T C T T T T T C T T C AG-3′ (EcoRⅠ)为引物,PCR扩增编码Ts-Hsp70的目的基因,并连入pET28a(+)载体,构建新载体pET-28a(+)/Ts-Hsp70,导入DH5α菌株,在含有卡那霉素的LB平板上37℃过夜培养,选取阳性菌落PCR,并提取质粒双酶切鉴定,测序分析。以L2: 5′-G C G A A T T C A T G T T C A T A T T T T A T G C T A T A GC-3′ (EcoRⅠ)和R2: 5′-G C C T C G A G T T A G G T G C A T G C A T C C A AG-3′(XhoⅠ)为引物,pET-28a(+)/Ts87为模板,扩增Ts87目的基因,双酶切纯化后连入pET-28a(+)/Ts-Hsp70质粒,转化感受态细胞DH5α,同上筛选阳性克隆,菌落PCR,酶切鉴定,测序分析。
1.2.2rTs-Hsp70-Ts87融合蛋白的表达及纯化:将pET-28a(+)/Ts-Hsp70-Ts87质粒导入表达宿主菌BL21(DE3)中,涂于含卡那霉素的LB平板上,37℃过夜培养,挑取阳性克隆接种于含卡那霉素的LB培养基中,37℃摇菌培养,当菌液OD值达到0.6~0.8时,加入IPTG至终浓度1 mmol/L诱导表达,4 h后收集菌体。超声破菌,11 000 r/min, 4℃离心10 min,用含有6 mol/L盐酸胍的Binding溶液溶解沉淀,用His-Bind试剂盒对蛋白进行纯化,用Protein Refolding试剂盒对蛋白进行复性。
1.2.3免疫血清制备: 同上述方法表达和纯化rTs-Hsp70、rTs87蛋白,将其分别与佐剂ISA50v2按1∶1的体积比例混合,隔周免疫1次,共免疫3次,背部皮下多点注射,每只小鼠免疫剂量为20 μg。末次免疫后7天,眼内眦静脉取血,将血液室温静置2 h后,3 000 r/min离心10 min,分离上清,再重复离心一次,取上清即为免疫血清。
1.2.4rTs-Hsp70-Ts87融合蛋白的鉴定:用Western blot的方法检测rTs-Hsp70-Ts87融合蛋白与抗His标签单抗、rTs-Hsp70免疫血清、rTs87免疫血清的反应情况。将纯化后的rTs-Hsp70-Ts87进行聚丙烯酰胺凝胶电泳,转移至NC膜上,一抗分别用抗His单抗(用抗体稀释液以1∶5000稀释血清),rTs-Hsp70免疫血清(1∶20 000),rTs87免疫血清(1∶20 000)室温慢摇1 h,二抗用羊抗小鼠IRDye800(抗体稀释液1∶ 5 000稀释),室温避光缓慢摇动1 h。用Odyssey双色红外荧光成像系统对NC膜进行扫描成像。
2 结果
2.1 重组原核表达质粒的构建
Ts-Hsp70(1 764 bp)与Ts87(1 044 bp)基因通过EcoRⅠ酶切位点相连接,构建含有目的基因Ts-Hsp70-Ts87的表达质粒pET-28a(+)/Ts-Hsp70-Ts87。经菌落PCR、酶切鉴定和DNA序列分析,证明目的基因已成功插入表达载体,如图1所示,箭头所指的条带即为Ts-Hsp70-Ts87融合基因的条带,其分子量为2 721 bp。

图1 pET-28a(+)/Ts-Hsp70-Ts87酶切鉴定Fig.1 Digestion identification of pET-28a(+)/Ts-Hsp70-Ts87M: DNA分子量标准; 1: pET-28a(+)/Ts-Hsp70-Ts87重组质粒单酶切; 2-3: pET-28a(+)/Ts-Hsp70-Ts87重组质粒双酶切; 4: pET28a(+)空质粒双酶切; 5: pET28a (+)空质粒单酶切。M: DNA marker; 1: pET-28a(+)/Ts-Hsp70-Ts87 single enzyme digestion; 2-3: pET-28a(+)/Ts-Hsp70-Ts87 double enzyme digestion; 4: pET-28a(+)double enzyme digestion; 5: pET-28a(+)single enzyme digestion.
2.2 重组蛋白rTs-Hsp70-Ts87的表达和纯化
对pET-28a(+)/Ts-Hsp70-Ts87的BL21表达菌进行诱导表达及SDS-PAGE电泳分析,结果显示,与诱导的空质粒和未诱导的重组质粒相比,诱导表达的重组质粒在约100 kDa左右可见明显的表达条带,与理论值相符。rTs-Hsp70-Ts87为非可溶蛋白,经镍柱亲和层析变性纯化、复性后,可溶且条带较单一,如图2所示,箭头所指的条带即为目的条带rTs-Hsp70-Ts87。
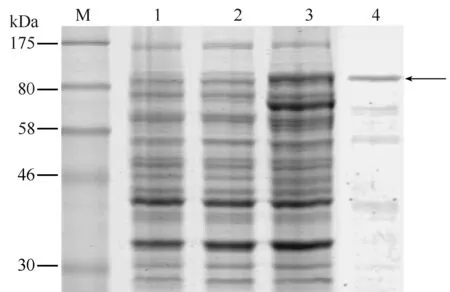
图2 融合蛋白rTs-Hsp70-Ts87的诱导表达及纯化产物的SDS-PAGE电泳分析Fig.2 Expression and purification of rTs-Hsp70-Ts87 by SDS-PAGEM: 蛋白分子量标准; 1: IPTG诱导表达的空质粒pET28a(+)全菌蛋白; 2: 未诱导表达的pET28a(+)/Ts-Hsp70-Ts87全菌蛋白; 3: IPTG诱导表达的pET28a(+)/Ts-Hsp70-Ts87全菌蛋白; 4: 纯化复性后的rTs-Hsp70-Ts87融合蛋白。M: Protein marker; 1: Crude E.coli lysate control (empty vector with IPTG induction); 2: Crude E.coli lysate without induction(pET-28a(+)/Ts-Hsp70-Ts87); 3: Crude E.coli lysate with IPTG induction(pET-28a(+)/Ts-Hsp70-Ts87); 4: Purified and refolded fusion protein rTs-Hsp70-Ts87.

图3 Western blot鉴定rTs-Hsp70-Ts87Fig.3 Western blot analysis of rTs-Hsp70- Ts87M: 蛋白分子量标准; 1: rTs-Hsp70- Ts87与抗His单抗相结合; 2:与rTs-Hsp70免疫血清相结合; 3: 与rTs87免疫血清相结合。M: Protein marker; 1: rTs-Hsp70- Ts87 recognized by anti-His MAb; 2: rTs-Hsp70- Ts87 recognized by rTs-Hsp70 immune sera; 3: rTs-Hsp70- Ts87 recognized by rTs87 immune sera.
2.3 重组蛋白rTs-Hsp70-Ts87的鉴定
用Western blot的方法对融合蛋白rTs-Hsp70-Ts87进行鉴定结果见图3。用抗His标签单抗检测重组蛋白表达,结果在100 kDa左右出现明显的蛋白印迹带,该蛋白的理论分子量与表达载体所携带的His标签的分子量相加约为100 kDa,与实验结果一致,提示融合蛋白表达正确。rTs-Hsp70-Ts87可分别被rTs-Hsp70免疫血清、rTs87免疫血清识别,提示该rTs-Hsp70-Ts87存在Ts-Hsp70和Ts87的抗原表位。
3 讨论
融合蛋白在基因表达、多功能酶研究、定向药物、新型细胞因子等方面均有广泛应用(张毅等, 2000; Schmidt, 2013)。如今,融合蛋白的应用更为疾病的治疗和预防带来新的希望。免疫球蛋白IgG1的Fc段已与TNFR、CTLA-4、 LFA-3、IL-1R等组成融合蛋白作为药物广泛应用于临床,对于免疫系统疾病如类风湿性关节炎、强直性脊柱炎、银屑病、家族性寒冷型自身炎症综合征和穆-韦(Muckle-Wells)两氏综合征等有较好疗效,且因其亚基FcγRs可作用于抗原提呈细胞调节免疫应答,也可与抗原结合用于疫苗的研究(Czajkowskyetal., 2012)。
Hsp70因其良好的免疫源性及佐剂作用被广泛用于多种融合蛋白的构建。例如:Hsp70与汉坦病毒核衣壳蛋白相融合,形成融合蛋白HTNV,可通过提高Th1型免疫反应,达到更好的免疫效果(Lietal., 2008);Hsp70也可与肿瘤相关抗原MAGE-A1相融合,提高抗原提呈能力,增强T细胞介导特异性免疫应答,对于表达MAGE-A1的肿瘤有高效的杀伤作用(Jiangetal., 2013)。另外,我们的前期工作证实,rTs-Hsp70可刺激树突状细胞成熟,提高Th1型细胞因子IFN-γ和IL-2及Th2型细胞因子IL-4和IL-6的分泌水平,与佐剂ISA50v2混合后免疫雌性BALB/c小鼠可获41.3%的肌幼虫减虫率(Fangetal., 2014),对旋毛虫感染有良好的免疫保护效果。而rTs87作为一种旋毛虫排泄分泌抗原同样可以诱导较好的抗旋毛虫免疫应答,但其作用仍需加强(Yangetal., 2010)。因此,为获得更高效的抗旋毛虫感染的疫苗,本研究将Ts-Hsp70与Ts87这两种疫苗候选蛋白的基因连接重组,并诱导表达了融合蛋白rTs-Hsp70-Ts87,为后续对融合蛋白rTs-Hsp70-Ts87免疫保护性的研究奠定了基础。
Hsp70基因有3个结构域,从N端到C端分别为核酸结合区,多肽底物结合区和可变区结构,前两者较为保守,是发挥其帮助蛋白质折叠和佐剂作用的关键区域(Kiangetal., 1998)。因而在构建融合蛋白的过程中通常将Hsp70置于N端,本研究依据这一特点,在构建表达质粒的过程中,将Ts-Hsp70连接于N端形成融合基因Ts-Hsp70-Ts87,这样有助于保留Ts-Hsp70协助蛋白质折叠的功能和其佐剂的作用。中间的连接采用EcoRⅠ酶切位点,该酶切位点表达谷氨酸和苯丙氨酸,对于整体蛋白的表达、折叠、抗原表位的形成影响不大(Lietal., 2008; Jiangetal., 2013)。
融合蛋白的构建方法主要有重叠延伸PCR、限制性内切酶酶切位点连接两种方法(闫璐颖等, 2008)。重叠延伸PCR法运用具有互补末端的引物,产生具有重叠序列的PCR产物,并将产物通过PCR的方式进行拼接(Yuanetal., 2012),此法多用于短片段和含有中间连接肽的融合蛋白的构建。限制性内切酶酶切位点连接利用限制性内切酶酶切位点将两个基因连接融合(Lietal., 2008)。此外,Invitrongen 公司开发的Gateway方法和Clontech公司研发的Infusion技术理论上均可应用于融合蛋白的制备,但由于成本较高,且中间需要插入不同大小的肽段,目前应用较少。本研究曾多次尝试运用重叠延伸PCR的方法进行目的片段的连接但均未成功,可能是由于Ts-Hsp70与Ts87片段较大且Ts87片段两端序列不太适宜引物的合成。随后我们改用限制性内切酶酶切位点连接法进行融合基因的构建,采用的酶切位点为EcoRⅠ酶切位点,经多次条件优化,最终成功将两个目的片段进行连接。上述结果提示,在对两种或两种以上已知序列的长片段基因进行连接时,宜选用限制性内切酶酶切位点连接的方法,且与PCR拼接法相比,此方法也更为经济快捷。
在融合蛋白的诱导表达过程中,本实验采用大肠埃希菌原核表达系统,所表达的融合蛋白为非可溶性蛋白,经纯化复性后可得到少量可溶蛋白。在前期研究中,大肠埃希菌原核表达系统表达出的蛋白rTs-Hsp70为可溶蛋白,rTs87为不可溶蛋白;二者融合后,分子量较大,可能是导致其不可溶的主要原因。另外,为提高蛋白表达量,我们探索了不同IPTG诱导剂浓度及不同诱导时间对于蛋白表达的影响,结果发现本实验中IPTG诱导剂浓度及诱导时间对蛋白表达无明显影响,因此后期实验仍采用实验室常规IPTG浓度及时间进行诱导表达。今后也可尝试酵母表达系统、昆虫表达系统对融合蛋白的表达进行优化。rTs-Hsp70-Ts87的Western鉴定结果发现 rTs-Hsp70-Ts87可被抗His标签单抗、rTs-Hsp70免疫血清、rTs87免疫血清识别,表明我们成功构建了融合蛋白rTs-Hsp70-Ts87,且此蛋白同时具有Ts-Hsp70和Ts87的抗原表位,可用于后续研究。
综上所述,本研究利用基因重组技术首次将旋毛虫的两种抗原分子Ts-Hsp70和Ts87的编码基因进行融合构建,并应用大肠杆菌原核表达系统成功诱导表达了该融合蛋白。此项工作为进一步探讨旋毛虫抗原融合蛋白的免疫保护性,及其作为疫苗候选抗原的可能性奠定了基础,并且为研制新型旋毛虫病疫苗提供了新的方向。
