粘质沙雷氏菌PL-06磷脂酶A1在大肠杆菌中的分泌表达及其条件优化
2015-11-10薛正莲苏燕南胡艳瑾
陈 环,薛正莲,*,王 洲,张 爽,苏燕南,胡艳瑾
(1.安徽工程大学生物与化学工程学院,安徽芜湖241000;2.微生物发酵安徽省工程技术研究中心,安徽芜湖241000)
粘质沙雷氏菌PL-06磷脂酶A1在大肠杆菌中的分泌表达及其条件优化
陈环1,2,薛正莲1,2,*,王洲1,2,张爽1,2,苏燕南1,胡艳瑾1
(1.安徽工程大学生物与化学工程学院,安徽芜湖241000;2.微生物发酵安徽省工程技术研究中心,安徽芜湖241000)
克隆粘质沙雷氏菌PL-06磷脂酶A1基因plaA,与载体pET-22b(+)连接构建重组质粒pET-22b(+)-plaA,并将重组质粒导入受体菌E.coli BL21(DE3)中表达,构建得到重组菌AP22,IPTG诱导表达目的蛋白后将培养基蛋白进行SDS-PAGE分析显示:重组蛋白以可溶性蛋白的形式大量存在于发酵液中,分子质量约35 ku,与预期蛋白大小一致。以磷脂酶A1酶活为指标,在单因素实验的基础之上,通过正交实验得到摇瓶培养最佳条件为:氨苄青霉素终浓度30 μg/mL,IPTG加量0.25 mmol/L,温度为34℃,OD600值为0.3,诱导时间4 h。在此条件下重组胞外磷脂酶A1酶活可高达8.6 U/mL,比优化前提高了43.3%。
磷脂酶A1,粘质沙雷氏菌,分泌表达,优化
磷脂酶A1广泛存在于动植物和微生物中,能催化磷脂第一位酯酰键的水解,生成溶血磷脂和脂肪酸。磷脂酶A1在工业上主要用于食品和非食品的磷脂乳化剂的修饰,增加油水混合物的乳化以及植物油脱胶等[1-3]。由于磷脂酶A1广泛的工业用途,对其的研究日益广泛[4]。微生物来源的磷脂酶A1有生产周期短、结构简单、易于工业化规模培养等优点,但野生菌株产量低、分离纯化困难,而且在食品安全方面存在一定的隐患[5-6]。近年来关于磷脂酶A1产生菌的研究表明产磷脂酶A1的细菌种类较多,如蜡状芽孢杆菌(Bacillus cereus),居泉沙雷氏菌(Serratia fonticola),荧光假单胞菌和灰色链霉菌等[7-10]。
随着生物工程相关技术的发展,基因克隆表达成为提高磷脂酶A1酶活的有效方式,如Fu等[11]克隆得到一个嗜冷细菌沙雷氏菌的磷脂酶A1基因,并实现了在大肠杆菌和毕赤酵母中的表达,Michael Givskov等[12]将克隆得到的液化沙雷氏菌(S.liquefaciens)磷脂酶A1基因在大肠杆菌体内进行表达,最终酶活不到1 U/mL,而来自沙雷氏菌MK1的磷脂酶A1基因在大肠杆菌中表达时,经条件优化后酶表达量最高为2.21 μg/100m培养基[13],苏燕楠等[14]将克隆得到的粘质沙雷氏菌PL-06磷脂酶A1基因plaA与载体pET28a连接,导入大肠杆菌BL21(DE3)表达,发酵液酶活仅为0.8 U/mL,主要得到无活性的包涵体,胞外可溶性表达量低。为了得到高活性、高可溶性表达的磷脂酶A1,本文采用分子生物学手段,从前期筛选到的一株产磷脂酶A1菌株粘质沙雷氏菌pL-06着手,克隆磷脂酶A1基因plaA,与分泌型质粒pET-22b连接,成功构建AP22菌株,并对其诱导分泌条件进行了优化。

表1 plaA基因扩增引物序列Table 1 Gene sequence of primer for plaA gene amplification
1 材料与方法
1.1材料与仪器
大肠杆菌JM109、粘质沙雷氏菌pL-06为本实验室筛选的高产磷脂酶A1菌株;BL21(DE3)菌株、表达载体pET-22b(+)(含氨苄青霉素抗性标记和pBR322复制位点,并含有T7、lacI启动子和T7终止子,可进行IPTG诱导) 均为本实验室保存;DNA标准Marker、T4 DNA连接酶、限制性内切酶购自MBI公司;分子生物学相关试剂盒和试剂均购自生工生物(上海)股份有限公司;其他化学药品均为国产分析纯。
MG96G PCR仪杭州朗基科学仪器有限公司;高速匀浆机上海弗鲁克流体机械制造有限公司;自动凝胶成像系统SYNGENE公司;JY92-2D超声波细胞粉碎机宁波新芝科器研究所;全自动高压灭菌锅华粤行仪器有限公司;PHSJ-3F pH计上海精密科学仪器有限公司;数显恒温水浴锅金坛市杰瑞尔电器有限公司。
1.2培养基与试剂
Luria-Bertani培养基:胰蛋白胨10 g,NaCL 10 g,酵母粉5 g,蒸馏水1000 mL,pH7.0。
氨苄青霉素(Amp):储液浓度50 mg/mL,工作浓度50 μg/mL。PLB培养基(卵磷脂+Luria-Bertani):卵磷脂20 g,胰蛋白胨10 g,NaCl 10 g,酵母粉5 g,0.02%溴甲酚紫30 mL,蒸馏水1000 mL,pH7.0。卵磷脂加少量Tween80用高速匀浆机乳化后单独灭菌。PB缓冲液:pH6.0 0.05 mol/L NaH2PO4-Na2HPO4缓冲液。
1.3磷脂酶A1酶活测定
参照国标GB/T 23535-2009[15]。酶活力定义为:1 g固体酶粉(或1 mL液体酶),在45℃和pH6.0条件下,1 min水解磷脂产生1 μmol的可滴定脂肪酸,即为1个酶活力单位(U/g或U/mL)。
1.4磷脂酶A1基因的克隆与表达
以菌粘质沙雷氏菌PL-06基因组DNA为模板,用Primer Premier 5.0设计引物扩增磷脂酶A1基因(plaA)。将扩增得到的磷脂酶A1基因plaA经EcolⅠ和BamHⅠ双酶切后与同样双酶切的pET22b(+)质粒连接,然后转入大肠杆菌JM109感受态细胞中,在含有氨苄抗性的平板上初筛,挑取转化子进行菌落PCR,挑取菌落PCR正确的转化子提取质粒,然后双酶切验证重组质粒并送生工生物(上海)股份有限公司测序,引物序列见表1。测序成功后转化至大肠杆菌BL21(DE3),构建工程菌AP22,涂布于含有氨苄青霉素的PLB培养基,根据是否有水解晕圈筛选阳性克隆。
1.5重组菌诱导酶活的初步测定及SDS-PAGE凝胶电泳检测
挑取AP22单克隆接种至5 mL LB/Amp液体培养基中200 r/min过夜培养,按2%接种量转接至100 mL LB/Amp液体培养基中,37℃、200 r/min振荡培养至OD600值为0.8时,加入终浓度为0.2 mmol/L IPTG继续培养4 h。诱导结束后分别对发酵液、发酵上清和破碎菌体进行酶活测定,并用SDS-PAGE检测目的蛋白在大肠杆菌中的表达。诱导结束后取样制备蛋白质样品,制备方法参照文献[16]。
1.6重组菌株生长曲线的测定
从平板上挑取AP22、P22[pET-22b(+)/BL21(DE3)]单菌落接种于装有5 mL LB液体培养基的培养管中,37℃、200 r/min过夜培养,按2%的接种量转接于装有100 mL LB液体培养基的250 mL三角瓶中,37℃、200 r/min振荡培养,待菌体OD值生长至0.8时加入IPTG诱导并开始计时,每隔1 h取样测OD600值。以时间为横坐标做该重组菌的生长曲线。
1.7AP22诱导产酶条件的单因素实验
接2 mL过夜活化的AP22菌液至100 mL LB培养基中,分别从诱导时间、诱导温度,加入IPTG时的OD值、IPTG加量和氨苄青霉素(Amp)浓度五个方面通过改变单因子的方法进行诱导优化AP22产酶条件。诱导时间分别为:2、4、6、8、10、12 h;诱导温度分别为:25、30、37、42℃;加入IPTG时的OD值分别为:0.2、0.5、0.8、1.0、1.2;IPTG加量分别为:0、0.05、0.1、0.2、0.3、0.5、0.7、1.0 mmol/L;Amp加量分别为:10、25、50、100、150、200 μg/mL;诱导结束后进行酶活定量测定。参照文献[13]初步选定在氨苄青霉素终浓度100 μg/mL,IPTG加量0.2 mmol/L,温度为37℃,OD600值为0.8条件下开始进行单因素优化。
1.8AP22诱导产酶条件的正交实验
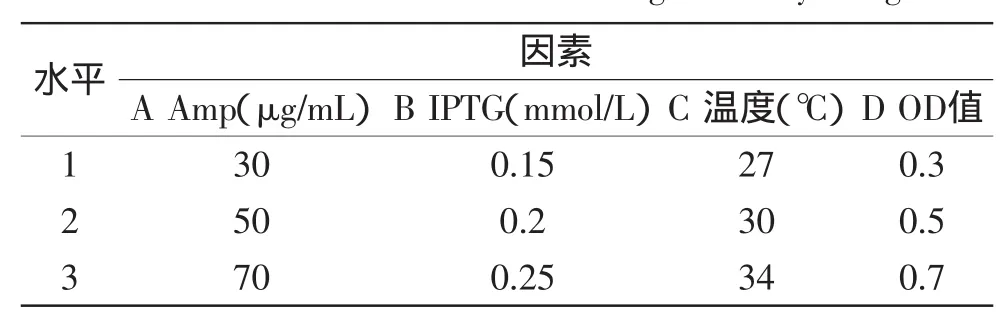
表2 正交实验因素水平表Table 2 Factors and levels for orthogonal array design
从以上单因素实验结果可以看出,氨苄青霉素(Amp)终浓度,IPTG加量,诱导温度,加入IPTG时的OD值四个因素对磷脂酶A1酶活影响较大,因此正交实验设计了四因素三水平对磷脂酶A1产酶条件进一步优化。4个因素分别记做A、B、C、D,各因素均取3个水平,设计L9(34)正交实验。因素水平表见表2。
1.9验证实验
按照正交实验得出的最佳诱导条件进行3次验证实验。
1.10数据处理
本文数据处理采用Origin 8.0,方差分析使用软件SPSS 18.0。
2 结果与讨论
2.1磷脂酶A1基因的扩增
用设计的引物扩增磷脂酶A1基因,琼脂糖凝胶电泳表明在约1000 bp处有明显的条带如图1(a)所示。将扩增产物及原核表达载体pET-22b(+)用BamHⅠ和EcoRⅠ双酶切,酶切产物纯化后用T4 DNA连接酶进行连接反应,构建pET-22b-plaA重组质粒并转入大肠杆菌JM109中。构建的重组质粒经双酶切验证,结果如图1(c)所示。DNA测序鉴定结果与NCBI公布的磷脂酶A1基因序列(genbank登录号:JX138535)比对,结果显示该片段序列完整且阅读框正确,表明原核表达载体pET22b(+)-plaA构建成功。将构建成功后的表达载体pET22b(+)-plaA转化至表达宿主菌BL21(DE3),结果如图1(b)所示,挑取有水解圈的菌落即为阳性克隆。

图1 目的基因扩增结果、重组菌的筛选和plaA-pET-22b(+)双酶切验证图Fig.1 PCR amplification of the target gene,Screening of recombinant stains and Double digest analysis of plaA-pET-22b(+)
2.2重组质粒在大肠杆菌中的表达
将验证正确的重组质粒plaA-pET-22b(+)转化至感受态表达菌株BL21(DE3)中,按上述1.5节方法进行诱导及SDS-PAGE电泳鉴定。结果如图2所示,在发酵液、细胞破碎上清和破碎沉淀中均有特异性条带,因此构建的重组菌plaA-pET-22b(+)/BL21(DE3)成功表达了分子质量为35 ku重组蛋白,与预期值相符,说明磷脂酶A1基因plaA在大肠杆菌BL21(DE3)中得以表达。

图2 大肠杆菌重组磷脂酶A1的SDS-PAGE电泳Fig.2 SDS-PAGE analysis of recombination plaA
2.3AP22诱导酶活的测定
如表3所示,重组菌酶活主要在发酵液中,发酵上清和破碎菌体中酶活之和基本上与发酵全酶活即发酵液酶活相等,说明有活性的磷脂酶A1大量分泌到胞外,便于后续AP22产酶条件的优化,为了操作方便后续条件优化均选择发酵液作为粗酶液进行酶活测定。

表3 酶活测定Table 3 Enzyme assay
2.4重组菌株生长曲线的测定
如图3所示,AP22和P22生长情况基本一致,而在AP22中加入IPTG后生长受到了抑制,可以认为基因plaA本身对重组菌的生长没有影响,但是经过IPTG诱导后生长受到抑制,一方面可能是IPTG本身有毒性,对菌体生长也有一定程度毒害作用,另一方面可能是由于磷脂酶A1对宿主细菌的毒性,磷脂酶A1的高活性表达对于宿主菌往往是致命的,会导致其菌体自溶导致菌体生长变慢[17]。
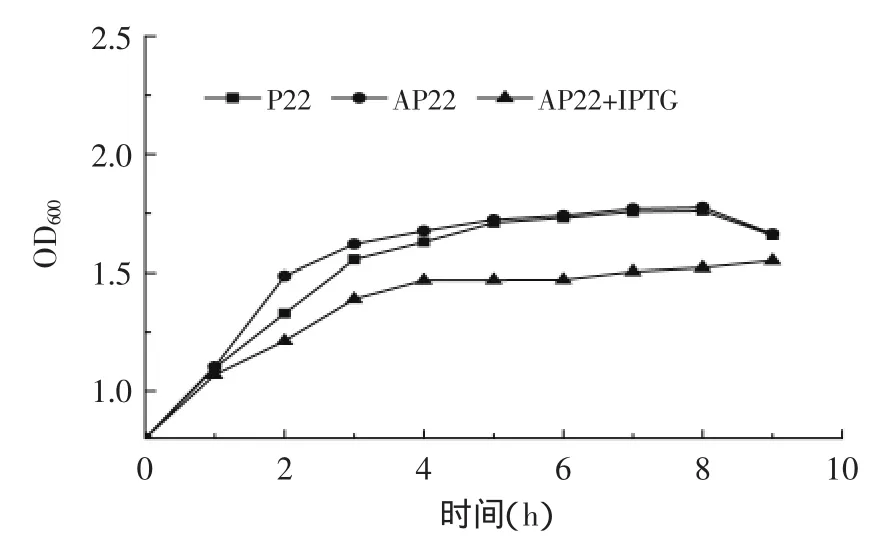
图3 重组菌生长曲线Fig.3 Growth curve of recombinant strain
2.5AP22单因素诱导产酶条件优化
2.5.1最佳诱导时间的确定诱导时间的长短对外源蛋白表达量的多少有较大影响,诱导时间过短目的产物没有充分表达,导致表达量低,由于IPTG和目的产物磷脂酶A1对菌体都有一定的毒害作用,所以诱导时间过长菌体可能发生自溶[17],影响目的产物表达量。因此,诱导时间对产磷脂酶A1有较大影响。按照1.7节方法进行最佳诱导时间的确定。结果如图4所示,诱导时间对酶活有一定程度的影响,随着时间的延长酶活增加,当诱导时间为4 h时酶活性最高,随后随着时间的递增而逐渐减小,因此确定最佳诱导时间为4 h。

图4 诱导时间对酶活的影响Fig.4 Effect of induction time on enzyme activity
2.5.2最佳IPTG浓度的确定IPTG作为诱导剂能启动lac启动子的转录,使目的基因得以表达,但是IPTG本身对细胞具有一定的毒性,对菌体生长有一定抑制作用,并且价格昂贵,所以IPTG的添加量并不是越高越好,因此,确定最佳的IPTG浓度非常重要。在最佳诱导时间条件下按照1.7节方法探讨IPTG浓度对产磷脂酶A1的影响。由图5可知,IPTG浓度对酶活影响较为明显,随着IPTG浓度的增加酶活明显提高,在IPTG浓度为0.2 mmol/L时酶活最高,随着IPTG浓度的增加反而降低,所以最佳IPTG诱导浓度为0.2 mmol/L。

图5 IPTG浓度对酶活的影响Fig.5 Effect of IPTG concentration on enzyme activity
2.5.3最佳氨苄青霉素浓度的确定随细菌培养时间的增加β-内酰氨酶将逐渐释放到溶液中去,降解溶液中的Amp[18],不具有生长优势的表达菌又失去了选择压力,造成大部分新生细菌无质粒,表现为表达困难,由于Amp本身对细胞生长有一定抑制作用,所以Amp浓度并不是越高越好,因此合适的Amp浓度至关重要。在最佳诱导时间和IPTG浓度条件下,按照1.7节方法对Amp浓度对产磷脂酶A1的影响进行了探讨。结果如图6所示,Amp浓度对产磷脂酶A1有较大影响,当Amp浓度为50 μg/mL时酶活最高,高于50 μg/mL时酶活逐渐下降,因此确定最佳Amp浓度为50 μg/mL。

图6 Amp浓度对酶活的影响Fig.6 Effect of Amp concentration on enzyme activity
2.5.4最佳诱导起始OD的确定诱导起始OD对菌体产酶有着较大影响,在对数生长期细胞代谢活性最强,细菌旺盛生长,代时最短,细胞代谢最强,体内各种酶的代谢都处于旺盛阶段,此时诱导利于外源蛋白的合成。若诱导时间过早,由于菌体量太少可能会降低外源蛋白产量;若诱导时间过迟,由于细菌过老自身代谢能力下降,所以不利于外源基因表达。在最佳诱导时间、IPTG和Amp浓度条件下,按照1.7节方法进行最佳诱导起始OD的确定。结果如图7所示,OD600值为0.5时酶活最高,随着起始OD600值的增加酶活明显下降,所以确定最佳诱导起始OD600为0.5。
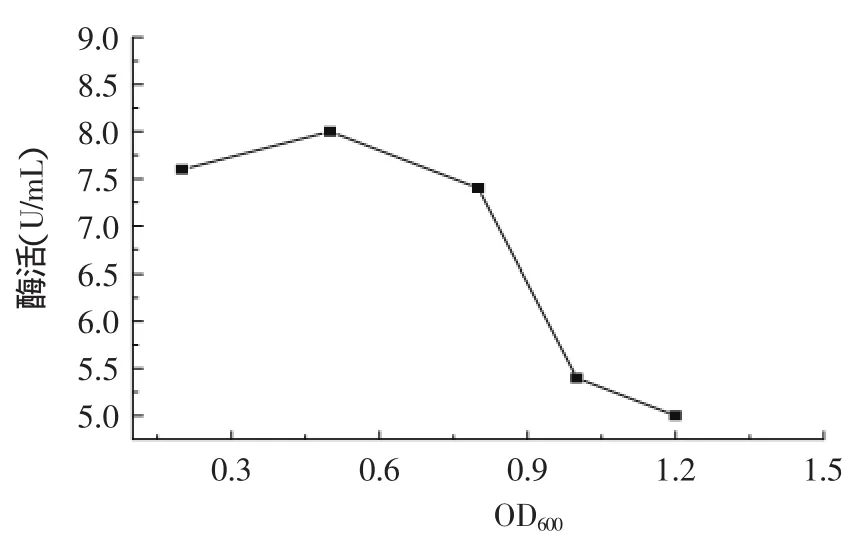
图7 诱导OD对酶活的影响Fig.7 Effect of induction OD on enzyme activity
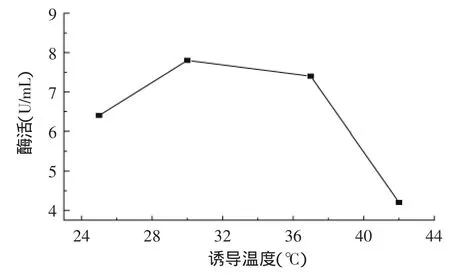
图8 诱导温度对酶活力的影响Fig.8 Effect of induction temperature on enzyme activity
2.5.5最佳诱导温度的确定大肠杆菌的最适生长温度是37℃,若诱导温度过高易使重组蛋白折叠错误,使目的蛋白大量以无活性的包涵体形式存在,降低胞外酶活。若温度过低会影响菌体生长,从而影响重组蛋白表达,所以诱导温度对胞外酶活至关重要。在最佳单因素条件下按照1.7节方法进行最佳诱导温度的确定。结果如图8所示,诱导温度过高严重降低了酶活,当诱导温度为30℃时酶活最高,诱导温度低于30℃时酶活也有一定程度的下降,所以确定30℃为最佳诱导温度。
综上所述,由单因素实验得到的重组大肠杆菌AP22诱导条件为:在含有终浓度为50 μg/mL Amp的培养基中培养至OD600值为0.5时加入终浓度为0.2 mmol/L的IPTG诱导,30℃诱导培养4 h。
2.5.6正交实验表4结果说明,各因素对磷脂酶A1酶活的影响程度依次为诱导OD值(D)>诱导温度(C)>IPTG加量(B)>氨苄青霉素终浓度(A),由方差分析表5得知四因素对酶活的影响都较为显著。在实验设计范围内,确定诱导AP22得到磷脂A1酶活的最佳条件为A1B3C3D1,即抗生素浓度30 μg/mL,IPTG浓度0.25 mmol/L,温度为34℃,OD值为0.3,诱导时间为4 h。
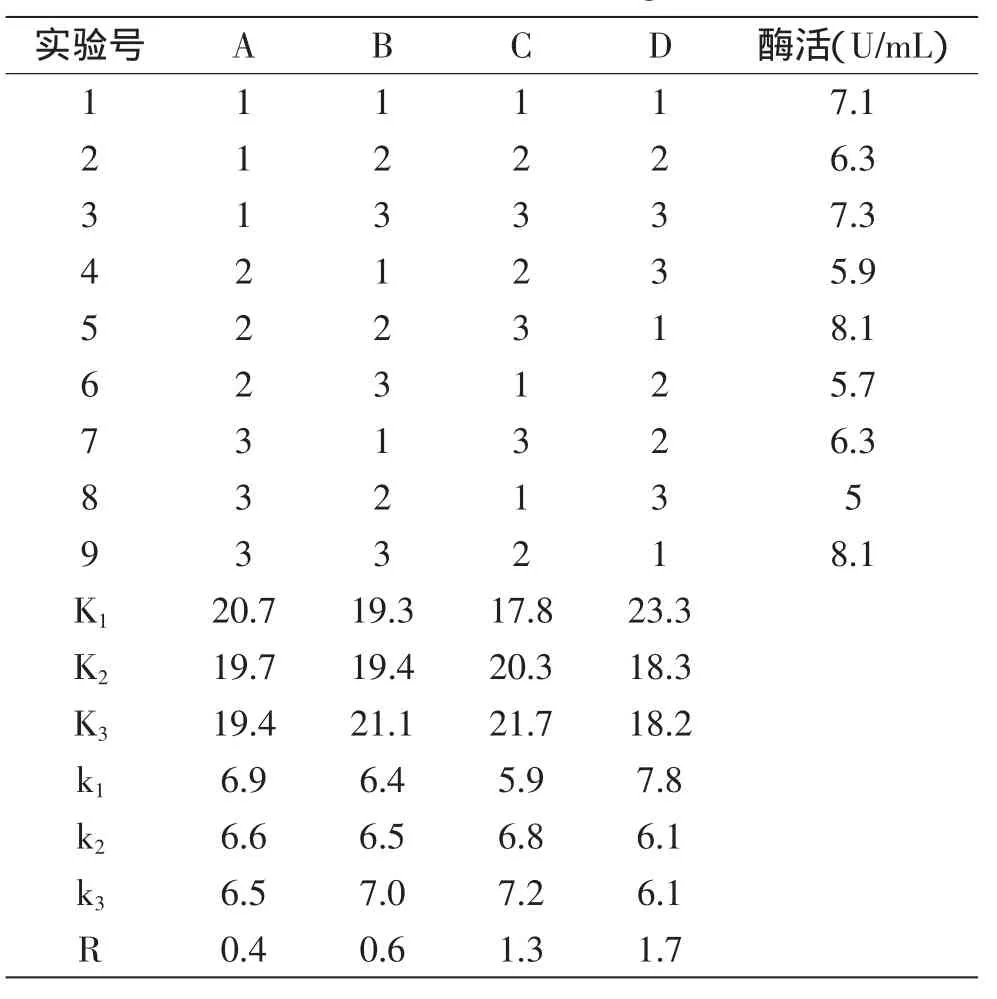
表4 正交实验结果Table 4 Results of the orthogonal test
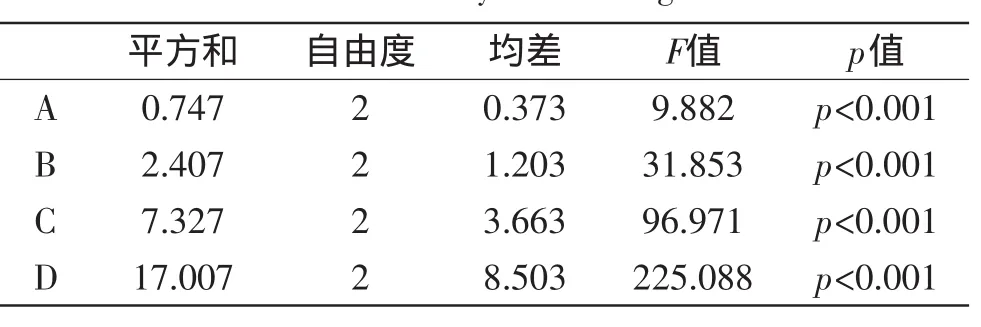
表5 正交实验方差分析表Table 5 Variance analysis of orthogonal results
2.5.7验证实验按照最佳诱导优化条件,即抗生素浓度30 μg/mL,IPTG浓度0.25 mmol/L,温度为34℃,OD600值为0.3,诱导时间为4 h,进行3次验证实验,得到磷脂酶A1平均酶活为8.6 U/mL。
3 结论
通过磷脂酶A1基因与pET-22b(+)载体的连接,成功实现了磷脂酶A1的原核表达,在单因素实验的基础上进行了正交实验,得出最佳诱导条件,使重组磷脂酶A1发酵液酶活达由正交实验前的6.0 U/mL提高到8.6 U/mL,比在pET-28a(+)载体中表达2.3 U/mL[14]的酶活提高了2.7倍,由此说明带有T7和lacI启动子的pET-22b(+)质粒具有较强的启动能力,适用于表达毒性较大的基因,并且有利于重组蛋白分泌到胞外,获得最大产量的可溶、有活性、正确折叠及可分泌到培养基中的磷脂酶A1蛋白,从而简化后续分离提纯实验,对低成本生产的微生物来源的磷脂酶A1具有重要意义,而且可为利用大肠杆菌生产分泌型重组异源蛋白提供进一步的技术措施。后续工作将利用其N端His标签进行分离纯化,获得的纯酶用于研究重组磷脂酶A1的酶学性质及一些应用。
[1]李秋生,杨继国,杨博,等.不同磷脂酶用于植物油脱胶的研究[J].中国油脂,2004,29(1):19-22.
[2]杨博,王洪建.经济环保的酶法脱胶技术[J].中国油脂,2004,29(3):21-23.
[3]Kim I H,Garcia H S,Hill C G Jr.Phospholipase A1-catalyzed synthesis of phospholipids enriched in n-3polyunsaturated fatty acid residues[J].Enzyme and Microbial Technology,2007,40:1130-1135.
[4]Joshi A,Paratkar S G,Thorat B N,et al.Modification of lecithin by physical,chemical and enzymatic methods[J].European Journal of Lipid Science and Technology,2006,108:363-373.
[5]Ramrakhiani L,Chand L.Recent progress on phospholipases:differentsources,assaymethods,industrialpotentialand pathogenicity[J].Appl Biochem Biotech,2011,164(7):991-1022.
[6]Studier F.Protein production by auto-induction in highdensity shaking cultures[J].Protein Expres Purif,2005,41(1):207-234.
[7]李军红,姜绍通,操丽丽,等.磷脂酶产生菌株的筛选及其性质研究[J].食品科学,2008,29(11):418-421.
[8]付建红,唐辉桂,姚斌,等.一株产低温碱性磷脂酶A1耐冷细菌的筛选及发酵条件的初步研究[J].工业微生物,2008,38(5):12-16.
[9]姜芳燕,王金梅,戴大章,等.产磷脂酶菌株的筛选鉴定及其应用[J].化工学报,2012,63(3):887-893.
[10]赵梦梦,薛正莲,苏燕南,等.产磷脂酶A1菌株的筛选及其发酵条件的优化[J].中国生物制品学杂志,2012,25(7):901-905.
[11]Fu J H,Huang H Q,Meng K.A novel cold-adapted phospholipase A1 from Serratia sp.xjF1:Gene cloning,expression and characterization[J].Enzyme and Microbial Technology,2008,42:187-194.
[12]Michael G,Lars O,Soren M.Cloning and expression in Escherichia coli of the gene for extracellular phospholipaseAl from serratia liquefaciens[J].Journal of Bacteriology,1988,170(12):5855-5862.
[13]Song J KKim M K,Rhee J S.Cloning and expression of the gene encoding phospholipase A1 from Serratia sp.MK1 in Escherichia coli[J].Journal of Biotechnology,1999,72:103-114.[14]苏燕南,薛正莲,陈涛,等.粘质沙雷氏菌PL-06磷脂酶A1基因大肠杆菌优化表达[J].中国生物工程杂志,2013,33(7):36-42.
[15]中国国家标准化管理委员会.GBT23535-2009,脂肪酶制剂[S].北京:中国标准出版社,2009.
[16]刘菲菲,张梁,顾正华,等.蜡状芽孢杆菌磷脂酶C基因在大肠杆菌中的异源表达[J].食品科学,2013,34(11):182-187.
[17]Richmond G S,Smith T K.Phospholipases A1[J].International Journal of Molecular Science,2011,12:588-612.
[18]Novagen.pET System Manua[EB/OL].2003,TB055(10):18.www.novagen.com.
Secretive expression and optimized condition of phospholipase A1 gene from Serratia marcescens PL-06 in Escherichia coli
CHEN Huan1,2,XUE Zheng-lian1,2,*,WANG Zhou1,2,ZHANG Shuang1,2,SU Yan-nan1,HU Yan-jin1
(1.Institute of Biologic,Chemical Engineering of Anhui Polytechnic University,Wuhu 241000,China;2.Microorganism Fermentation Engineering and Technology Research Center of Anhui Province,Wuhu 241000,China)
The phopholipase A1 gene from Serratia marcescens PL-06 named plaA was cloned,ligased with pET-22b(+)to construct recombinant plasmid pET-22b(+)-plaA and then transferred to E.coli BL21(DE3). The engineered stains expressing phospholipase A1 was obtained,and named AP22.After subsequent indution by IPTG,lots of approximately 35 ku protein was detected in the fermented liquid by SDS-PAGE.This protein was in the same size with the expected protein.Selectioning phospholipase A1 enzyme activity as reference,by single factor and orthogonal experiment method,optimized induction conditions for phopholipase A1 expression were obtained as follows:ampicillin concentration 30 μg/mL,IPTG concentration 0.25 mmol/mL,inducing temperature 34℃,strain density OD6000.3 and induction time 4 h.Under the optimized conditions,maximum phospholipase A1 enzyme activity was observed to be 8.6 U/mL and increased by 43.3%than before.
phospholipase A1;Serratia marcescens;secretory expression;optimization
TS201.2
A
1002-0306(2015)16-0193-06
10.13386/j.issn1002-0306.2015.16.031
2014-11-18
陈环(1989-),女,在读硕士研究生,研究方向:粘质沙雷氏菌磷脂酶A1表达系统的优化,E-mail:chenhuan0206@126.com。
薛正莲(1967-),女,硕士,教授,研究方向:工业微生物育种及发酵过程控制、酶的生产及应用、微生物制药等,E-mail:xuezl@ahpu.edu.cn。
国家自然科学基金(C200504);安徽省自然科学基金(11040606M81)。
