浅析高考试题中的差异充气电池
2015-11-09吴克勇蔡子华
吴克勇+蔡子华
摘要:结合高考试题中出现的一些金属腐蚀形式,介绍了差异充气电池形成的根本原因,并就因供氧差异而产生的一些重要吸氧腐蚀形式如盐水滴腐蚀、水线腐蚀的具体形成机理加以介绍,可为相关教学提供有益的参考,并期望能引起广大教师对自身专业发展的认识和重视。
关键词:差异充气电池;氧浓差电池;盐水滴腐蚀;水线腐蚀;高考试题
文章编号:1005–6629(2015)9–0078–04 中图分类号:G633.8 文献标识码:B
金属与含氧量不同的溶液相接触而形成腐蚀电池,又称差异充气电池或供氧差异腐蚀电池。它是吸氧腐蚀的一种重要形式,也是普遍存在的、危害性很大的腐蚀形式,是造成金属局部腐蚀的重要因素之一,是引起盐水滴腐蚀、水线腐蚀、沉积物腐蚀和缝隙腐蚀的主要原因。在近几年的各地高考试题中,以这类腐蚀为背景的试题频繁出现。
1 差异充气电池形成的根本原因
许多腐蚀发生的原因在于差异充气,如钢铁材料在实际的应用中,因为某种原因造成了金属表面不同区域的溶解氧浓度不同,从而形成供氧差异腐蚀电池,在与缺氧溶液相接触的金属表面发生了强烈的腐蚀,而与富氧溶液相接触的金属表面相对来讲腐蚀微弱,即形成缺氧溶液区域为腐蚀电池的阳极区,腐蚀速率加快;而富氧溶液区域为腐蚀电池的阴极区,腐蚀速率减慢。
在一些教材[1]中,把这种由于供氧差异而形成的电池称为“氧浓差电池”,并用能斯特方程式来解释这种腐蚀电池的成因,这种解释是错误的。首先,金属在腐蚀介质中处于自腐蚀状态下的电位称为自腐蚀电位,常简称为腐蚀电位。通常,腐蚀介质中起初并不含有腐蚀金属的离子,腐蚀体系是不可逆体系,因此腐蚀电位是离开平衡电极电位相当远的非平衡电极电位,与该金属的标准平衡电位偏差很大。随着腐蚀的进行,电极表面附近该金属的离子会逐渐增多,因而腐蚀电位随时间推移发生变化。一定时间后,腐蚀电位趋于稳定,这时的电位可称为稳定电位,但仍不是可逆平衡电位,其原因是金属仍在不断地溶解,而阴极去极化剂(腐蚀剂)仍在不断地消耗,不存在物质的可逆平衡。而只有可逆电极才能满足能斯特方程式,因此用能斯特方程式来解释供氧差异腐蚀电池的形成是不正确的。其次,如果两个电极体系仅是由于溶解氧浓度的不同,而金属的表面阳极溶解将遵循同一动力学规律,是不会导致缺氧区域强烈的局部腐蚀,而只会使两个区域阳极溶解速率相等。
实际上,当钢铁表面形成供氧差异腐蚀电池时,随着腐蚀过程的进行,因电极反应产物和电场作用下的离子迁移的影响引起溶液的成分等因素发生变化,进而引起金属表面不同区域的阳极行为也随之发生了方向不同的变化,与富氧溶液接触的表面区域因为供氧充足和pH升高而使氧化膜加厚,变得致密,阳极过程变得比原来更难进行,而与缺氧溶液接触的表面区域因供氧不足、pH下降以及氯离子的富集而被减薄直至完全溶解,阳极过程变得比原来更容易进行,尽管腐蚀电位不变,但富氧区域的腐蚀电流密度降低,缺氧区域的腐蚀电流密度增大。这种不同表面区域的阳极行为差异,会导致阳极区和阴极区之间有电流流过,也必然带来各区域溶液的组成和金属的表面状态进一步发生变化,腐蚀过程的进行不但不会被消弱,反而会加强,最终导致与缺氧区域溶液接触的表面部分(阳极区)发生了严重的局部腐蚀。
常见的局部腐蚀,如水线腐蚀、缝隙腐蚀、沉积物腐蚀、盐水滴腐蚀等都是由差异充气电池引起的。
2 各种形式的差异充气电池
2.1 氧浓差电池
例1 (2011年海南化学卷第12题)根据图1,下列判断中正确的是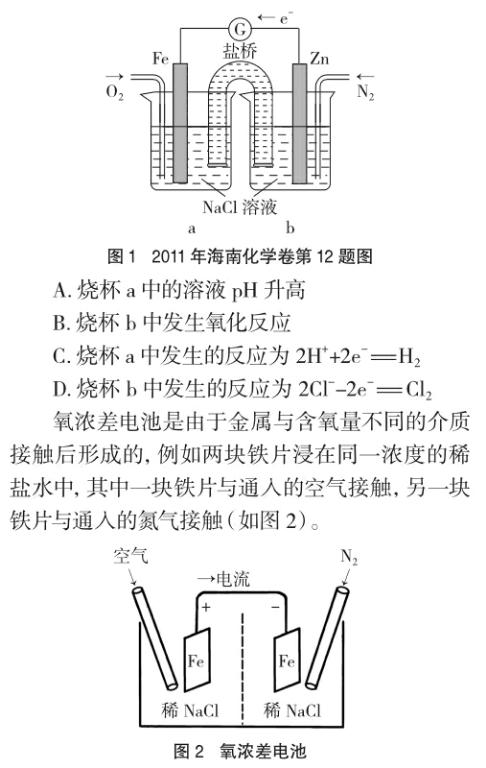
在这两块铁片上负电荷密度本来应该是相同的,但是由于溶液中含氧量不同,在发生下列反应时所进行的程度也不同:O2+2H2O+4e-=4OH-。在通入空气的铁电极上,氧气的还原反应较迅速,因而表面电子被中和,负电荷密度降低较多。在通入氮气因而空气较少的铁电极上,氧气的还原反应难以进行,因此负电荷密度几乎没有什么变化。这样,由于溶液中氧气浓度的不同造成了电位差,产生了腐蚀电流。在上述电池中可观察到,与氮气接触的铁片发生了溶解,而与空气接触的铁片没有腐蚀。
在例1中,可能是命题者出于降低试题难度的考虑,将两个电极设置为活泼性不同的两种金属,但其实质仍然是氧浓差电池,该题的正确答案应该为A、B。
2.2 盐水滴腐蚀
例2 (2011年浙江理综卷第10题)将NaCl溶液滴在一块光亮清洁的铁板表面上,一段时间后发现液滴覆盖的圆周中心区(a)已被腐蚀而变暗,在液滴外沿棕色铁锈环(b),如图3所示。导致该现象的主要原因是液滴之下氧气含量比边缘少。下列说法正确的是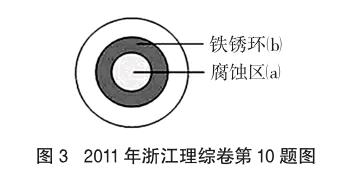
A.液滴中的Cl-由a区向b区迁移
B.液滴边缘是正极区,发生的电极反应为:O2+2H2O+4e-=4OH
C.液滴下的Fe因发生还原反应而被腐蚀,生成的Fe2+由a区向b区迁移,与b区的OH-形成Fe(OH)2,进一步氧化、脱水形成铁锈
D.若改用嵌有一铜螺丝钉的铁板,在铜铁接触处滴加NaCl溶液,则负极发生的电极反应为Cu-2e-=Cu2+
该题涉及的是一个早期进行的、经典的腐蚀实验,称为盐水滴实验[2],这也是一种局部腐蚀现象。盐水滴实验是在一块抛光、干净的钢片上滴上一滴含有少量酚酞和铁氰化钾并为空气所饱和的食盐水。在液滴覆盖的区域内很快就出现粉红色和蓝色的小斑点(图4-a)。再过几分钟,则液滴中心部分主要呈现蓝色,液滴边缘为一红色圆环,而在两者之间有一棕褐色环(图4-b)。

由于钢铁表面的划痕或成分的不均匀,盐水滴接触钢板表面后,出现的蓝色斑点是微电池的负极区,铁溶解产生的Fe2+与铁氰化钾反应,生成滕氏蓝沉淀Fe3[Fe(CN)6]2,故该区域呈现蓝色。蓝色以外的区域是正极区,发生反应O2+2H2O+4e-=4OH-,生成的OH-使酚酞变红,所以该区域呈现粉红色。图4-a中的这种微电池分布情况称为初生分布,这种分布情况不会持续很久。当液滴中的氧气逐渐被消耗,需要从空气中补充氧气时,作为腐蚀介质的盐水滴出现了含氧气不均匀的情况:液滴中心部位,由于液层较厚,氧气从空气中通过扩散到达中心部位的钢板表面路程较长,故供氧较慢,成为贫氧区域,原有的正极反应逐渐终止,在这里主要进行铁溶解的电极过程,故呈现蓝色;而液滴边缘部分液膜较薄,氧气容易到达,成为富氧区域,主要进行氧分子的还原反应,形成大量的OH-离子,这里原有的负极区被新生成的较致密的Fe(OH)2所覆盖,氧化反应停止,蓝色斑点消失,所以边缘上呈现粉红色。负极区产物Fe2+和正极区产物OH-,由于扩散和电迁移,在中间区域相遇,首先生成Fe(OH)2,之后被大气中的氧气进一步氧化生成棕褐色的铁锈。故中心的蓝色区域和边缘的粉红色区域之间,存在着一个棕褐色圆环。根据上述分析,随着腐蚀过程的进行腐蚀电池中将产生净电流。在液滴内电流从中心向边缘呈辐射状流动,然后进入钢板;在钢板内部,电流则是由边缘流向中心。如果将形成次生分布后的试件,置于磁场中,则会观察到液滴像电动机中的转子似地转动;如果改变磁场方向,则液滴又会反方向旋转。这充分证明了液滴内部确实有电流流动,因此这一实验有力地证明了金属腐蚀的电化学机理。
综上分析,例2的答案为B。
2.3 水线腐蚀
例3 (2014年福建理综卷第24题)铁及其化合物与生产、生活关系密切。
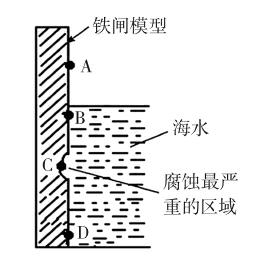
(1)图5是实验室研究海水对铁闸不同部位腐蚀情况的剖面示意图。
①该电化腐蚀称为 。
②图中A、B、C、D四个区域,生成铁锈最多的是
(填字母)。
……
人们在生活中获得这样的经验,一个未装满水的金属容器常比完全装满水的容器容易腐蚀。在腐蚀科学发展史上,艾文斯曾经进行过一个著名的实验[3],他将金属Zn试样垂直插入含KCl的电解质溶液中,试样的一半浸入溶液中,另一半暴露于空气中,结果发现,金属Zn试样从底部开始腐蚀,逐渐向上蔓延,底部腐蚀很严重。我们在实际生产中也会发现许多类似的实例,例如,桥桩、船体、储罐等在静止的中性水溶液中受到严重腐蚀的部位常在靠近水线下面,受腐蚀部位形成明显的沟或槽。这种腐蚀称为水线腐蚀,如图6所示,这是生产上最普遍的一种局部腐蚀。
之所以会发生水线腐蚀,是由于液面下不同距离处水中的氧气含量不同,水的表层含有较高浓度的氧气,表层的氧气如果被消耗,将可及时从大气中得到补充,但氧气的扩散速度缓慢,水的下层氧气浓度则较低,水下层的氧气被消耗后由于氧气不易到达而补充困难,因而产生了氧气的浓度差。表层为富氧区,水下为贫氧区,富氧区的金属表面主要进行O2的还原反应:O2+2H2O+4e-= 4OH-,贫氧区的金属表面主要发生金属的氧化溶解。远离水线以下的区域虽然氧气浓度低,但由于距离远,水溶液的电阻大,腐蚀电流小,因而腐蚀并不严重,通常严重腐蚀的部位离开水线是不远的,故称水线腐蚀。
钢铁的生锈和腐蚀是不同的两个概念,铁氧化转化为亚铁离子,变质损坏,是腐蚀;铁生成水合氧化铁是生锈。钢铁闸门在海水中发生吸氧腐蚀的过程中,所生成的亚铁离子扩散到接近水面区域,和OH-相遇形成Fe(OH)2,并继续演化形成铁锈。(当然,上部区域的OH-也会扩散到下部,但是,下部氧气少,形成铁锈能力弱。)相反,下部的铁闸氧化腐蚀的程度大于接近水面的区域。这在日常生活中是可以观察到的,如钉入木头很久的锈铁钉,钉的下部比上部腐蚀更严重,变得更细,钉的上部表面锈得更厉害。
所以,上述例题中,②的答案为B。
此外,在工程部件中常用铆、焊,螺钉等方法连接,在其连接处形成的缝隙深处因供氧困难导致严重的局部破坏,疏松的沉积物下面发生的垢下腐蚀,也是差异充气电池造成的。
随着科学的发展,人们对一些自然现象和问题的认识会逐步深入,及时吸收一些新的发现、新的认识,补充到我们的日常教学之中,这不仅仅是教材编写者应该考虑的问题,同时也是教师教学应关注的。这种补充不但会丰富我们的教学,也会激起学生强烈的探究欲望。不要让高考试题倒逼我们,我们才想起做改变。化学的发展已经渗透到自然科学的各个方面,成为人类进步的关键,涉猎与化学密切相关的一些学科,将广泛地拓展化学教师对化学本身的认识,也将极大地改变我们的日常教学。
参考文献:
[1]杨文治.电化学基础[M].北京:北京大学出版社,1982:246.
[2]朱日彰等编.金属腐蚀学[M].北京:冶金工业出版社,1989:98.
[3]李松林编著.材料化学[M].北京:化学工业出版社,2008:224.
[4]曹楚南.腐蚀电化学原理[M].北京:化学工业出版社,2008:230.
