石榴皮多酚对糖尿病小鼠肾脏抗氧化防御功能的影响
2015-11-08唐远谋许丽佳蒋卫东
唐远谋,许丽佳,蒋卫东,李 尊
(1.成都大学临床医学院,四川成都610106;2.四川大学轻纺与食品学院,四川成都610065;3.成都大学,四川成都610106)
石榴皮多酚对糖尿病小鼠肾脏抗氧化防御功能的影响
唐远谋1,2,许丽佳3,蒋卫东3,李尊3
(1.成都大学临床医学院,四川成都610106;2.四川大学轻纺与食品学院,四川成都610065;3.成都大学,四川成都610106)
探究石榴皮多酚对实验性糖尿病小鼠辅助调节血糖功能及肾脏抗氧化能力的影响。用低、中、高剂量的石榴皮多酚灌胃糖尿病小鼠6周后,观察其血糖、体重变化和肾脏的抗氧化能力变化。结果表明:石榴皮多酚能有效的降低糖尿病小鼠的血糖浓度,体重相比无统计学意义;石榴皮多酚组小鼠与糖尿病组比较,MDA含量、NO含量和GSH-Px水平降低,CAT和GSH含量增加,且均具有统计学差异(p<0.05或p<0.01),表明石榴皮多酚能提高糖尿病小鼠肾脏抗氧化酶的活性,减少糖尿病小鼠肾脏组织的氧化应激;而石榴皮多酚组小鼠与糖尿病组比较,NOS含量、SOD含量和GST含量的差异均无统计学意义(p>0.05)。石榴皮多酚具有辅助调节糖尿病小鼠血糖功能和减少其肾脏组织的氧化应激,增强肾脏的抗氧化能力。
石榴皮,多酚,糖尿病小鼠,肾脏,抗氧化
石榴皮多酚是一类具有多酚羟基化合物的总称,存在游离态和结合态[1],富含安石榴苷、鞣花酸、绿原酸、槲皮素和表儿茶素等多种有机化合物,因其结构中的共轭不饱和键及酚羟基赋予其一系列的化学性质,如具有还原性和捕获自由基的特性、能与蛋白质结合抑制自由基催化酶的活性等,使多酚类物质具有较强的抗氧化活性。在体外,石榴皮多酚的抗氧化作用主要体现为清除常见的自由基[2-4]、抗脂质过氧化作用[5]等。
自由基生物学和医学是近几十年迅速发展起来的新兴学科,人体内自由基产生过多或清除过少,就会发生氧化应激造成对组织的伤害,如介导细胞物质的损伤,引起癌症、心血管疾病、局部缺血/再灌输损伤、炎症、糖尿病、神经性病变和衰老等各种疾病的发生和恶化。研究表明,在糖尿病及其并发症中,由于氧化应激带来的脏器损伤可能是糖尿病及其并发症发病机制的主要通道[6],氧化应激可能影响清除自由基的各种抗氧化酶的活性及表达,致使体内自由基水平升高,从而损伤肾脏组织[7],糖尿病肾脏病变是其最为严重的并发症之一。石榴皮提取物能减少机体的氧化应激和脂质过氧化作用,增加某些抗氧化酶活性,对糖尿病具有一定的辅助治疗作用[8],而关于石榴皮多酚对糖尿病肾脏抗氧化防御作用尚未见报道。由此,本文通过研究石榴皮多酚对实验性糖尿病小鼠辅助调节血糖作用及其肾脏抗氧化防御能力的影响,为石榴皮作为一种天然抗氧化剂和糖尿病辅助调节剂提供理论依据。
1 材料与方法
1.1材料与仪器
清洁健康屏蔽级雄性昆明种小鼠4周龄左右,体重约为28~30 g左右,具备合格证号(医动字第24101106号);石榴皮成都中药饮片公司;链脲佐菌素Streptozotocin(STZ)美国Sigma公司;丙二醛MDA试剂盒、超氧化物歧化酶SOD试剂盒、过氧化氢酶CAT试剂盒、谷胱甘肽巯基转移酶GST试剂盒、谷胱甘肽过氧化物酶GSH-Px试剂盒、谷胱甘肽GSH试剂盒、一氧化氮NO试剂盒、一氧化氮合酶NOS试剂盒、组织蛋白质测定试剂盒南京建成生物研究所;其他试剂均为实验室常用试剂,分析纯,成都科龙化工试剂厂,均在实验前新鲜配制。
GT-1640型血糖测试仪、GLUCOCARD II型血糖试纸日本京都公司;HH-S型数显恒温水浴锅金坛市金城国胜实验仪器厂;冷冻低温离心机德国Eppendorf公司;UV-2600型紫外可见分光光度计上海尤尼柯仪器有限公司。
1.2实验方法
1.2.1石榴皮多酚的制备参照蒲博等[9]的实验方法制备石榴皮多酚,石榴皮干燥粉粹,过80~100目筛,采用微波辅助提取,以水为提取溶剂,料液比为1∶30(g/mL),提取温度为75℃,提取时间为140 s,得到的提取液旋转蒸发浓缩后,冷冻干燥得石榴皮粗提取物,此时,石榴皮多酚含量为49.31%。而后采用D101大孔树脂进行石榴皮多酚的纯化,石榴皮溶液进柱质量浓度为10 mg/mL,流速为2 BV/h,清洗用水5 BV,乙醇洗脱剂的体积分数为70%,用量为5.5 BV;纯化后石榴皮多酚质量分数为71.64%。
1.2.2实验小鼠的分组及处理清洁健康屏蔽级雄性昆明种小鼠(mus musculus,4周龄左右),适应性喂养一周后,选取体重为28~30 g左右的小鼠,饮水不限,禁食12 h后按照体重75 mg/kg腹腔注射1%的链脲佐菌素(STZ),2 d后再加强注射1次,注射后小鼠自由进食,饮水不限,5 d后测其体重,空腹取尾血测其血糖值,血糖浓度大于10 mmol/L的确定为糖尿病小鼠[10],同时用正常小鼠做对照。
将糖尿病模型小鼠按照空腹血糖水平和体重随机分成4组,分别为糖尿病模型组(DM组)、模型+石榴皮多酚低剂量组(DM+L)、模型+石榴皮多酚中剂量组(DM+M)、模型+石榴皮多酚高剂量组(DM+H),每组8只,同时用正常小鼠做对照(NC组,8只)。石榴皮多酚低、中和高剂量组动物分别按各自体重以0.2、0.4、0.8 g/kg灌胃石榴皮多酚,糖尿病模型组和对照组(NC)按体重给予蒸馏水(20 mL/kg)灌胃,每天1次。
1.2.3实验动物喂养环境所有实验动物自由进食和饮水,动物室内净化空气流动换气,房间温度保持在20~28℃,湿度控制在50%~70%,明暗时间各12 h。
1.2.4观察指标及测定方法实验动物每周称重,用血糖试纸检测空腹血糖值,连续给药28 d后,称重,测定空腹血糖浓度。第6周末断颈处死动物,称取部分肾脏组织,加冷的生理盐水,冰浴条件下,制成10%的组织匀浆,4℃下3000 r/min离心10 min,取上清液,按照试剂盒上的检测方法测定不同组别小鼠肾脏MDA、SOD、CAT、GST、GSH-Px、GSH、NO、NOS及组织蛋白质水平。
表1 各组实验动物血糖及体重情况比较(±s)Table 1 The comparison of different blood glucose and weight in each group(±s)
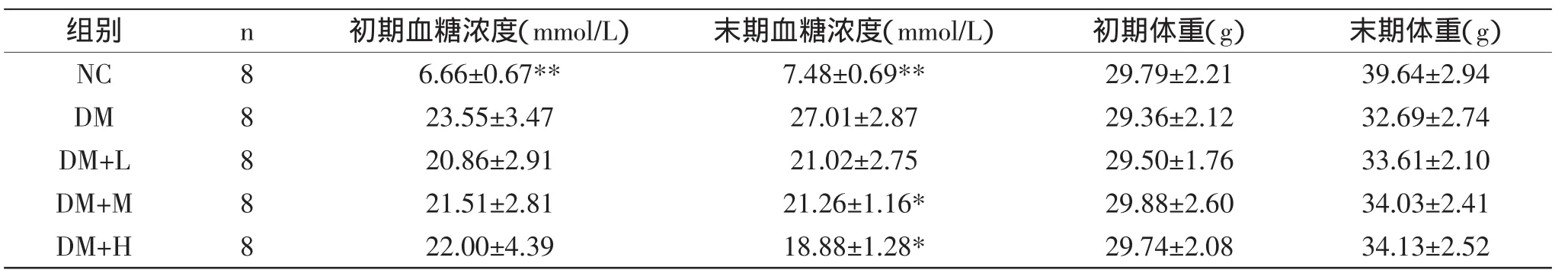
表1 各组实验动物血糖及体重情况比较(±s)Table 1 The comparison of different blood glucose and weight in each group(±s)
注:与DM相比,*p<0.05,**p<0.01;表2、表3同。
组别 n 初期血糖浓度(mmol/L) 末期血糖浓度(mmol/L) 初期体重(g) 末期体重(g)NC 8 6.66±0.67** 7.48±0.69** 29.79±2.21 39.64±2.94 DM 8 23.55±3.47 27.01±2.87 29.36±2.12 32.69±2.74 DM+L 8 20.86±2.91 21.02±2.75 29.50±1.76 33.61±2.10 DM+M 8 21.51±2.81 21.26±1.16* 29.88±2.60 34.03±2.41 DM+H 8 22.00±4.39 18.88±1.28* 29.74±2.08 34.13±2.52
2 结果与分析
2.1各组小鼠血糖及体重情况比较
由表1可知,与DM组比较,石榴皮多酚组初期血糖浓度无差异,NC组血糖明显较低,与DM组相比有极显著差异(p<0.01)。实验末期各组小鼠血糖浓度,与DM组比较,石榴皮多酚组均降低,其中石榴皮中剂量组和高剂量组小鼠血糖有显著差异(p<0.05),说明石榴皮多酚具有辅助降低糖尿病小鼠血糖的作用。实验初期,各组小鼠体重无差异;实验末期,与NC组相比,DM组和石榴皮多酚组小鼠体重降低,但无统计学意义(p>0.05)。石榴皮多酚小鼠体重均比DM组高,但二者相比也无统计学意义(p>0.05)。
2.2石榴皮多酚对糖尿病小鼠肾脏MDA、SOD、CAT、GST的影响
由表2可知,与DM组比较,石榴皮多酚组小鼠MDA含量明显降低,与DM组比较,均具有极显著差异(p<0.01);石榴皮多酚组小鼠CAT含量增加,其中中剂量组和高剂量组与DM组比较,均有显著差异(p<0.05),说明石榴皮多酚能有效减少糖尿病小鼠肾脏组织的氧化应激;与DM组比较,石榴皮多酚组小鼠SOD含量均有所增加,但无统计学意义(p>0.05);其GST含量的差异也无统计学意义(p>0.05)。
2.3石榴皮多酚对糖尿病小鼠肾脏GSH-Px、GSH、NO、NOS的影响
由表3可知,与DM组比较,石榴皮多酚组小鼠GSH含量明显增加,石榴皮多酚剂量组GSH水平与DM组比较均有极显著差异(p<0.01);石榴皮多酚组小鼠GSH-Px和NO含量明显减少,石榴皮多酚高剂量组GSH-Px水平与DM组比较有显著差异(p<0.05);与DM组比较,石榴皮多酚中剂量组和高剂量组NO含量均有极显著差异(p<0.01),说明石榴皮多酚能有效的减少糖尿病小鼠肾脏组织的氧化应激;而石榴皮多酚组小鼠NOS含量的差异无统计学意义。
表2 石榴皮多酚对糖尿病小鼠肾脏MDA、SOD、CAT、GST的影响(±s)Table 2 Effect of pomegranate peel polyphenol on the MDA、SOD、CAT、GST in kidney of diabetic mice(±s)

表2 石榴皮多酚对糖尿病小鼠肾脏MDA、SOD、CAT、GST的影响(±s)Table 2 Effect of pomegranate peel polyphenol on the MDA、SOD、CAT、GST in kidney of diabetic mice(±s)
组别 n MDA含量(nmol/mg prot) SOD含量(U/mg prot) CAT含量(U/g prot) GST含量(μmol/g prot)NC 8 0.88±0.56** 97.64±14.39* 384.84±29.90** 0.33±0.98 DM 8 1.66±0.13 53.26±9.00 224.32±15.54 0.20±0.09 DM+L 8 1.11±0.05** 63.81±8.23 236.64±25.59 0.24±0.07 DM+M 8 1.03±0.04** 66.53±11.72 265.04±7.02* 0.14±0.07 DM+H 8 0.95±0.38** 62.59±6.64 261.92±6.83* 0.19±0.06
表3 石榴皮多酚对糖尿病小鼠肾脏GSH-Px、GSH、NO、NOS的影响(±s)Table 3 Effect of pomegranate peel polyphenol on the GSH-Px、GSH、NO、NOS in kidney of diabetic mice(±s)
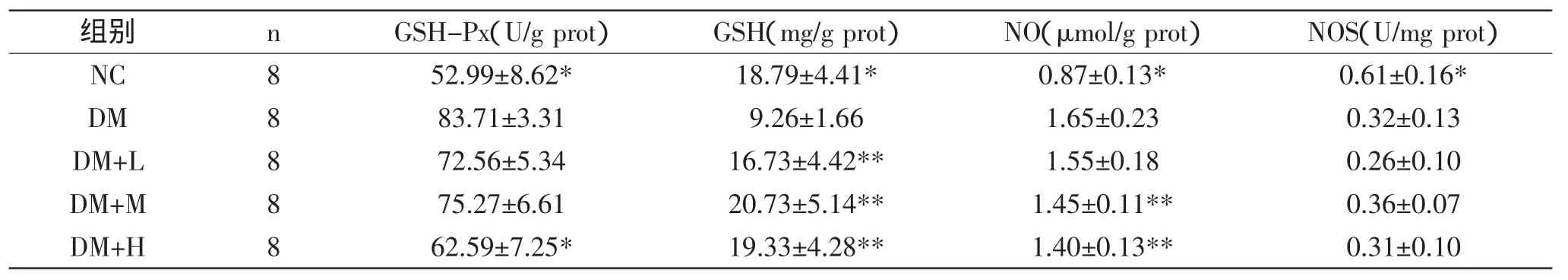
表3 石榴皮多酚对糖尿病小鼠肾脏GSH-Px、GSH、NO、NOS的影响(±s)Table 3 Effect of pomegranate peel polyphenol on the GSH-Px、GSH、NO、NOS in kidney of diabetic mice(±s)
组别 n GSH-Px(U/g prot) GSH(mg/g prot) NO(μmol/g prot) NOS(U/mg prot)NC 8 52.99±8.62* 18.79±4.41* 0.87±0.13* 0.61±0.16* DM 8 83.71±3.31 9.26±1.66 1.65±0.23 0.32±0.13 DM+L 8 72.56±5.34 16.73±4.42** 1.55±0.18 0.26±0.10 DM+M 8 75.27±6.61 20.73±5.14** 1.45±0.11** 0.36±0.07 DM+H 8 62.59±7.25* 19.33±4.28** 1.40±0.13** 0.31±0.10
3 讨论与结论
糖尿病是一种常见的慢性代谢紊乱性疾病,由于其长期的高血糖引发机体心、肝、肾、眼、神经等多种器官并发症,其中糖尿病肾病是最为严重的并发症之一,也是导致患者死亡的主要原因[11]。糖尿病及其并发症的发生和发展与机体自由基引发的氧化损伤和机体抗氧化防御系统清除自由基能力的失衡密切相关[12]。科学研究中,STZ的注入可引起实验动物胰岛β细胞严重破坏,导致胰岛素分泌不足,促使血糖升高[13]。本实验中,STZ诱导的DM组初期血糖浓度达(23.55±3.47)mmol/L,可认为成功诱导成糖尿病小鼠模型。STZ诱导的糖尿病小鼠模型中,其组织多个器官均出现氧化应激。氧化应激是指机体反应性氧生成的增加或清除降低,过量的自由基水平升高,引起细胞和机体的损伤,其在糖尿病肾病的发生发展中起到了重要的作用。STZ诱导的糖尿病模型鼠肾组织中糖代谢紊乱及氧化应激的存在,肾组织中抗氧化酶发生糖化或氧化,影响肾组织中抗氧化酶活性及氧化产物的水平,测定组织中这些指标,能间接反映机体内氧化应激水平[6,8]。
近来年,石榴皮多酚由于其具有抗氧化、抗癌、抗菌、降血脂等多种生物学功能,引起了广大科研者的兴趣,已成为目前的研究热点。欧、美、日等国家科研工作者对石榴皮提取物在抗氧化方面展开了大量的研究,并已证实石榴皮提取物具有较高的抗氧化活性,这与石榴皮中富含多酚类物质直接相关[14]。Morsy等的研究表明,减少机体氧化应激水平和改善抗氧化系统,可以减轻糖尿病所引起的肾脏损害[15]。李建科等[16]利用灌胃法研究石榴皮多酚对正常小鼠的血液、肝脏和脑组织中抗氧化指标的影响,结果揭示石榴皮多酚能提高小鼠血液、肝脏及脑组织中SOD活性和小鼠血液、肝脏中CAT活性,降低小鼠血液、肝脏及脑组织中MDA含量。本实验观察石榴皮多酚对糖尿病小鼠肾脏氧化应激的影响,所选动物模型为糖尿病小鼠,与正常实验中小鼠模型相比,其体内氧化应激更为明显[6],采用石榴皮多酚灌胃糖尿病小鼠,体内抗氧化研究目的更为明确。实验结果与DM组比较,石榴皮多酚组小鼠MDA含量降低,CAT含量增加,且均具有统计学差异(p<0.05或p<0.01),这与李建科等[16]对小白鼠的血液、肝脏和脑组织研究中抗氧化指标较为一致;石榴皮多酚组小鼠SOD活性也有所提高,但无统计学意义(p>0.05)。另外,本实验中石榴皮多酚组小鼠NO含量和GSH-Px水平降低,GSH含量增加,且均具有统计学差异(p<0.05或p<0.01),说明石榴皮多酚提高糖尿病小鼠肾脏的抗氧化应激能力,降低肾脏组织氧化损伤,对减轻糖尿病肾脏损伤具有重要的意义;而石榴皮多酚组小鼠与糖尿病组比较,NOS含量无明显变化,但NO含量降低,可能是因为NO含量的变化受底物利用度、NOS活性、表达水平或其他构成亚型NOS酶活性共同作用的影响[17]。GST含量也无明显变化,可能是因为GST主要存在于肝脏内[18],肾脏中含量甚少所致。
总之,本研究的结果揭示石榴皮多酚具有辅助调节糖尿病小鼠血糖功能和减少其肾脏组织的氧化应激,增强肾脏的抗氧化能力。同时,石榴皮多酚具有辅助调节血糖功能,能改善STZ诱导的糖尿病模型鼠糖代谢,进一步研究可开发成糖尿病辅助调节剂保健食品。
[1]原田,刘邻渭,高忠梅,等.石榴皮游离与结合态多酚的组成和抗氧化性研究[J].食品工业科技,2014,35(18):161-166.
[2]赵艳红,李建科,李国荣.石榴皮多酚纯化及其抗氧化活性表征[J].食品科学,2010,31(11):31-37.
[3]Reza T,Elham H,Ali B.Optimization of ultrasonic-assisted extraction of pomegranate(Punica granatum L.)peel antioxidants by response surface methodology[J].Separation and Purification Technology,2012,98(19):16-23.
[4]Li Y F,Guo C J,Yang J J,et al.Evaluation of antioxidant properties of pomegranate peel extract in comparison with pomegranatepulpextract[J].FoodChemistry,2006,96(2):254-260.
[5]梁俊,李建科,赵伟,等.石榴皮多酚体外抗脂质过氧化作用研究[J].食品与生物技术学报,2012,31(2):159-165.
[6]焦士蓉,王波,黄承钰,等.糖尿病小鼠模型的组织氧化应激研究[J].现代预防医学,2009,36(21):4136-4138.
[7]李晓博,牟忠卿,陈丽,等.糖尿病大鼠肾脏组织氧化应激及其在糖尿病肾病发病中的意义[J].中国病理生理杂志,2006,22(4):806-809.
[8]Saleem B,Samer S,Ziyad A.Pomegranate and type 2 diabetes[J].Nutrition Research,2013,33(5):341-348.
[9]蒲博,李兵,杨舒慧,等.石榴皮多酚分离纯化及对脂肪酸合成酶抑制作用的研究[J].食品科学,2014,35(17):99-103.
[10]卫生部卫生法制与监督司.保健食品检验与评价技术规范[S].北京:中华人民共和国卫生部,2003:38.
[11]Pandey K B,Rizvi S I.Role of red grape polyphenols as antidiabetic agents[J].Integrative Medicine Research,2014,3(3):119-125.
[12]Yang Y S,Huang C N,Wang C J,et al.Polyphenols of Hibiscus sabdariffa improved diabetic nephropathy via regulating the pathogenic markers and kidney functions of type 2 diabetic rats[J].Journal of Functional Foods,2013,5(2):810-819.
[13]Haider R,Prabu S K,John A.Impaired mitochondrial respiratory functions and oxidative stress in streptozotocininduced diabetic rats[J].International Journal of Molecular Sciences,2011,12(5):3133-3147.
[14]马倩倩,李建科,于振,等.石榴皮多酚生物学活性的研究进展[J].食品工业科技,2013,34(6):363-366.
[15]Morsy M D,Hassan W N,Zalat S I.Improvement of renal oxidative stress markers after ozone administrationin diabetic nephropathy in rats[J].Diabetology Metabolic Syndrome,2010,2(1):29-35.
[16]李建科,李国秀,赵艳红,等.石榴皮多酚组成分析及抗氧化活性[J].中国农业科学,2009,42(11):4035-4041.
[17]廖润玲,杨斌.一氧化氮及诱导性一氧化氮合酶的研究进展[J].时珍国医国药,2007,18(4):980-981.
[18]李涛.肝病患者谷胱甘肽巯基转移酶P1的研究[D].济南:山东大学,2013.
Effect of pomegranate peel polyphenols on kidney antioxidant defense function in diabetic mice
TANG Yuan-mou1,2,XU Li-jia3,JIANG Wei-dong3,LI Zun3
(1.School of Clinical Medical of Chengdu University,Chengdu 610106,China;2.College of Light Industry,Textile and Food Engineering,Sichuan University,Chengdu 610065,China;3.School of Chengdu University,Chengdu 610106,China)
The effects of pomegranate peel polyphenols(PPP)on the regulation of blood glucose and kidney antioxidant defense function in diabetic mice(DM)were studied in this paper.The diabetic mice were fed with low,medium,high doses of PPP for 6 weeks,the blood glucose,body weight and the kidney antioxidant ability were observed.The results indicated that the PPP could reduce blood glucose levels effectively in diabetic mice,which with no significant difference in body weight.Compared with the DM group,the MDA,NO and GSH-Px in the PPP fed mice were reduced,the CAT and GSH were increased(p<0.05 or p<0.01),but there was no statistical significance in the NOS,SOD and GST of the PPP fed mice(p>0.05).The conclusion was that the PPP had the functions of regulating blood glucose and reduced the oxidative stress of kidney in diabetic mice,which strengthened the kidney antioxidant capacity.
pomegranate peel;polyphenols;diabetic mice;kidney;antioxidant
TS201.1
A
1002-0306(2015)16-0370-04
10.13386/j.issn1002-0306.2015.16.067
2014-11-13
唐远谋(1986-),男,博士研究生,讲师,研究方向:生物降解与转化,E-mail:tym860320@163.com。
成都大学校青年基金项目(2014XJZ12);药食同源植物资源开发四川省高校重点实验室开放基金项目(10Y201404)。
