酿酒酵母蛋白提取工艺优化
2015-11-08岳红卫韩富亮
岳红卫,韩富亮
(西北农林科技大学葡萄酒学院,陕西杨凌712100)
酿酒酵母蛋白提取工艺优化
岳红卫,韩富亮*
(西北农林科技大学葡萄酒学院,陕西杨凌712100)
采用响应面法优化酵母蛋白提取工艺,实验结果表明,酵母蛋白最佳提取方法为0.1%NaCl、0.97%NaOH、2.0%十二烷基硫酸钠(SDS)和0.77%曲拉通X-100。在此条件下,酵母蛋白提取的理论值为168.68 mg/g(干重),实际提取量为147.57 mg/g(干重),占干酵母质量的14.76%。四溶剂复合法可有效提取酵母蛋白,为提取酵母蛋白提供了方法基础。
酿酒酵母,蛋白,提取,响应面设计
酿酒酵母(Saccharomyces cerevisiae)含有丰富的蛋白,其常用的提取方法有碱法、酶法、超声波辅助法、冻融法、盐热法、碱热法、盐法、自溶法、离子萃取法和高压脉冲电场法等[1-11]。这些方法各有利弊,单一方法的蛋白提取率均较低。
目前,酵母蛋白的提取主要采用复合法[12]。例如,采用表面活性剂吐温80和超声波辅助提取啤酒酵母蛋白,酵母粗蛋白的产率为0.106 mg/mL[13];采用超声波法、冻融法、盐热法和碱热法四种方法提取啤酒废酵母蛋白质,其粗蛋白质的提取率分别为3.47%、4.15%、5.66%和22.81%[14];采用超声波和酶法从白葡萄酒废酵母中提取蛋白质,其提取液中的蛋白质含量可达9.8 g/L[5];采用诱导剂+自溶+酶法从啤酒废酵母中提取蛋白的提取得率为27%[7]。由于蛋白提取效率的表征方法不同,这些研究结果不具有可比性。
酵母细胞蛋白的提取涉及蛋白的释放(细胞破壁)和蛋白的溶解两个过程[15-16]。氯化钠和氢氧化钠是常用的细胞破壁剂和蛋白溶解剂,十二烷基硫酸钠(SDS)和曲拉通X-100(Triton X-100)是蛋白提取常用的增容剂。二喹啉甲酸法(BCA)法是优越的蛋白定量分析方法之一,试剂配制简单、操作方便、反应产物稳定、检测灵敏度高、线性范围宽,受蛋白标准品的影响较小[17]。BCA法对氯化钠、氢氧化钠、SDS和Triton X-100等蛋白提取溶剂有较高的耐受性[18-21]。因此,拟采用复合提取法,即采用盐法、碱法和表面活性剂(离子型和非离子型)法提取酵母蛋白,BCA法定量分析蛋白,利用响应面法优化酵母蛋白的提取工艺,为其进一步研究提供方法基础。
1 材料与方法
1.1材料与仪器
酿酒酵母安琪酵母股份有限公司(宜昌);Tween 80、麦角固醇、YNB、SDS、Triton X-100、二喹啉甲酸二钠盐(BCA)、牛血清蛋白Sigma公司(上海)。所有试剂为分析纯。
UV-2450型紫外分光光度计日本岛津公司;BPH-9042型恒温培养箱上海一恒科学仪器有限公司;HH-4型恒温水浴锅国华电器有限公司。
1.2模拟葡萄汁发酵
葡萄汁中含有一定量的蛋白,对实验的结果可能会造成一定的影响。因此,配制含有酵母生长繁殖所需的氮源但不含有蛋白的模拟葡萄汁进行实验。模拟葡萄汁配制参考Dennis等方法[22]。主要配方为果糖和葡萄糖各120 g、苹果酸5 g、酒石酸5 g、柠檬酸0.2 g、麦角甾醇15 mg、烟酸2 mg、氯化铵0.3 mg、20种氨基酸混合液和酵母无氨基氮源(YNB)等。称取酵母1 g,添加到含糖量5%的水中,在37℃恒温水浴锅内活化20 min。将活化好的酵母倒入模拟葡萄汁中,放置于27℃的酵母培养箱中培养。在酵母生长的稳定期,离心收集酵母细胞。
1.3酵母蛋白的提取
1.3.1蛋白测定方法参考韩富亮等方法,采用BCA法测定蛋白含量[17]。其配制方法为A液:BCANa21 g、Na2CO3·H2O 2 g、酒石酸钠0.16 g、NaOH 0.4 g、NaHCO30.95 g溶于80 mL水中,用1 mol/L NaOH调pH至11.25,定容至100 mL。B液:CuSO4·5H2O 4 g,加水定容至100mL。测定时取A液100体积与B液2体积混合,配制成工作液。取BSA标准品适量配制成1 mg/mL的标准蛋白溶液,配制一系列蛋白浓度梯度绘制标准曲线。取样品溶液0.1 mL与工作液2.0 mL混合,37℃保温30 min,于562 nm处测定吸光度A,根据标准曲线计算样品中蛋白的浓度。标准曲线方程为y= 0.788X+0.020(R2=0.997)。
1.3.2单因素提取实验在酵母生长的稳定期(4.8× 109cfu),离心(10000 r/min,10 min)收集酵母,氮气吹干。液氮研磨15 min,烘箱烘干。取5 mL离心管,分别称取0.2 g干酵母,考察0%、0.1%、0.5%、1%、2%、4%(w/v,去离子水)浓度梯度的NaCl、NaOH、SDS、Triton X-100对蛋白提取的影响。提取方法的其他因素设定为料液比1∶3,提取2 h,共提取3次。合并提取液,测定蛋白含量。实验重复2次。
1.3.3响应面设计在单因素实验基础上,根据Box-Behnken的中心组合设计原理,选取NaCl、NaOH、SDS和Triton X-100四因素三水平(表1)的响应面设计,优化酵母蛋白提取工艺。

表1 酵母蛋白提取响应面设计Table 1 Factors and levels used in Box-Behnken experimental design
1.4数据分析
单因素实验采用SPSS 17.0进行方差(ANOVA)分析(LSD法),响应面设计与分析采用Design Expert 7.0软件。
2 结果与分析
2.1NaCl添加量对酵母蛋白提取的影响
由图1可以看出,氯化钠法提取蛋白含量在60~70 mg/g(干重)。不同氯化钠添加量处理之间的蛋白提取量差异不显著(p>0.05)。这表明酵母蛋白的亲水性和电荷可能受氯化钠离子强度的影响较小[23-24]。因此,在氯化钠低添加量和高添加量处理的蛋白含量差异不显著。在多因素实验中,氯化钠可能具有交互作用。在响应面实验中,选取氯化钠并设置添加量0.1%~1%。

图1 NaCl添加量对酵母蛋白提取的影响Fig.1 Effect of NaCl on protein extraction from yeast
2.2NaOH添加量对酵母蛋白提取的影响
由图2可以看出,氢氧化钠法提取蛋白含量为60~107 mg/g(干重)。随着氢氧化钠添加量的增加,蛋白提取量增加到100 mg/g以上。因为随氢氧化钠添加量的增加,pH增加,蛋白质与水之间的相互作用力增强,蛋白溶解度提高[25]。当氢氧化钠添加量增加到2%,溶液的pH与蛋白的等电点相等,使得蛋白的溶解度降低。当添加量继续增加,溶液的pH与蛋白的等电点不再相等,蛋白的溶解度增加[24]。虽然在2%氢氧化钠处理的蛋白含量下降,但是与0.5%和1%处理之间差异不显著(图2)。方差分析表明,0.1%处理与对照差异不显著;0.1%、0.5%、1%和2%处理间差异不显著;0.5%、1%和4%处理间差异不显著。在响应面实验中,氢氧化钠添加量选取0.1%~1%。
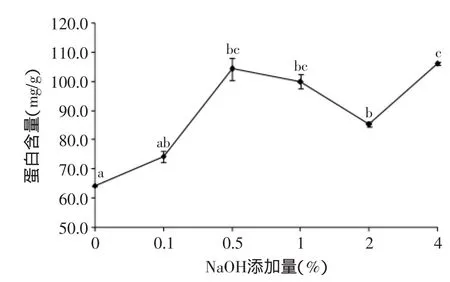
图2 NaOH添加量对酵母蛋白提取的影响Fig.2 Effect of NaOH on protein extraction from yeast
2.3SDS添加量对酵母蛋白提取的影响
由图3可以看出,SDS法提取蛋白含量为60~82 mg/g(干重)。随着SDS添加量的增加,蛋白提取量有增加的趋势。这可能是因为SDS在蛋白提取过程中可以抑制酵母内源蛋白酶对蛋白的酶解[15,26]。但是方差分析(图3)表明,4%处理显著高于对照(0%)和0.1%处理,0.5%、1%、2%和4%处理之间差异不显著。BCA法测定蛋白对SDS具有一定的耐受性。浓度过高,可能影响BCA定量蛋白的准确性。因此,在响应面实验中,SDS添加量选取0.5~2%。

图3 SDS添加量对酵母蛋白提取的影响Fig.3 Effect of SDS on protein extraction from yeast
2.4Triton X-100添加量对酵母蛋白提取的影响
由图4可以看出,Triton X-100法提取蛋白含量为75~85 mg/g(干重)。随着Triton X-100添加量的增加,蛋白提取量稍有增加,随后又略有下降。Triton X-100是非离子型表面活性剂,在蛋白提取过程中有稳定和增溶膜蛋白的作用[27-28]。但是方差分析(图4)表明,不同处理间的蛋白提取量差异不显著。因此,Triton X-100在0.1%~4%的添加量范围内对酵母蛋白的提取无显著影响。考虑BCA法对曲拉通X-100的耐受性,以及在多因素提取中可能存在的交互效应,在响应面实验中,曲拉通X-100的添加量选取0.1%~1%。

图4 Triton X-100添加量对酵母蛋白提取的影响Fig.4 Effect of Triton X-100 on protein extraction from yeast
2.5Box-Behnken响应面实验
2.5.1回归模型的建立根据响应面设计,得到29组实验结果(表2)。采用Design Expert 7.0软件,对其进行响应面分析,得到回归模型:


表2 酵母蛋白提取响应面分析设计与结果Table 2 Experimental design and results for response surface analysis
2.5.2响应面二次模型的方差分析由表3可知,模型极显著(p<0.01),说明该模型具有统计学意义。模拟方程的决定系数R2=0.8819,说明因变量与自变量之间呈高度相关。失拟项不显著(p>0.05),表明拟合程度较好,实验拟合的二次回归方程可较好地对响应值进行预测。由该模型的方差分析结果表明,A、B、C、B2对Q值的影响极显著(p<0.01);交互项均不显著(p>0.05),无统计学差异。在所选择的实验范围内,由F值的大小可以推断,四个因素影响酵母蛋白提取的大小排序为NaOH>NaCl>SDS>Triton X-100。
根据a=0.05的显著水平剔除不显著项,简化后的回归方程为:
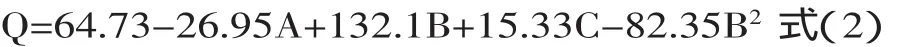
2.5.3响应面分析优化由图5可以看出,随着NaOH和SDS添加量的增加,从酵母中提取的蛋白含量增加。但当因素水平进一步增加,从酵母中提取的蛋白含量有下降的趋势。而随着NaCl和Triton X-100添加量的增加,从酵母中提取的蛋白含量有下降的趋势。从响应面坡度的陡峭度可以看出各因素之间交互作用的强弱。但是从等高线图可以看出,各因素之间的交互作用不显著。利用Design Expert 7.0软件,分析蛋白提取量的极大值点及对应的因素水平,得到最佳提取方法为0.1%NaCl、0.97%NaOH、2.0%SDS和0.77%Triton X-100,此时酵母蛋白提取量理论预测值为168.68 mg/g(干重)。
2.5.4响应面分析验证根据上述优化出的提取工艺0.1%NaCl,0.97%NaOH,2.0%SDS,0.77%Triton X-100,验证Box-Behnken实验设计所得结果的可靠性。实验测得酵母蛋白提取量为147.57 mg/g(干重),与理论值的相对误差为12.5%。因为拟合方程的决定系数为0.8819,因此其相对误差较高。但是拟合方程具有统计学意义,表明数学模型优化的酵母蛋白提取方法可行[29-30]。

表3 回归模型的方差分析Table 3 Analysis of variance for the regression equation

图5 各因素交互作用响应曲面图Fig.5 The response surface of interaction between factors
3 结论
响应面实验结果表明,四个因素对酵母蛋白提取的影响为NaOH>NaCl>SDS>Triton X-100。最佳提取工艺为0.1%NaCl、0.97%NaOH、2.0%SDS和0.77% Triton X-100。在此条件下,蛋白实际提取量可达147.57 mg/g(干重),占干酵母重的14.76%。复合提取法可有效提取酵母蛋白,为酵母蛋白的进一步研究提供了方法基础。实验优化了氯化钠、氢氧化钠、SDS和曲拉通X-100提取酵母蛋白的最佳比例,下一步应考察其他提取因素(例如料液比、提取温度、时间和提取次数等)对蛋白提取的影响。
[1]张彦,朱娅敏,夏长虹.食用酵母的营养价值[J].食品科技,2009(10):94-96.
[2]成建国,董亮,付莹莹,等.不同菌龄酿酒酵母细胞壁蛋白差异性分析[J].食品与发酵工业,2012(4):116-119.
[3]董惠忠,赵黎明,蒋丽华,等.酶法提取功能性大米蛋白的工艺研究[J].中国食品学报,2013(4):87-93.
[4]Martin J F G,Guillemet L,Feng Ch,et al.Cell viability and proteins release during ultrasound-assisted yeast lysis of light lees in model wine[J].Food Chemistry,2013(141):934-939.
[5]屈慧鸽,于小飞,张玉香,等.白葡萄酒废酵母蛋白及多糖的提取工艺研究[J].食品科学,2007(9):315-318.
[6]郑惠娜,张晶晶,周春霞,等.pH调节法提取牡蛎蛋白及氨基酸、蛋白组成分析[J].中国食品学报,2014(7):230-235.
[7]刘蓉,邓泽元,李瑞贞.啤酒废酵母中蛋白质提取工艺的研究[J].食品科学,2007(10):168-170.
[8]洪晶,陈涛涛,唐梦茹,等.响应面法优化韭菜籽蛋白质提取工艺[J].中国食品学报,2013(12):89-96.
[9]Al-Rawi N,Kavanagh K.Rapid method for the extraction of wholecellproteinsfromCandidaspecies[J].Journalof Microbiological Methods,1998(34):107-112.
[10]Ge L Y,Wang X T,Tan S N,et al.A novel method of protein extraction from yeast using ionic liquid solution[J].Talanta,2010(81):1861-1864.
[11]刘铮,杨瑞金,赵伟.高压脉冲电场破壁法提取废啤酒酵母中的蛋白质与核酸[J].食品工业科技,2007(3):85-88.
[12]游庆红,尹秀莲.超声辅助酶法促进啤酒废酵母自溶的研究[J].食品工业科技,2014(2):264-267,280.
[13]张俊杰.啤酒酵母泥中蛋白质的提取[J].河北理工大学学报:自然科学版,2008(1):93-95.
[14]郭龙,王欣欣,黄建新.啤酒废酵母蛋白的提取工艺研究[J].安徽农业科学,2010(34):19566-19567,19580.
[15]刘晓杰,章海锋,傅明亮,等.酵母液泡蛋白酶的研究进展[J].食品工业科技,2010(12):377-379.
[16]戴宁,张裕中,周东.超高压均质参数对酵母破壁率的影响[J].食品与发酵工业,2011(9):109-113.
[17]韩富亮,袁春龙,郭安鹊,等.二喹啉甲酸法(BCA)分析蛋白多肽的原理、影响因素和优点[J].食品与发酵工业,2014(11):202-207.
[18]Smith P K,Krohn R I,Hermanson G T,et al.Measurement of protein using bicinchoninic acid[J].Analytical Biochemistry,1985(19):76-85.
[19]吕媛,马钰,冯志明,等.二喹啉甲酸法在牛奶蛋白质定量中的应用[J].食品科学,2010(6):151-154.
[20]郭琳琳,朱艳,张小为.蛋白质定量方法的研究现状[J].中国医学工程,2010(4):156-157.
[21]宿玮,常耀光,薛长湖,等.海地瓜多糖中蛋白含量测定方法比较[J].食品科学,2011(2):201-204.
[22]Dennis E G,Keyzers R A,Kalua C M,et al.Grape contribution to wine aroma:production of hexyl acetate,octyl acetate,and benzyl acetate during yeast fermentation is dependent upon precursors in the must[J].Journal of Agricultural and Food Chemistry,2012(60):2638-2646.
[23]祝海娟,赵晨霞,张翌楠,等.盐法提取大麦虫蛋白质的研究[J].江苏农业科学,2013(8):274-276.
[24]张治强,成兰英.响应面法优化苦瓜籽蛋白质提取工艺[J].食品工业科技,2013(1):268-272.
[25]任秀艳,曹戈,王孟云,等.玉米胚芽蛋白的碱法提取工艺及特性研究[J].食品工业科技,2014(10):279-283.
[26]龚迪,毕阳,王军节,等.基于蛋白组学的水果蛋白质提取方法[J].食品工业科技,2014(3):376-379.
[27]谢浩,陈艳可,孙恩杰,等.去垢剂在膜蛋白研究中的应用[J].生物技术通报,2010(2):205-212.
[28]Arachea B T,Sun Z H,Potente N,et al.Detergent selection forenhancedextractionofmembraneproteins[J].Protein Expression and Purification,2012(86):12-20.
[29]王倩,刘淑集,林彩平,等.响应面法优化鱿鱼缠卵腺糖蛋白提取工艺研究[J].食品工业科技,2014,35(3):261-265.
[30]彭晓莉,刘新,陈卫中,等.响应面优化龙眼核原花青素的醇提工艺[J].食品工业科技,2012,33(8):305-308,313.
Optimization of protein extraction from Saccharomyces cerevisiae
YUE Hong-wei,HAN Fu-liang*
(College of Enology,Northwest A&F University,Yangling 712100,China)
The response surface analysis was employed to optimize the protein extraction from yeast.The results showed that the best protein extraction conditions were 0.1%NaCl,0.97%NaOH,2.0%SDS and 0.77%Triton X-100.Under the condition,the maximum theoretical concentration of protein extraction was 168.68 mg/g,the actual concentration was 147.57 mg/g which accounted for 14.76%of dry yeast weight.This method could extract protein effectively and provide a support for yeast protein extraction.
Saccharomyces cerevisiae;protein;extraction;response surface design
TS261.9
B
1002-0306(2015)16-0304-05
10.13386/j.issn1002-0306.2015.16.053
2015-01-04
岳红卫(1990-),女,硕士研究生,研究方向:食品营养,E-mail:yhwflier@163.com。
韩富亮(1979-),男,博士,讲师,研究方向:食品营养,E-mail:hanfl@nwsuaf.edu.cn。
国家“十二五”科技支撑计划项目(2012BAD31B07);西北农林科技大学基本科研创新一般项目(Z109021202)。
