石榴皮多酚调控肝细胞内胆固醇平衡的相关通路研究
2015-11-08李建科马倩倩
吕 欧,李建科,马倩倩,梁 俊,赵 伟
(陕西师范大学食品工程与营养科学学院,陕西西安710062)
石榴皮多酚调控肝细胞内胆固醇平衡的相关通路研究
吕欧,李建科*,马倩倩,梁俊,赵伟
(陕西师范大学食品工程与营养科学学院,陕西西安710062)
探讨石榴皮多酚对成人肝细胞脂滴形成的影响,对肝细胞胆固醇合成限速酶基因及低密度脂蛋白受体基因表达的调控作用及其机制。以石榴皮多酚纯化物(PPPs)、安石榴苷(PC)和石榴鞣花酸(EA)为受试物,以体外培养成人正常肝细胞L-02为研究对象,采用油红O染色法观察肝细胞内脂滴变化情况,利用实时荧光定量核酸扩增(realtime quantitative,RT-PCR)分析对肝细胞胆固醇合成限速酶关键基因HMGCR mRNA、SE mRNA及肝细胞低密度脂蛋白受体基因LDLR mRNA及其上游基因SREBP-2 mRNA表达的影响。结果表明:石榴皮多酚三种受试物均能减少细胞内脂滴的形成,以石榴鞣花酸效果最好;与模型组相比较,石榴皮多酚各处理组均可极显著降低(p<0.01)肝细胞内胆固醇含量;与正常组相比较,石榴皮多酚三种受试物均可使胆固醇合成关键酶HMGCR和SE基因表达调控至较低水平,对LDLR基因和SREBP-2基因表达则有明显的上调作用。石榴皮多酚及其主要成分(安石榴苷和石榴鞣花酸)降低肝细胞胆固醇及降脂作用的机制可能是通过下调胆固醇合成限速酶基因表达,上调肝细胞低密度脂蛋白受体基因表达而实现的。
石榴皮多酚纯化物,安石榴苷,石榴鞣花酸,胆固醇
近年来,关于植物多酚功能活性的研究比较多,如石榴皮多酚[1-2]、安石榴苷[3-6]、石榴鞣花酸[7-8]在降血脂、抗氧化和调节预防心脑血管疾病等方面具有重要作用。并已清楚安石榴苷、鞣花酸、没食子酸为石榴皮多酚的主要成分[9-11]。
赵艳红等研究发现安石榴苷是石榴皮多酚纯化物的主要活性成分[2]。B Cerdá等对安石榴苷吸收代谢进行研究,证明安石榴苷吸收入血的活性形式为鞣花酸[3]。程霜等对高脂血症SD大鼠经石榴皮多酚提取物饲养28 d后,发现高脂血症SD大鼠的血清与肝内血清游离脂肪酸、甘油三酯、总胆固醇、低密度脂蛋白胆固醇含量明显下降,同时高密度脂蛋白胆固醇含量也有所增加[12]。李云峰等采用石榴皮提取物对高脂饲料喂养动物AS形成的防治作用以及对氧化损伤血管内皮细胞的保护作用进行了研究,结果显示石榴皮提取物能够提高小鼠抗氧化防御体系功能、调节血脂水平、抑制平滑肌细胞的迁移和脂质蓄积,发挥抗AS的活性,且其效果要高于石榴果肉提取物,也进一步证明石榴皮提取物的降脂活性是高于石榴果肉提取物的[13]。丁玮等研究发现石榴皮醇提取物对高脂血症模型大鼠也具有较好的降血脂作用,其实验结果表明,石榴皮醇提物给药组(800、1600 mg/kg)的大鼠较高脂血症模型组大鼠的胆固醇、甘油三酯、低密度脂蛋白胆固醇均明显降低,高密度脂蛋白胆固醇、超氧化物歧化酶明显升高[14]。梁俊等研究了石榴皮多酚提取物对高脂模型人肝细胞的降血脂作用与其对体外的脂质过氧化作用。其结果显示石榴皮多酚能够有效的抑制体外脂质过氧化,能够明显地减少脂变肝细胞内脂滴和胆固醇含量。同时,其研究结果表明石榴皮多酚主要通过抑制脂肪变性L-02成人肝细胞内HMGCR基因mRNA的表达,来降低HMGCR的活性,最终减少脂肪变性肝细胞内胆固醇的含量[8,15]。
从以上的研究成果可以看出,石榴皮多酚对动物具有一定的降血脂作用,但其对人体降血脂作用的研究较少,石榴皮多酚对人体降血脂作用的分子机制目前尚不明确。本实验以正常成人肝细胞L-02为研究对象,构建成人脂变肝细胞模型,以石榴皮多酚纯化物(PPPs)、石榴鞣花酸(EA)、安石榴苷(PC)为考察对象,经MTT法筛选合适浓度,利用油红O染色法观察石榴皮多酚对脂变肝细胞内脂滴堆积的影响,同时采用RT-PCR检测肝细胞内与胆固醇合成相关基因HMGCR mRNA、SE mRNA表达水平以及肝细胞对胆固醇内吞清除相关基因LDLR mRNA、SREBP-2 mRNA表达水平,揭示石榴皮多酚对肝细胞胆固醇合成及内吞清除影响及其分子调控机制。以期探明石榴皮多酚对成人肝细胞内胆固醇合成途径的影响及其作用机理,为石榴皮多酚在功能食品和医药方面的应用奠定理论基础。
1 材料与方法
1.1材料与仪器
成人正常肝细胞L-02购于武汉大学典藏细胞库;石榴皮多酚受试物:石榴皮多酚纯化物陕西师范大学食品工程与营养科学学院食品营养与安全实验室制备,总多酚含量为87.81%;安石榴苷标品(≥96.0%)、石榴鞣花酸标品(≥98.0%) 均购于美国sigma公司;油红O、牛胰岛素、二甲基亚砜(DMSO)、噻唑蓝(MTT) 均购自美国Sigma公司;胎牛血清购于杭州四季清公司产品;RPMI-1640培养液购于美国Hyclone公司;胰蛋白酶购于美国Amresco公司;胆固醇(TC)测定试剂盒购于南京建成生物工程研究所;总RNA提取试剂盒OMEGA试剂公司;RevertAidTMFirst Stand cDNA Synthesis KitFermentas公司;SYBR Premix Ex TaqTMII(Tli RNaseH Plus)宝生物工程(大连)有限公司;HMGCR基因(NM_000859.2)、SE基因(NM_003129.3)、GAPDH基因(NM_001256799.1)、SREBP-2基因(NM_004599.2)、LDLR基因(NM_000527.4) 采用Primer5.0软件对引物进行设计和分析,由上海生物工程有限股份公司合成。
311气套式型CO2恒温培养箱美国Thermo公司;TS100型倒置显微镜日本Nikon公司;SW-CJ-1D型超净工作台江苏吴江市净化设备厂;IX71型倒置荧光显微镜图像采集系统美国Thermo公司;RT-6000型酶标仪雷杜公司;微量核酸蛋白测定仪、实时荧光定量PCR仪美国Thermo公司。
1.2实验方法
1.2.1细胞培养完全培养液由RPMI-1640、10%胎牛血清、1%双抗、1 μg/mL胰岛素配制。成人正常肝细胞L-02采用RPMI-1640完全培养液培养,置于培养箱中孵育。孵育条件为温度37℃、CO2浓度5%、空气湿度95%。待细胞贴壁生长至70%~80%时,用PBS冲洗1~2次,消化3 min,加入1 mL培养液终止反应,收集细胞,1000 r/min离心3 min,弃去上清液,加入新鲜完全培养液,吹打均匀,以1×106cell/瓶的浓度接种于新的培养瓶内,传代培养[16]。
1.2.2建立肝细胞脂肪变性模型造模培养液由RPMI-1640、50%胎牛血清、1%双抗和1 μg/mL胰岛素配制。取对数生长期的成人肝细胞L-02接种于六孔板(1×104cell/孔),待细胞生长至50%~60%时,正常组换用完全培养液继续培养作为对照,模型组换用造模培养液对细胞进行诱导造模,48 h后进行处理。
1.2.3石榴皮多酚对L-02脂肪变性肝细胞增殖活力的影响取对数生长期的肝细胞L-02接种于96孔板内,待12 h贴壁后对细胞进行分组处理。正常组用完全培养液培养96 h,模型组用造模培养液培养48 h后改用完全培养液培养48 h,实验组分别用含不同浓度(5、10、20、40、80、160、320 μg/mL)PPPs、PC、EA的造模培养液培养48 h之后继续用含相同浓度受试物的完全培养液培养48 h。每组各设6个平行复孔,进行MTT增殖检测。于570 nm的波长用酶标仪检测各孔吸光值,计算各药物浓度下L-02细胞的存活率:
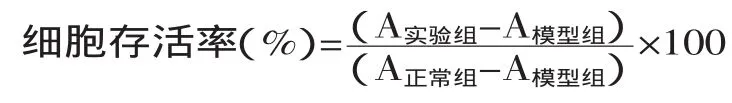
1.2.4石榴皮多酚对L-02脂肪变性肝细胞内脂肪堆积的影响根据受试物MTT实验结果选择安全有效浓度处理细胞,实验分组如下:正常组用完全培养液培养96 h,模型组用造模培养液培养48 h后改用完全培养液培养48 h,实验组分别用含不同浓度(25、50、100 μg/mL)PPPs、PC、EA的造模培养液培养48 h,之后继续用含相同浓度受试物的完全培养液培养48 h。待细胞处理结束后,采用油红O染色法检测石榴皮多酚对脂肪变性L-02肝细胞内脂肪堆积的影响,并按照试剂盒说明测定各组细胞中的胆固醇含量。
油红O染色法的具体操作如下:将6孔板中待处理的L-02肝细胞用PBS缓冲溶液漂洗两次;先用1 mL 4%(w/v)的多聚甲醛溶液在4℃冰箱固定8 min,接着再用PBS清洗细胞2次;然后每孔避光加入1 mL油红O染色液,染色10 min,吸弃废液,用60%(v/v)异丙醇漂洗分化,除去多余的染料,吸弃;最后用倒置荧光显微镜的普通光观察细胞形态变化以及细胞内橘红色脂滴形成情况[17]。
1.2.5石榴皮多酚对L-02脂肪变性肝细胞胆固醇合成影响机制研究根据受试物对肝细胞内脂肪堆积影响选择12.5、25 μg/mL作为最佳处理浓度。实验分组如下:正常组用完全培养液培养96 h,模型组用造模培养液培养48h后改用完全培养液培养48 h,实验组分别用含不同浓度(12.5、25 μg/mL)PPPs、PC、EA的造模培养液培养48 h之后继续用含相同浓度受试物的完全培养液培养48 h。待各组处理结束后,按照试剂盒说明提取各组肝细胞内的总RNA,检测纯度及完整性并逆转录合成cDNA。将所得cDNA用于后续实验或置于-20℃保存,若长期保存则置于-70℃。表1为各基因的引物序列。

表1 PCR引物序列及产物大小Table 1 The sequenees of primers and the size of PCR produets
以上述所得各处理组cDNA为模板,采用RT-PCR检测各组HMGCR基因mRNA、SE基因mRNA、LDLR基因mRNA、SREBP-2基因mRNA的扩增情况。荧光定量PCR的扩增条件:95℃,30 s;95℃,5 s;60℃,30 s;共40个循环;60℃,30 s;溶解曲线,60~95℃。
1.3统计分析
实验数据经Excel初步统计后,采用SPSS 17.0进行显著性分析。
2 结果与分析
2.1石榴皮多酚对L-02肝细胞增殖活力的影响
如图1所示,当石榴皮多酚作用于L-02脂肪变性肝细胞时,细胞存活率随着石榴皮多酚浓度的增加而呈逐渐下降的趋势,低浓度的石榴皮多酚对L-02脂肪变性肝细胞增殖无明显抑制,表现为在0~80 μg/mL的浓度范围内,细胞存活率均在90%以上。但在高浓度的石榴皮多酚作用下,L-02肝细胞出现了较多的死亡,表现出明显的增殖抑制效应,320 μg/mL的石榴皮多酚纯化物作用下细胞存活率仅为40.12%。故在本实验中选定0~100 μg/mL作为安全浓度,进一步研究受试物作用于细胞的最佳处理浓度。

图1 不同浓度石榴皮多酚对脂变L-02肝细胞存活率的影响(±s,n=4)Fig.1 The effects of different concentrations of PPPs on the hepatocytes proliferation(±s,n=4)
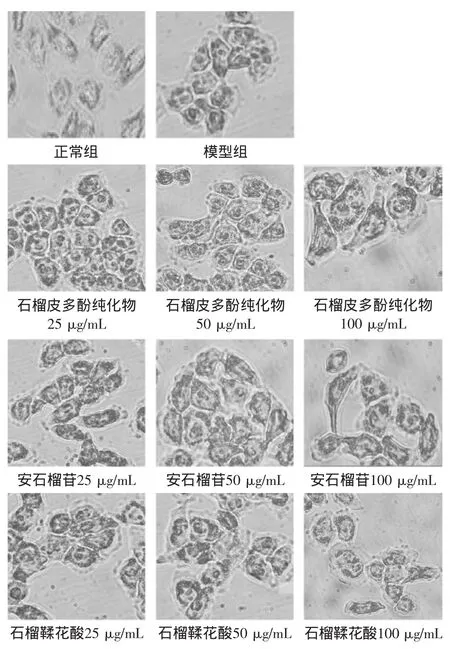
图2 石榴皮多酚对实验组脂变肝细胞内脂滴影响(400×)Fig.2 The effects of the accumulation of lipid droplets in the experimental groups observed by oil red O staining(400×)
2.2石榴皮多酚对L-02脂肪变性肝细胞内脂肪堆积的影响
2.2.1石榴皮多酚对细胞脂滴聚积的影响由图2可见:与模型组相比,石榴皮多酚纯化物、安石榴苷、鞣花酸均能减少肝细胞内的脂滴。受试物浓度为25 μg/mL时,细胞内脂滴较模型组大量减少;受试物浓度为50 μg/mL及100 μg/mL时,细胞内脂滴与25 μg/mL处理组无明显差异。
2.2.2石榴皮多酚对细胞内胆固醇含量的影响由图3可见:与正常组相比较,模型组胆固醇含量极显著升高(p<0.01);与模型组相比较,石榴皮多酚各处理组胆固醇含量极显著降低(p<0.01);三个浓度(25、50、100 μg/mL)之间不具有显著性差异(p>0.05)。故后续实验选定处理浓度为12.5、25 μg/mL。

图3 细胞内胆固醇含量的变化Fig.3 Changes of cholesterol levels in cells
2.3石榴皮多酚对脂变肝细胞胆固醇合成相关基因表达的影响
2.3.1石榴皮多酚对HMGCR基因mRNA、SE基因mRNA表达量的影响由图4和图5可见,与正常组相比,模型组中HMGCR基因mRNA和SE基因mRNA表达量均极显著减少(p<0.01);实验组与正常组比较,石榴皮多酚纯化物、安石榴苷及石榴鞣花酸对胆固醇合成限速酶HMGCR基因mRNA和SE基因mRNA表达均有抑制作用。肝细胞脂变模型组比正常组HMGCR基因mRNA、SE基因mRNA表达量明显降低的原因可能是,肝细胞严重脂变导致了细胞的一些功能降低,以及肝细胞内胆固醇升高对胆固醇合成的反馈抑制所致。图5中实验组比正常组SE基因mRNA表达量明显降低而比模型组有一定上升,可能是因为石榴皮多酚对肝细胞胆固醇合成限速酶SE基因mRNA表达具有一定的双向调节作用,这也是许多天然食品功能因子调节体内代谢的共同特点[18-19]。

图4 各实验组HMGCR mRNA基因相对表达量Fig.4 The relative expressions of HMGCR mRNA in the experimental groups

图5 各实验组SE mRNA基因相对表达量Fig.5 The relative expressions of SE mRNA in the experimental groups
2.3.2石榴皮多酚对LDLR基因mRNA表达量的影响
由图6可见,与正常组相比,模型组LDLR基因mRNA表达量明显减少(p<0.01);与模型组相比较,随着三种受试物浓度的增加,实验组LDLR基因mRNA的表达量有所上调,说明石榴皮多酚可促使脂变肝细胞LDLR基因mRNA上调;与正常组相比较,25 μg/mL石榴鞣花酸处理组LDLR基因mRNA表达量极显著高于正常组(p<0.01),说明石榴皮多酚可上调肝细胞LDLR基因mRNA表达。
LDLR为肝细胞低密度脂蛋白受体,血液中有75%的低密度脂蛋白(LDL)由肝脏清除,其中90%是通过低密度脂蛋白受体(LDLR)途径清除的,LDLR对调节体内胆固醇平衡,调节血液总胆固醇(TC)含量起着关键作用[20]。本实验结果发现的石榴皮多酚对LDLR基因mRNA有显著上调作用,说明石榴皮多酚可提高肝细胞对LDL的内吞清除能力,有利于清除血液LDL从而发挥降血脂作用,加速肝脏对肝外胆固醇的代谢转化[21-22]。

图6 各实验组LDLR mRNA基因相对表达量Fig.6 The relative expressions of LDLR mRNA in the experimental groups
2.3.3石榴皮多酚对SREBP-2基因mRNA表达水平的影响由图7可见,与正常组相比,模型组SREBP-2基因mRNA表达量减少(p<0.01);与模型组相比,随着受试物浓度的增加,SREBP-2基因mRNA的表达量有所上调,特别是石榴皮多酚及其主要成分EA可显著上调脂变肝细胞SREBP-2基因mRNA的表达;与正常组相比,PEA处理组SREBP-2基因mRNA表达量显著高于正常组(p<0.05)。总之,三种受试物对SREBP-2基因mRNA表达均有一定的剂量依赖性上调作用,其上调作用强弱依次为石榴鞣花酸(EA)>石榴皮多酚纯化物(PPPs)>安石榴苷(PC)。SREBP-2是LDLR的上游基因,SREBP-2基因mRNA表达上调可进一步使LDLR基因mRNA表达上调,这与2.3.2结果相一致,进一步揭示了石榴皮多酚对胆固醇内吞清除的调控机制。
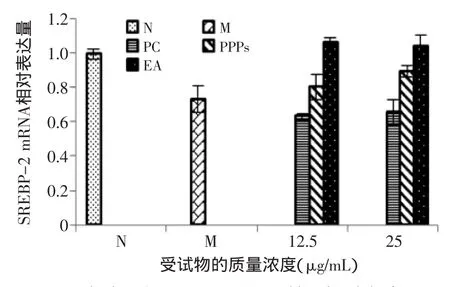
图7 各实验组HMGCR mRNA基因相对表达量Fig.7 The relative expressions of SREBP-2 mRNA in the experimental groups
3 结论
石榴皮多酚纯化物、安石榴苷、鞣花酸三种受试物均可不同程度的抑制肝细胞内脂滴积累,降低高脂模型肝细胞内胆固醇含量;石榴皮多酚纯化物、安石榴苷、鞣花酸三种受试物对胆固醇合成关键限速酶HMGCR基因mRNA和SE基因mRNA表达有下调作用,并有双向调控作用,从而维持肝细胞内胆固醇代谢平衡;三种受试物均可上调肝细胞LDLR基因mRNA及其上游SREBP-2基因mRNA表达,从而提高肝细胞对胆固醇的内吞清除能力。
石榴皮多酚纯化物、安石榴苷、鞣花酸降低胆固醇及降血脂的机制可能是通过下调胆固醇合成限速酶HMGCR基因mRNA和SE基因mRNA表达,上调肝细胞LDLR基因mRNA及其上游SREBP-2基因mRNA表达而实现的,其确切机制有待于进一步深入研究。
[1]赵艳红,李建科,李国荣.石榴皮多酚纯化及其抗氧化活性表征[J].食品科学,2010,11:31-37.
[2]Mar Larrosa,Francisco A Toma’s-Barbera’n,Juan Carlos Espı’n.The dietary hydrolysable tannin punicalagin releases ellagic acid that induces apoptosis in human colon adenocarcinoma Caco-2 cells by using the mitochondrial pathway[J].Journal of Nutritional Biochemistry,2006,17:611-625.
[3]B Cerdá,R Llorach,José J Cerón,et al.Evaluation of the bioavailability and metabolism in the rat of punicalagin,an antioxidant polyphenofrom pomegranate juice[J].European Journal of Nutrion,2003,1(42):18-28.
[4]Pin-Shern Chen,Jih-Heng Li.Chemopreventive effect of punicalagin,a novel tannin component isolated from Terminalia catappa,on H-ras-transformed NIH3T3 cells[J].Toxicology letter,2006:44-53.
[5]Lee Sang-Ik,Kim Byoung-Soo,Kim Kyoung-Shin,et al. Immune-suppressive activity of punicalagin via inhibition of NFATactivation[J].BiochemicalandBiophysicalResearch Communications,2008,371:799-803.
[6]Jurenka J.Therapeutic Applications of Pomegranate(Punica granatum L.):A Review[J].Alternative Medicine Review,2008,2(13):128-144.
[7]郭增军,谭林,徐颖,等.鞣花酸类化合物在植物界的分布及其生物活性[J].天然产物研究与开发,2010(3):519-524.
[8]梁俊,李建科,赵伟,等.石榴皮多酚体外抗脂质过氧化作用研究[J].食品与生物技术学报,2012,31(2):159-165.
[9]Al-Muammar MN,Khan F.Obesity:The preventive role of the pomegranate(Punica granatum)[J].Nutrition,2012:1-10.
[10]Manuel Viuda-Martos,Yolanda Ruiz-Navajas,Juana Fernández-López,et al.Antioxidant properties of pomegranate(Punica granatum L.)bagasses obtained as co-product in the juice extraction[J].Food Research International,2011,44:1217-1223.
[11]Mustafa Çam.Pressurised water extraction of polyphenols from pomegranate peels[J].Food Chemistry,2010,123:878-885.
[12]程霜,郭长江,杨继军,等.石榴皮多酚提取物降血脂效果的实验研究[J].解放军预防医学杂志,2005,23(3):160-163.
[13]李云峰.石榴皮抗氧化物质提取及其抗氧化、抗动脉粥样硬化作用研究[D].北京:中国人民解放军军事医学科学院,2004.
[14]丁玮,孙建新,扎文峰,等.石榴皮醇提物降血脂作用的实验研究[J].中药新药与临床药理,2011,22(1):44-47.
[15]梁俊,李建科,刘永峰,等.石榴皮多酚对脂变L-02肝细胞胆固醇合成的影响及机制探究[J].食品与生物技术学报,2013,32(4):487-493.
[16]陈慧梅,廖红,高静.肝细胞培养方法研究进展[J].细胞生物学杂志,2002,24(3):163-166.
[17]田玉旺,李琳,李丽,等.介绍一种改良的油红O脂肪染色法[J].中国组织化学与细胞化学杂志,2007(6):736-736.
[18]殷红,程桂芳.白藜芦醇双向调节核转录因子-κB活化和HEK293细胞增殖[J].科学通报,2005,50(9):885-889.
[19]罗彤,戚向阳,李培培.紫菜多糖双向免疫调节作用的研究进展[J].食品科技,2010,35(8):210-216.
[20]周成江,和彦苓,周立社,等.蒙药童格勒格-1四种粗提物对大鼠肝细胞BRL株低密度脂蛋白受体基因表达的影响[J].中国现代应用医学,2008,25(3):186-189.
[21]陈芬,王绿娅,尹卫东.低密度脂蛋白受体功能及其影响因素研究进展[J].中国动脉硬化杂志,2006,14(5):448-450.
[22]于碧莲,赵水平,谢湘竹,等.氧化型低密度脂蛋白对3T3-L1脂肪细胞胆固醇流出的影响[J].中南大学学报:医学版,2007,32(4):631-636.
Effect of pomegranate peel polyphenols on regulation pathways of cholesterol in hepatic cell
LV Ou,LI Jian-ke*,MA Qian-qian,LIANG Jun,ZHAO Wei
(College of Food Engineering and Nutritional Science,Shaanxi Normal University,Xi’an 710062,China)
This paper was aimed to study the effects of pomegranate peel polyphenols on lipid droplet formation of hepatocyte and the expression levels of cholesterol synthesis enzyme gene and low density lipoprotein receptor gene.Pomegranate peel polyphenols(PPPs),punicalagin(PC)and pomegranate ellagic acid(EA)were used as test substances,L-02 human hepatocytes were choosen as experimental cell.The lipid droplets in human hepatocytes were assessed by oil red O staining,and the expression levels of HMGCR mRNA,SE mRNA,low density lipoprotein receptor gene LDLR mRNA and its upstream gene SREBP-2 mRNA was analyzed by RT-PCR.The results showed that these three test substances could reduce the intracellular lipid droplets,and the EA showed better effect.Compared with the model group,PPPs could significantly decrease(p<0.01)cholesterol.Moreover,compared with the normal group,HMGCR mRNA and SE mRNA were downregulated,whereas LDLR mRNA and SREBP-2 mRNA were up-regulated by pomegranate peel polyphenols. The possible mechanism of regulating cholesterol balance by PPPs and its mian component PC and EA in hepatic cells was via the downregulating cholesterol synthesis enzyme gene expression and upregulating the LDLR gene expression.
pomegranate peel polyphenols;punicalagin;pomegranate ellagic acid;cholesterol
TS255.1
A
1002-0306(2015)16-0222-05
10.13386/j.issn1002-0306.2015.16.037
2014-10-14
吕欧(1988-),女,硕士研究生,研究方向:食品营养与安全,E-mail:A992878504@163.com。
李建科(1960-),男,博士,教授,研究方向:食品分子营养学,E-mail:jiankel@snnu.edu.com。
国家自然科学基金项目(31171677)。
