川芎嗪对UVA诱导人皮肤成纤维细胞衰老的拮抗作用及MMP-1、MMP-3 mRNA表达影响
2015-11-07赵敏玲刘仲荣陈胡林朱英杰严苗苗范秀针
赵敏玲 刘仲荣 陈胡林 朱英杰 严苗苗 范秀针
川芎嗪对UVA诱导人皮肤成纤维细胞衰老的拮抗作用及MMP-1、MMP-3 mRNA表达影响
赵敏玲 刘仲荣 陈胡林 朱英杰 严苗苗 范秀针
目的 探讨川芎嗪对长波紫外线(UVA)诱导人皮肤成纤维细胞(HDF)衰老的拮抗作用及对基质金属蛋白酶(MMP)-1和MMP-3 mRNA表达的影响。方法 酶消化法分离HDF进行原代培养,用不同浓度川芎嗪分别作用UVA多次照射前后的HDF。CCK-8法检测川芎嗪作用24、48、72 h或川芎嗪预处理24 h进行多次UVA照射的各组HDF体外增殖情况。光学显微镜下观察经多次UVA照射的各组细胞形态变化及β半乳糖苷酶染色情况,实时荧光定量PCR检测各组细胞内MMP-1和MMP-3 mRNA相对表达量。结果 浓度为20、50 mg/L的川芎嗪作用HDF 24、48、72 h对细胞的体外增殖活性无促进或抑制作用,但100 mg/L作用48 h对HDF出现短暂抑制作用,与未给药组比较细胞增殖活性差异有统计学意义(P<0.05)。20、50、100 mg/L的川芎嗪预处理HDF 24、48、72 h对经多次UVA照射的HDF体外增殖均有一定的促进作用,各组间细胞增殖活性在3个时间点差异有统计学意义(F值分别为17.451,15.231,23.535,均P<0.01)。多次UVA照射后HDF形态出现体积变大、颗粒增加及β半乳糖苷酶表达增加等衰老现象,接近复制性衰老的HDF(P55组)。而20、50、100 mg/L的川芎嗪预处理HDF 24 h可减轻这种衰老现象,其中UVA组β半乳糖苷酶阳性率(68.417± 1.181)%,UVA+川芎嗪20 mg/L组(58.167±5.620)%,UVA+川芎嗪50 mg/L组(45.167±5.502)%,UVA+川芎嗪100 mg/L组(43.000±2.000)%,未照射组(33.667±5.865)%,P55组(76.000±6.557)%,各组间差异有统计学意义(F=45.918,P<0.01),且UVA+各浓度川芎嗪组、未照射组与UVA组比较差异有统计学意义(均P<0.05)。川芎嗪可降低多次UVA照射诱导的HDF表达MMP-1和MMP-3 mRNA,且UVA+各浓度川芎嗪组、未照射组与UVA组比较差异有统计学意义(均P<0.05)。结论 川芎嗪对多次UVA照射诱导的HDF衰老有拮抗作用,并能降低HDF衰老过程中MMP-1和MMP-3 mRNA的表达。
川芎嗪;成纤维细胞;细胞衰老;基质金属蛋白酶1;基质金属蛋白酶3;紫外线;细胞增殖
人皮肤成纤维细胞(HDF)能维持皮肤的弹性及水分,皮肤老化出现松弛、干燥粗糙、弹性下降、皱纹增多等现象都与HDF的数量减少及分泌合成功能下降有关[1-2]。长波紫外线(UVA)穿透力强,引起成纤维细胞损伤,长期反复照射,引起衰老相关标志物β半乳糖苷酶表达增加,还诱导HDF表达基质金属蛋白酶(MMP)增加。MMP是降解皮肤胶原纤维的主要因子,可促进皮肤光老化现象的发生[3]。盐酸川芎嗪(2,3,5,6-tetramethylpyrazine)是川芎中的主要活性生物碱。研究发现,川芎嗪有抗氧化应激[4]、抗肿瘤[5]等作用。我们研究川芎嗪对多次UVA照射诱导HDF衰老以及MMP-1、MMP-3 mRNA表达的影响,为其抗皮肤光老化提供一定的依据。
材料与方法
一、主要仪器和试剂
盐酸川芎嗪(白色干粉剂,上海纯优生物科技有限公司,货号P1010,CAS:76494-51-4,纯度≥98%)CCK-8试剂盒、β半乳糖苷酶染色试剂盒(美国Sigma公司),Transcriptor First Strand cDNA合成试剂盒、2×SYBR Green I Master(ROX)(美国Roche公司)。UVA台式紫外线治疗仪(SS-04A)、UVA辐射探测仪(上海希格玛高技术有限公司),酶标仪(美国Life Technologies公司),PCR仪(美国Bio-Rad公司),Rotor-Gene 6000 PCR仪(美国Corbett公司)。
二、方法
1.药物配制:用含10%胎牛血清的高糖DMEM培养液常温下溶解盐酸川芎嗪,分别配制成浓度为20、50、100 mg/L。
2.细胞培养:HDF为原代培养的人皮肤成纤维细胞,取自门诊手术室健康青年男性(年龄18~23岁)包皮环切术后进行标本分离的包皮组织,采用酶消化法分离留取HDF进行原代培养,连续传代,取第3~10代细胞进行实验。本研究经过医院伦理委员会批准,患者均签署知情同意书。
3.细胞分组和UVA照射:部分HDF分成未给药组(只给予含10%胎牛血清的高糖DMEM培养液)、20 mg/L川芎嗪组、50 mg/L川芎嗪组、100 mg/L川芎嗪组,观察川芎嗪预处理24、48、72 h对成纤维细胞增殖活性的影响。另一部分HDF分成5组:UVA+20 mg/L川芎嗪组、UVA+50 mg/L川芎嗪组、UVA+100 mg/L川芎嗪组、UVA组(高糖DMEM培养液+UVA照射)、未照射组(不照射,其余处置与UVA组同),各药物组先用川芎嗪预处理HDF细胞24 h后进行UVA照射,以观察川芎嗪对多次UVA照射诱导HDF衰老以及MMP-1、MMP-3 mRNA表达的影响。
UVA照射:HDF接种于直径30 mm的培养皿中,接种密度为1×104/皿,置37℃、5%CO2培养箱中培养至融合时进行UVA照射,利用UVA辐射探测仪检测UVA的强度(照射强度10 mW/cm2,照射距离10 cm)调整照射时间使照射剂量为10 J,每日1次,连续照射5次,累积剂量为50 J。每次UVA照射前吸出培养液,磷酸盐缓冲液(PBS)洗涤1次,再以PBS覆盖细胞,置于冰上照射。
4.CCK-8法检测川芎嗪对UVA照射前后HDF增殖活性的影响:取各组HDF,调整浓度为3.0× 103/ml接种于96孔板,每孔100 μl,每组设3个复孔,培养24、48、72 h,每孔加入10 μl CCK-8试剂,置37℃培养箱中避光孵育2h,酶标仪测定在450 nm波长处每孔的吸光度值。实验重复3次,取均值。
5.光镜下观察HDF形态变化及β半乳糖苷酶染色:取各组细胞,多次UVA照射后24 h,光学倒置显微镜下观察细胞形态变化,以衰老(传至55代,P55)HDF作为衰老阳性对照组。β半乳糖苷酶染色于光学倒置显微镜下观察细胞着色情况并拍照,蓝色细胞为阳性,每孔随机挑选4个视野(×100)计数至少500个细胞,计算染色阳性率[6],每个视野染色阳性细胞百分比=阳性细胞数/细胞总数×100%。实验重复3次。
6.实时荧光定量PCR检测HDF MMP-1、3的mRNA表达:取各组细胞,多次UVA照射后24 h提取细胞总RNA,反转录合成cDNA。PCR扩增条件:95℃预变性10 min,95℃变性15 s,60℃退火延伸60 s,40个循环。每次反应设3个复孔。反应结束后,采用△△Ct法分析目的基因相对表达量。目的基因引物:MMP-1上游:5′-CCCAAGGACATCTACAGC-3′,下游:5′-CTCTGGGATCAACGTCAG-3′,扩增片段长度为630 bp;MMP-3上游:5′-TATGGATCCCC CCCTGACTCCCCTGAG-3′,下游:5′-ATGGAATTCA GGTTCAAGCTTCCTGAGG-3′,扩增片段长度为434 bp。β肌动蛋白引物:上游5′-GTCCTCTCCCAA GTCCACAC-3′,下游:5′-GGGA-GACCAAAAGCCT TCAT-3′,扩增片段205 bp。
结果
1.川芎嗪对HDF体外增殖活性的影响:见表1。与未加药组比较,川芎嗪100 mg/L作用48 h组细胞增殖活性显著降低(P<0.05),而作用24 h和72 h组没有统计学变化(均P>0.05)。其余各浓度组的细胞增殖活性与未加药组比较在各时间点差异无统计学意义(均P>0.05)。据此在后续非细胞增殖实验中选择24 h作为处理时间。
表1 不同浓度川芎嗪作用不同时间对未照射人皮肤成纤维细胞体外增殖的影响(A450,±s)
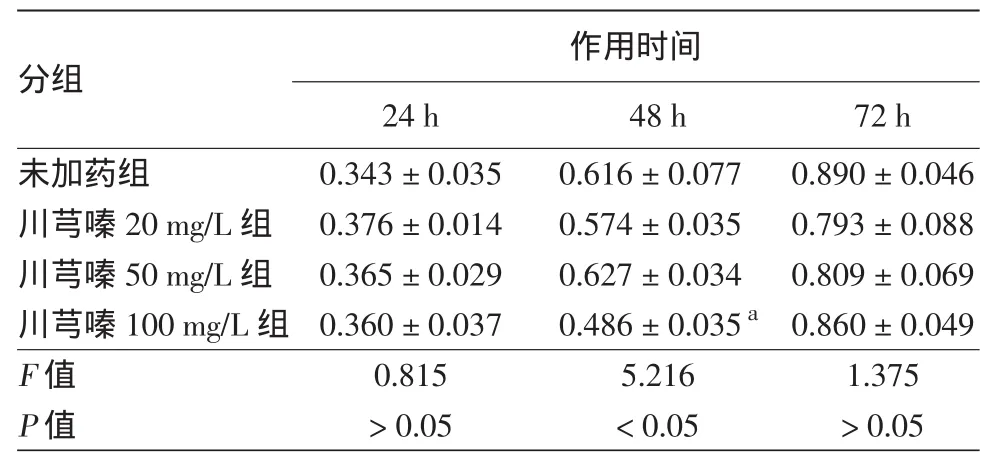
表1 不同浓度川芎嗪作用不同时间对未照射人皮肤成纤维细胞体外增殖的影响(A450,±s)
注:n=3。a:与未加药组比较,P<0.05
分组 作用时间24 h 48 h 72 h未加药组 0.343±0.035 0.616±0.077 0.890±0.046川芎嗪20 mg/L组 0.376±0.014 0.574±0.035 0.793±0.088川芎嗪50 mg/L组 0.365±0.029 0.627±0.034 0.809±0.069川芎嗪100 mg/L组 0.360±0.037 0.486±0.035a 0.860±0.049 F值 0.815 5.216 1.375 P值 >0.05 <0.05 >0.05
2.川芎嗪对多次UVA照射后HDF体外增殖活性的影响:见表2。与未照射组比较,经UVA多次照射后各组细胞增殖活性明显降低,除48h时,UVA+川芎嗪100mg/L组外,差异有统计学意义(均P<0.05)。与UVA组比较,川芎嗪各浓度组细胞增殖活性升高,且UVA+川芎嗪100 mg/L组在24、48、72 h时与UVA组差异有统计学意义(均P<0.05)。结果显示,多次UVA照射对HDF的增殖活性有抑制作用,而川芎嗪在浓度100 mg/L范围内能减轻这种抑制作用,且在浓度100 mg/L时作用更显著,在48 h时细胞增殖活性与未照射组差异无统计学意义。
表2 川芎嗪对多次长波紫外线(UVA)照射后HDF体外增殖活性的影响(A450,±s)

表2 川芎嗪对多次长波紫外线(UVA)照射后HDF体外增殖活性的影响(A450,±s)
注:n=5。a:与未照射组比较,P<0.05;b:与UVA组比较,P<0.05。HDF:人皮肤成纤维细胞
作用时间24 h 48 h 72 h 0.522±0.037a 0.738±0.037a0.804±0.023a UVA+川芎嗪20 mg/L组 0.566±0.046a 0.779±0.041a0.925±0.040ab UVA+川芎嗪50 mg/L组 0.606±0.016ab 0.763±0.055a0.932±0.053ab UVA+川芎嗪100 mg/L组 0.621±0.032ab 0.914±0.065b0.984±0.072ab未照射组 0.711±0.049b 0.894±0.020b 1.081±0.024b F值 17.451 15.231 23.535 P值 <0.01 <0.01 <0.01
3.川芎嗪对多次UVA照射后HDF形态变化的影响:见图1。未照射组细胞生长活跃,主要表现为细长梭形、相互平行排列或呈放射状和漩涡状排列。P55组细胞有明显老化现象,细胞体积变大、形状扁平,或有过度伸展,伸展末端细长有分枝,胞内颗粒增加。UVA组细胞与P55组细胞有类似的变化,但程度较轻。而川芎嗪各浓度组细胞类似的变化则明显减轻,且在100 mg/L时接近未照射组细胞形态。
4.HDFβ半乳糖苷酶染色情况:多次UVA照射后HDF β半乳糖苷酶染色阳性率明显增加,其中UVA组β半乳糖苷酶阳性率为(68.417±1.181)%,UVA+川芎嗪20mg/L组为(58.167±5.620)%,UVA+川芎嗪50mg/L组为(45.167±5.502)%,UVA+川芎嗪100mg/L组为(43.000±2.000)%,未照射组为(33.667± 5.865)%,P55组为(76.000±6.557)%,各组间差异有统计学意义(F=45.918,P<0.01),且UVA组、UVA+川芎嗪20 mg/L组、UVA+川芎嗪50 mg/L组、UVA+川芎嗪100mg/L组与未照射组比较均有统计学差异(均P<0.05),UVA组细胞阳性率接近P55组,且两组间差异无统计学意义(P>0.05)。川芎嗪能降低多次UVA照射引起的β半乳糖苷酶着色增加,其作用有随浓度的增加而增大的趋势,UVA+川芎嗪20 mg/L组、UVA+川芎嗪50mg/L组、UVA+川芎嗪100 mg/L组与UVA组的差异有统计学意义(均P<0.05)。
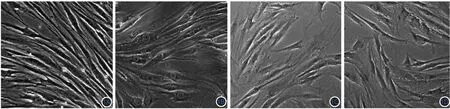
图1 显微镜观察川芎嗪对多次长波紫外线(UVA)照射后HDF形态变化的影响(×200) 未照射组(1A)细胞形态呈细长梭形;UVA+川芎嗪100 mg/L组(1B)与未照射组细胞形态较接近,但细胞体积较未照射组有所增大;UVA组(1C)细胞生长较稀疏,体积变大、形状扁平、胞内颗粒增加;P55组(1D)与UVA组细胞形态接近,细胞生长稀疏,体积变大、形状扁平、伸展末端细长有分支、胞内颗粒增加
表3 川芎嗪对多次长波紫外线(UVA)照射后HDF MMP-1、MMP-3 mRNA表达(2-△△C)t的影响(±s)
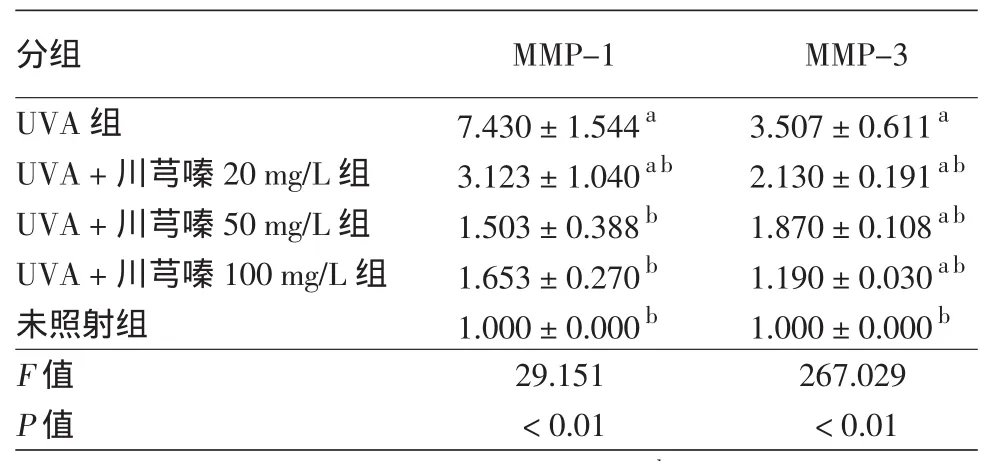
表3 川芎嗪对多次长波紫外线(UVA)照射后HDF MMP-1、MMP-3 mRNA表达(2-△△C)t的影响(±s)
注:n=3。a:与未照射组比较,P<0.05;b:与UVA组比较,P<0.05。HDF:人皮肤成纤维细胞;MMP:基质金属蛋白酶
分组 MMP-1 MMP-3 UVA组 7.430±1.544a 3.507±0.611a UVA+川芎嗪20 mg/L组 3.123±1.040ab 2.130±0.191ab UVA+川芎嗪50 mg/L组 1.503±0.388b 1.870±0.108ab UVA+川芎嗪100 mg/L组 1.653±0.270b 1.190±0.030ab未照射组 1.000±0.000b 1.000±0.000b F值 29.151 267.029 P值 <0.01 <0.01
5.川芎嗪对多次UVA照射后HDF MMP-1、MMP-3 mRNA表达的影响:见表3。与UVA组比较,不同浓度川芎嗪能降低衰老HDF中MMP-1、MMP-3 mRNA表达,且差异有统计学意义(均P<0.05)。与未照射组比较,UVA组与川芎嗪20 mg/L组MMP-1、MMP-3 mRNA表达量均显著增加(均P<0.05)。川芎嗪 50、100 mg/L浓度组 MMP-1的mRNA表达量与未照射组比较无统计学差异(均P>0.05),而MMP-3 mRNA表达量差异有统计学意义(均P<0.05)。
讨论
川芎嗪是从中药川芎中提取出来的活性生物单体,具有广泛的药理作用。本研究用川芎嗪作为研究对象,以多次低剂量UVA照射HDF诱导细胞衰老,探讨川芎嗪对UVA诱导HDF衰老的保护作用。结果显示,100 mg/L川芎嗪处理细胞48 h后出现短暂的细胞增殖抑制作用,可能与川芎嗪抑制成纤维细胞DNA合成有关[7],但至72 h时抑制作用消失,提示其可能为一过性,细胞自身可对抗这种抑制作用。进一步研究显示,多次UVA照射可诱导HDF生长缓慢,而川芎嗪在一定浓度范围内可减缓这种衰老现象,且在浓度为100 mg/L作用48 h后这种保护作用更强,该组细胞增殖活性与未照射组差异无统计学意义,但与UVA照射前100 mg/L川芎嗪作用HDF 48 h出现一过性抑制作用相矛盾,我们推测这种矛盾可能与低浓度川芎嗪诱导HDF出现适应性反应有关。低剂量电离辐射可诱导生物体或细胞出现适应性反应已有较深入的研究并得到了证实[8]。普遍认为适应性反应的机制与细胞内Ca2+、蛋白激酶C(PKC)激活进一步诱导保护性蛋白有关[9]。
衰老成纤维细胞和角质形成细胞均表达β半乳糖苷酶,而休眠细胞和终末分化细胞则缺乏。本研究发现,川芎嗪能降低多次UVA照射引起HDF的β半乳糖苷酶表达,并改善细胞体积变大、颗粒增加等细胞衰老现象,提示川芎嗪能延缓多次UVA照射诱导的HDF衰老。
本课题组前期[10-11]研究表明,多次低剂量UVA能诱导HDF分泌MMP增加,降解细胞外基质,从而促进皮肤光老化皱纹形成。有学者认为,MMP-1和MMP-3在衰老的皮肤中表达增加,促进皮肤光老化的发生[12]。研究表明,UVA的多次照射通过诱导细胞内氧自由基累积等作用,促进成纤维细胞衰老的发生,改变其生物学特性,增加MMP分泌,使胶原纤维及弹性纤维数量减少、结构崩解,从而引起皮肤干燥、深皱纹、粗糙、皮革样外观、色素沉着等皮肤光老化的改变[13]。本研究中,与UVA组比较,不同浓度川芎嗪均能降低多次UVA照射诱导的HDF内MMP-1和MMP-3 mRNA表达。据此推测,川芎嗪有一定的抗皮肤光老化作用,可以通过降低HDF内MMP-1和MMP-3 mRNA表达保护弹性纤维免遭水解,对抗皮肤老化。
综上所述,我们的实验结果初步证实川芎嗪能延缓多次UVA照射引起的HDF生长缓慢、细胞颗粒增加、体积变大以及β半乳糖苷酶表达增加等衰老现象,可能与川芎嗪清除氧自由基[4]甚至潜在地诱导细胞适应性反应有关,其机制尚待进一步探讨。
[1]吕莹,蒋献.紫外线对人皮肤成纤维细胞的影响[J].国际皮肤性病学杂志,2006,32(2):130-132.
[2]Fagot D,Asselineau D,Bernerd F.Matrix metalloproteinase-1 production observed after solar-simulated radiation exposure is assumed by dermal fibroblasts but involves a paracrine activation through epidermal keratinocytes[J].Photochem Photobiol,2004, 79(6):499-505.
[3]Yao J,Liu Y,Wang X,et al.UVB radiation induces human lens epithelial cell migration via NADPH oxidase-mediated generation of reactive oxygen species and up-regulation of matrix metalloproteinases[J].Int J Mol Med,2009,24(2):153-159.
[4]Zheng CY,Xiao W,Zhu MX,et al.Inhibition of cyclooxygenase-2 by tetramethylpyrazine and its effects on A549 cell invasion and metastasis[J].Int J Oncol,2012,40(6):2029-2037.
[5]Zhang Y,Liu X,Zuo T,et al.Tetramethylpyrazine reverses multidrug resistance in breast cancer cells through regulating the expression and function of P-glycoprotein[J].Med Oncol,2012,29(2):534-538.
[6]Zhu Y,Song X,Han F,et al.Alteration of histone acetylation pattern during long-term serum-free culture conditions of human fetal placental mesenchymal stem cells[J/OL].PLoS One,2015,10(2):e0117068[2015-05-10].http://www.ncbi.nlm.nih.gov/pmc/ articles/PMC4324636/
[7]江美芳.川芎嗪注射液的临床应用进展[J].中国现代药物应用,2008,2(9):109-110.
[8]Upton AC.National Coluncil on Radiation protection and measurements scientific committee 1-6.The state of the art in the 1990′s: NCRP Report No.136 on the scientific bases for linearity in the dose-response relationship for ionizing radiation[J].Health Phys, 2003,85(1):15-22.
[9]刘树铮.低水平环境因子与适应性反应[J].中华放射医学与防护杂志,1998,18(5):310-315.
[10]刘仲荣,刘荣卿,张国威,等.基质金属蛋白酶表达在皮肤光老化皱纹形成中的作用[J].中华皮肤科杂志,2003,36(6):332-334.
[11]刘静宇,刘仲荣,杨慧兰,等.低剂量长波紫外线反复照射诱导培养成纤维细胞表达基质金属蛋白酶实验研究[J].中国美容医学,2010,19(11):1635-1637.
[12]Permatasari F,Hu YY,Zhang JA,et al.Anti-photoaging potential of Botulinum Toxin Type A in UVB-induced premature senescence of human dermal fibroblastsin vitrothrough decreasing senescencerelated proteins[J].J Photochem Photobiol B,2014,133:115-123.
[13]Bae JT,Ko HJ,Kim GB,et al.Protective effects of fermented Citrus unshiu peel extract against ultraviolet-A-induced photoageing in human dermal fibrobolasts[J].Phytother Res,2012,26(12): 1851-1856.
Inhibitory effect of tetramethylpyrazine on ultraviolet A-induced senescence and matrix metalloproteinase-1 and-3 mRNA expressions in human dermal fibroblasts
Zhao Minling,Liu Zhongrong,Chen Hulin,Zhu Yingjie, Yan Miaomiao,Fan Xiuzhen.Department of Dermatology,Guangzhou General Hospital of Guangzhou Military Command of PLA,Guangzhou 510010,China
Corresponding author:Liu Zhongrong,Email:pfklzr@163.com
ObjectiveTo explore the inhibitory effect of tetramethylpyrazine(TMP)on ultraviolet A-induced senescence as well as matrix metalloproteinase-1(MMP-1)and-3(MMP-3)mRNA expressions in human dermal fibroblasts(HDFs).MethodsHDFs were isolated from the prepuce by enzymatic digestion,and subjected to primary culture.Cultured HDFs were randomly divided into several groups:control group cultured in high-glucose DMEM medium and receiving no treatment,three TMP groups treated with 20,50 and 100 mg/L TMP respectively,UVA group receiving UVA radiation alone,UVA+TMP groups pretreated with 20,50 and 100 mg/L TMP respectively for different durations followed by UVA radiation.UVA radiation was given once daily for 5 consecutive days.The 55th passage HDFs served as the P55 group(senescence control group).Subsequently,CCK-8 assay was performed to evaluate the proliferative activity of HDFsin vitro,optical microscopy to observe the morphologic changes of HDFs after UVA radiation,β-galactosidase staining to estimate the senescence in HDFs,and real-time fluorescence-based quantitative PCR to quantify the mRNA expressions of MMP-1 and MMP-3 in HDFs.Statistical analysis was carried out by one-way analysis of variance(ANOVA)followed by least significant difference(LSD)-ttest or Dunnett′s T3 test.ResultsCompared with the control group,the proliferation of HDFs was significantly but transiently inhibitedin vitroafter the treatment with 100 mg/L TMP for 48 hours(P<0.05),but showed no significant changes after the treatment with 20 or 50 mg/L TMP for 24,48 or 72 hours or after the treatment with 100 mg/L TMP for 24 or 72 hours(allP<0.05).The pretreatments with TMP of 20,50 and 100 mg/L for 24,48 and 72 hours all promoted the proliferation of HDFs to acertain degree in the UVA+TMP groups compared with the UVA group,with significant differences in cellular proliferative activity among the UVA group,UVA+TMP groups and control group at 24,48 and 72 hours(F=17.451, 15.231,23.535,allP<0.01).Compared with the UVA group,the proliferative activity of HDFs was significantly increased in UVA+100-mg/L TMP group at 24,48,72 hours,UVA+50-mg/L TMP group at 24 and 72 hours and UVA+20-mg/L TMP group at 72 hours.After repetitive UVA radiation,HDFs in the UVA group experienced an increase in cell volume,granule acount,and β-galactosidase expression,which was similar to the changes in the P55 group,while the pretreatments with 20,50 and 100 mg/L TMP for 24 hours suppressed these UVA-induced changes in HDFs.The percentage of β-galactosidase-positive HDFs was 68.417%±1.181%in the UVA group,58.167% ±5.620%in the UVA+20-mg/L TMP group,45.167%±5.502%in the UVA+50-mg/L TMP group,43.000%±2.000%in the UVA+100-mg/L TMP group,33.667% ±5.865%in the control group,and 76.000% ±6.557%in the P55 group,with significant differences among these groups(F=45.918,P<0.01).Furthermore,the UVA group significantly differed from the UVA+TMP groups and control group in the percentage of β-galactosidase-positive HDFs and mRNA expressions of MMP-1 and MMP-3(allP<0.05).Conclusion TMP can protect HDFs against senescence induced by repetitive UVA radiation,and down-regulate the mRNA expressions of MMP-1 and MMP-3 during senescence.
Tetramethylpyrazine;Fibroblasts;Cell aging;Matrix metalloproteinase 1;Matrix metalloproteinase 3;Ultraviolet rays;Cell proliferation
10.3760/cma.j.issn.0412-4030.2015.10.009
国家自然科学基金(30972652);广东省省级科技计划项目(2013B021800053)
510010广州军区广州总医院皮肤科
刘仲荣,Email:pfklzr@163.com
2014-11-21)
(本文编辑:尚淑贤)
