长江口日本鳗鲡幼体色素发育时相及其体型变化
2015-11-05郭弘艺唐文乔张旭光吴嘉敏
郭弘艺 张 亚 唐文乔 刘 东 张旭光 吴嘉敏
(上海海洋大学农业部淡水水产种质资源重点实验室, 上海 201306)
日本鳗鲡(Anguilla japonica)是一种具有重要经济价值的降海洄游鱼类, 产卵场位于西马里亚纳海脊南部[1,2], 孵化的柳叶鳗仔鱼随北赤道流和黑潮输送至中国、朝鲜及日本的大陆架变态为玻璃鳗, 并在河口水域变态为线鳗[3]。柳叶鳗-玻璃鳗-线鳗的变态, 伴随着多个形态发育和生理调节过程。其中, 表皮和内部器官上渐进沉积的黑色素是最清晰的可视标志[4]。Tesch和White[3]根据色素发育特征, 将变态过程划分为I-VI色素发育时相。已有研究表明, 幼鳗色素发育过程中个体体长、体重、体型、丰满度以及存活率等指标发生显著变化[5—13]。
长江口历来是我国主要的鳗苗产区, 丰富的鳗苗资源支撑和主导着我国日本鳗鲡养殖业的整体发展[14]。目前人工养殖的鳗苗完全靠天然采捕, 苗种质量优劣直接影响着成鳗的产量。近年来, 我国学者对日本鳗鲡的研究主要集中在鳗苗的资源动态[15]、遗传结构[16]和早期生活史特征[17]等方面, 未见任何关于幼鳗色素发育的报道。本研究报道长江口日本鳗鲡幼鳗群体的色素发育时相分布, 研究色素发育时相与日龄以及长江口水温的关系, 旨在揭示色素发育过程中幼鳗体型和丰满度的变化规律, 为日本鳗鲡早期生活史研究提供基础资料。
1 材料与方法
1.1 实验材料
2012年 1—4月鳗苗汛期, 在长江口九段沙水域(图1), 随持鳗苗专项捕捞证渔船“沪浦渔 49669号”作业, 每日收集网内鳗苗, 同时监测采集点水温(℃)。鳗苗捕获后,立刻冰冻处死, 装入50 cm×30 cm双层封口保鲜袋内, 用冰块保存, 放入泡沫箱中带回实验室。
图1 长江口汛期日本鳗鲡鳗苗采集点Fig. 1 Sampling site of larva Japanese eels collected in the Yangtze River Estuary from fishing season
1.2 实验方法
鳗苗带回实验室解冻后, 用干净纱布吸干体表多余水分, 用电子分析天平称量标本体重(Body weight, BW),精确至1 mg, 用数显游标卡尺测量鱼体全长(Total length,TL), 精确至0.1 mm。由公式K = BW (g) /TL (mm)3×1000计算每尾个体的丰满度(Condition factor, K)。
据Fukuda等[12]对玻璃鳗神经索、脑部顶区、体表前区和体表后区4个区域色素发育过程研究(表1), 在Zeiss Stereo Discovery V12 解剖镜下, 逐一观测并拍照记录每尾鳗苗体色素发育状况。依据Tesch和White[6]以及Fukuda等[12]对日本鳗鲡色素发育过程的评判标准(表 2), 鉴定每尾鳗苗所处的发育时相。

表1 玻璃鳗神经索、脑部顶区、体表前区和体表后区色素发育过程的特征Tab.1 Pigmentation character locations in glass eels to discriminate each pigmentation phases in nerve cord (N1–N3), the top of the brain(B1–B2), anterior body surface (A1– A4) and posterior body surface (P1–P3).

表2 各发育时相色素沉积的评判标准Tab. 2 Pigmentation stages in A. japonica modified from the study of Tesch and Fukuda
1.3 数据分析
依据Tzeng和Tsai[18], 对日本鳗鲡日龄的描述和计数方法, 制备矢耳石磨片鉴定日龄。成功制片并鉴定日龄的幼鳗个体总计143尾。协方差分析(ANCOVA)日龄和水温对色素发育时相的影响。采用Kruskal-Wallis分析差异性检验各发育时相群体日龄、全长、体重和丰满度K。并将全长和体重转化为自然对数值, 线性分析各发育时相LnTL和LnBW的相关关系。数据处理和分析采用EXCEL 2007和SPSS 16.0软件进行。
2 结果
2.1 长江口幼鳗色素发育时相及特征
所分析的 425尾幼鳗均属于玻璃鳗阶段, 包括 VA—VIA15个色素发育时相。其中, VB1期个体最多, 为256尾,占总个体数的 60.2%; VB2和 VA次之, 分别占 21.4%和16.3%; VIA0和VIA1期个体极少, 分别为6尾和3尾, 仅占 1.4%和 0.7% (图 2、表 3)。
长江口汛期玻璃鳗各发育时相色素发育如下:
VA期(n=69): 体形呈鳗型, 69.6%个体神经索色素沉积未完全(N1占14.5%, N2占55.1%), 30.4%个体神经索色素完全沉积(N3); 体表前区, 仅有2.9%个体处于A1阶段,吻端未出现色素斑, 97.1%个体发育至A2阶段, 吻端有不同程度的色素沉积; 全部个体脑部顶区均未出现色素(B1)(图3a), 体表后区尾鳍端部均有少量色素斑(P2)。
VB1期(n=256): 神经索色素发育至N3个体比例上升至54.3%, N2个体比例降低至45.7%, 无N1个体。体表前区, 仅有 0.8%个体色素发育仍处于 A1阶段, 发育至A2比重上升至99.2%。全部个体脑部顶区均出现少量色素斑, 发育至B2阶段(图3b)。
VB2期(n=91): 神经索色素发育至 N3个体比例上升为 87.9%, N2个体仅为 12.1%。体表前区色素发育达到A3阶段, 脑部、尾鳍端部及吻端色素激增, 吻端色素延伸至眼后, 与脑部色素交汇(图3c)。
VIA0期(n=6): 全部个体神经索色素发育完全, 100%个体达N3阶段, 体表前区, 色素发育至A4阶段, 吻端色素延伸过脑后(图3d)。
VIA1期(n=3): 神经索、体表前区和脑部顶区色素均已完全沉积(个体处于N3, B2, A4阶段)。体表后区, 全部个体色素发育至P3阶段, 尾部色素沿着整个背鳍往前蔓延至背鳍前端, 与吻端蔓延至背鳍的色素斑交汇(图 4),肛门后背部色素往体表两侧发展, 色素尚未蔓延过侧线(图 5)。
Spearman相关分析显示, 身体各区域色素发育阶段均具有显著正相关关系(P<0.01, 表 4)。当个体脑部顶区色素发育处于B1阶段时, 其体表前区和后区色素分别发育至A1-2和P2阶段; 而当个体体表后区色素发育至P3阶段时, 相应个体的神经索、脑部顶区、体表前区色素均已发育完全, 分别至B2、N3和A4(表3)。由此可见, 玻璃鳗色素发育在身体各部是协同渐进的过程。
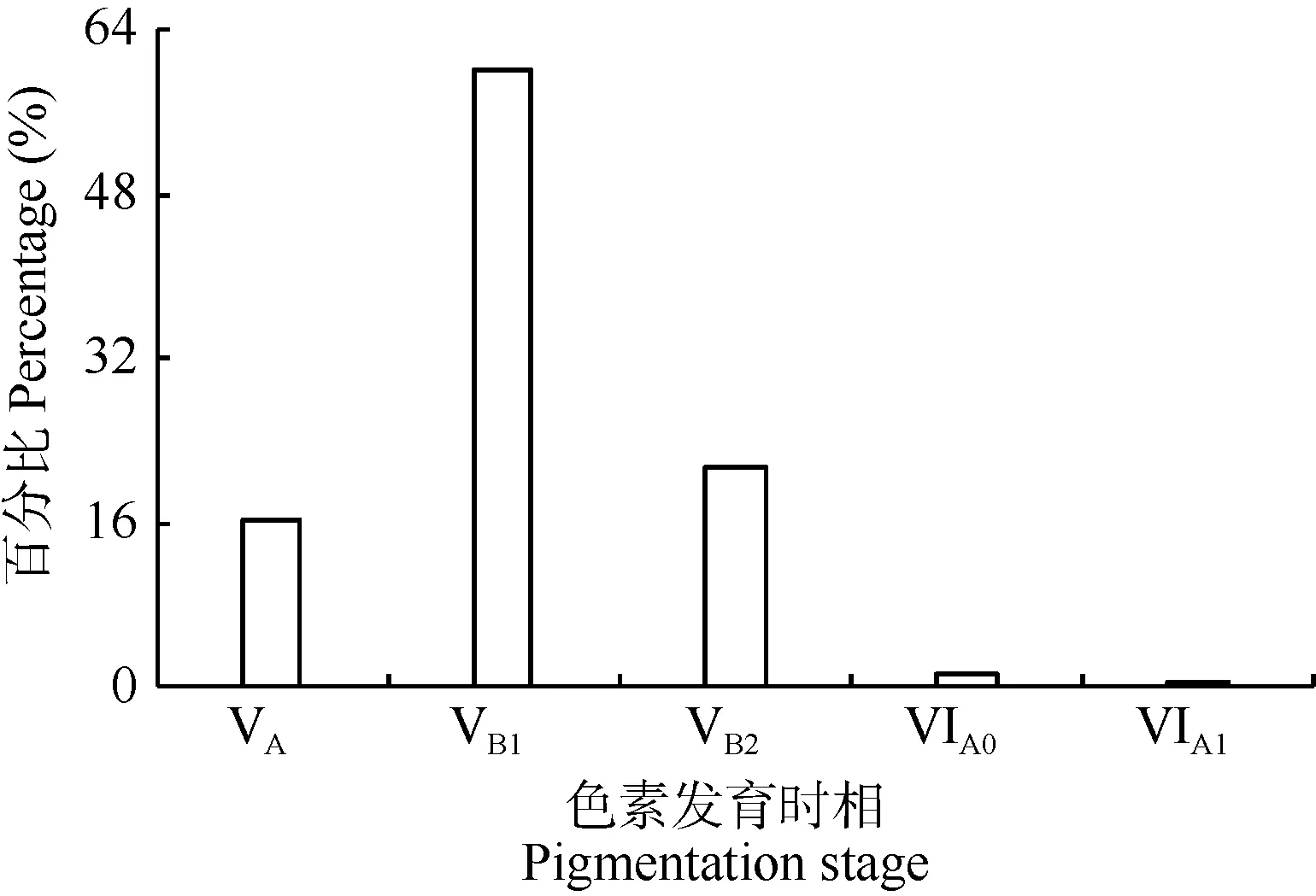
图2 长江口汛期玻璃鳗不同色素发育时相的个体比例Fig. 2 The percentage of A. japonica glass eels with each pigmentation stage collected in the Yangtze River Estuary from fishing season
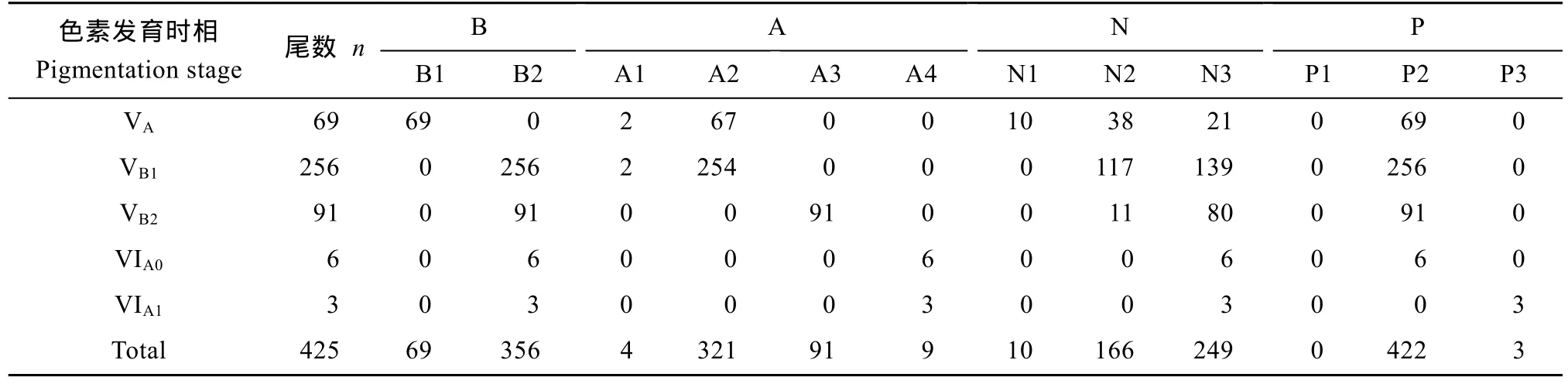
表3 长江口玻璃鳗不同色素发育时相所处的发育阶段Tab. 3 The number of A. japonica glass eels with each pigmentation stage of appearance of the pigmentation on the top of the brain, anterior body surface, nerve cord and posterior body surface
2.2 色素发育与日龄的关系
Kruskal-Wallis分析显示, 玻璃鳗群体VA—VIA15个色素发育时相间, 日龄存在极差异显著(P<0.01)。由图 6可见, 从VA期至VIA1期幼鳗群体日龄呈现递增趋势, 由(144±10.2)d 增至(181 ±10.8)d。
协方差分析显示, 水温和日龄对幼鳗色素发育均有显著影响(ANCOVA, P<0.01, 表5)。采用协方差模型扣除水温的影响, 即假设在相同水温条件影响下, 求得标准化水温条件的各色素发育时相的修正平均日龄。结果显示,扣除水温影响后, 各色素发育时相群体的平均日龄仍存在显著差异, 表现为 VA—VB2群体内及 VIA0—VIA1群体内日龄无显著差异, 但 VA—VB2与 VIA0—VIA1群体间具有显著差异(ANCOVA, P<0.05, 表 6)。Spearman相关分析表明, 扣除水温影响的修正日龄和色素发育时相成显著正相关关系(r=0.902, P<0.001)。由此可见, 幼鳗的体表色素发育时相, 可以作为日龄的指示标志。
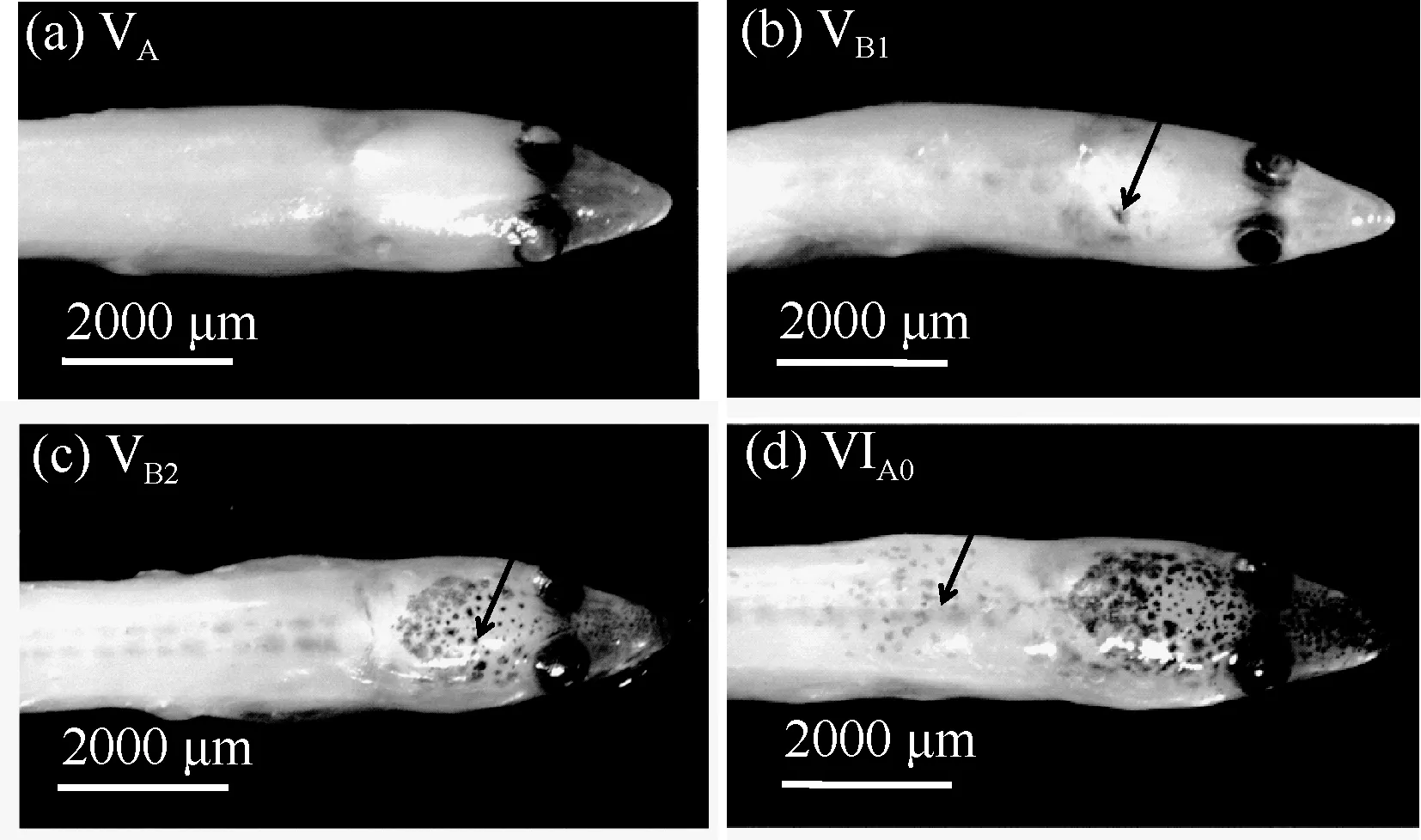
图3 VA— VIA0期玻璃鳗头部色素发育特征Fig. 3 Pigmentation character on the head pigmentation stages from VA to VI A0 in A. japonica glass eels
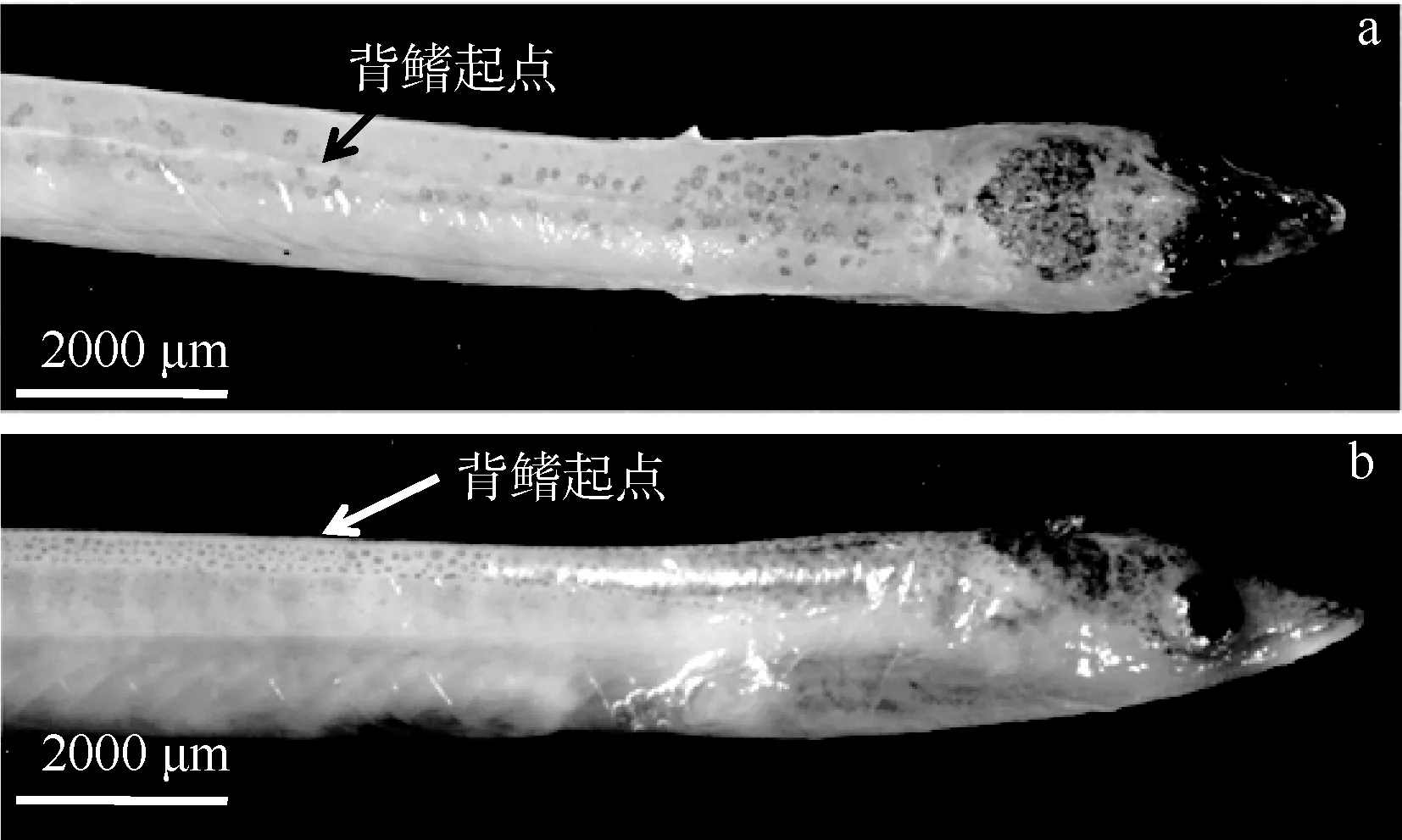
图4 VIA1期玻璃鳗背鳍起点色素发育特征Fig. 4 Pigmentation character on the original dorsal fin pigmentation stages VI A1 in A. japonica glass eels

图5 VIA1期玻璃鳗肛门前后体侧色素发育特征Fig. 5 Pigmentation character on the anal ventrolateral pigmentation stages VI A1 in A. japonica glass eels
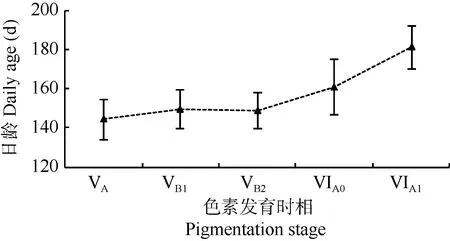
图6 长江口各色素发育时相玻璃鳗群体平均日龄Fig. 6 Mean ± SD daily age according to pigmentation stages in A.japonica glass eels
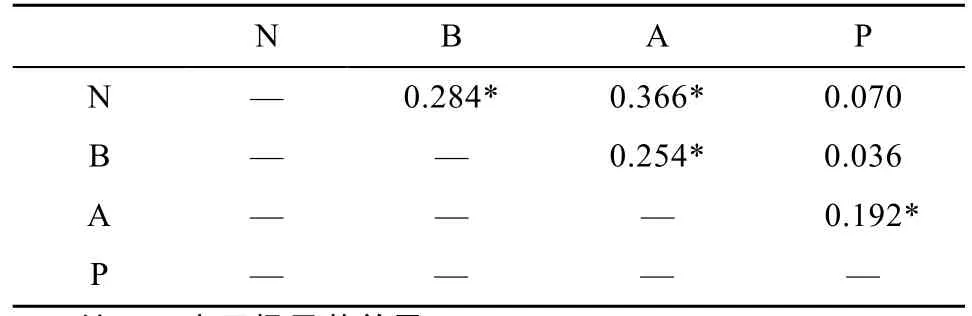
表4 玻璃鳗体表神经索、脑部顶区、体表前区和体表后区色素发育间Spearman相关分析Tab. 4 Spearman correlation analysis among the timing of appearance of the pigmentation phases on the top of the brain, anterior body surface, nerve cord and posterior body surface in A. japonica glass eels

表5 ANCOVA分析结果Tab.5 Results of the analysis of covariance
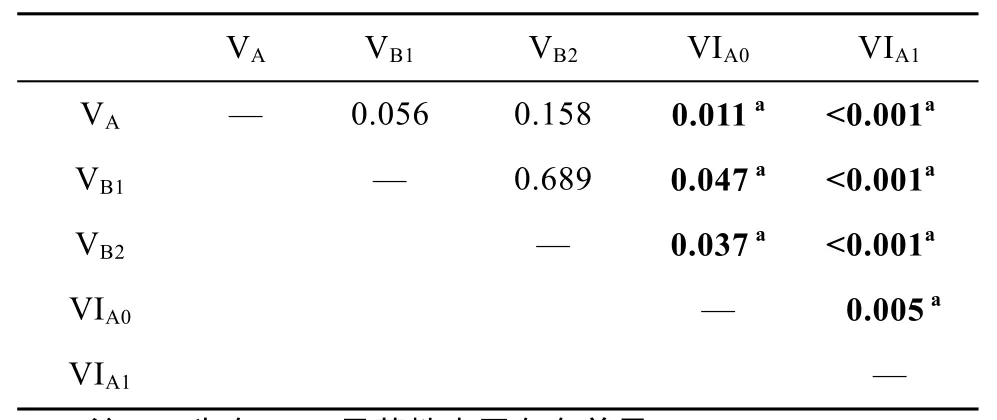
表6 协方差模型估算的各色素期修正平均日龄的成对显著性比较Tab. 6 Pairwise comparisons for mean age from the ANCOVA model for each pigmentation stage
2.3 色素发育过程中体型变化
Kruskal-Wallis分析显示, 玻璃鳗VA—VIA15个色素发育时相, 群体间全长无显著差异(P=0.258>0.05), 而体重和丰满度均存在极差异显著(P<0.001)。由图7可见, 从VA期至 VIA1期, 平均全长变化曲线较为平稳, 各期平均TL 为(55.6±2.4)—(57.7±5.0) mm; 而平均体重和丰满度变化曲线由VA期至VB1略有增加, 随后, VB1至VIA1期均呈急剧递减趋势[平均 BW 由(119±24.0) mg降至(79±13.6) mg, K 由 0.067±0.012降低至 0.041±0.004]。
各发育时相玻璃鳗群体的全长体重关系式见图 8,LnTL-LnBW线性模型的回归系数a (斜率)为2.53—3.14,由VA—VIA1期a值呈降低趋势, a值逐步偏离匀速生长值3, 呈异速性生长, 体型相对由丰满趋于纤细, 在相同的TL条件下, 色素发育晚期VIA0—VIA1群体BW反而较早期VA—VB2群体小。
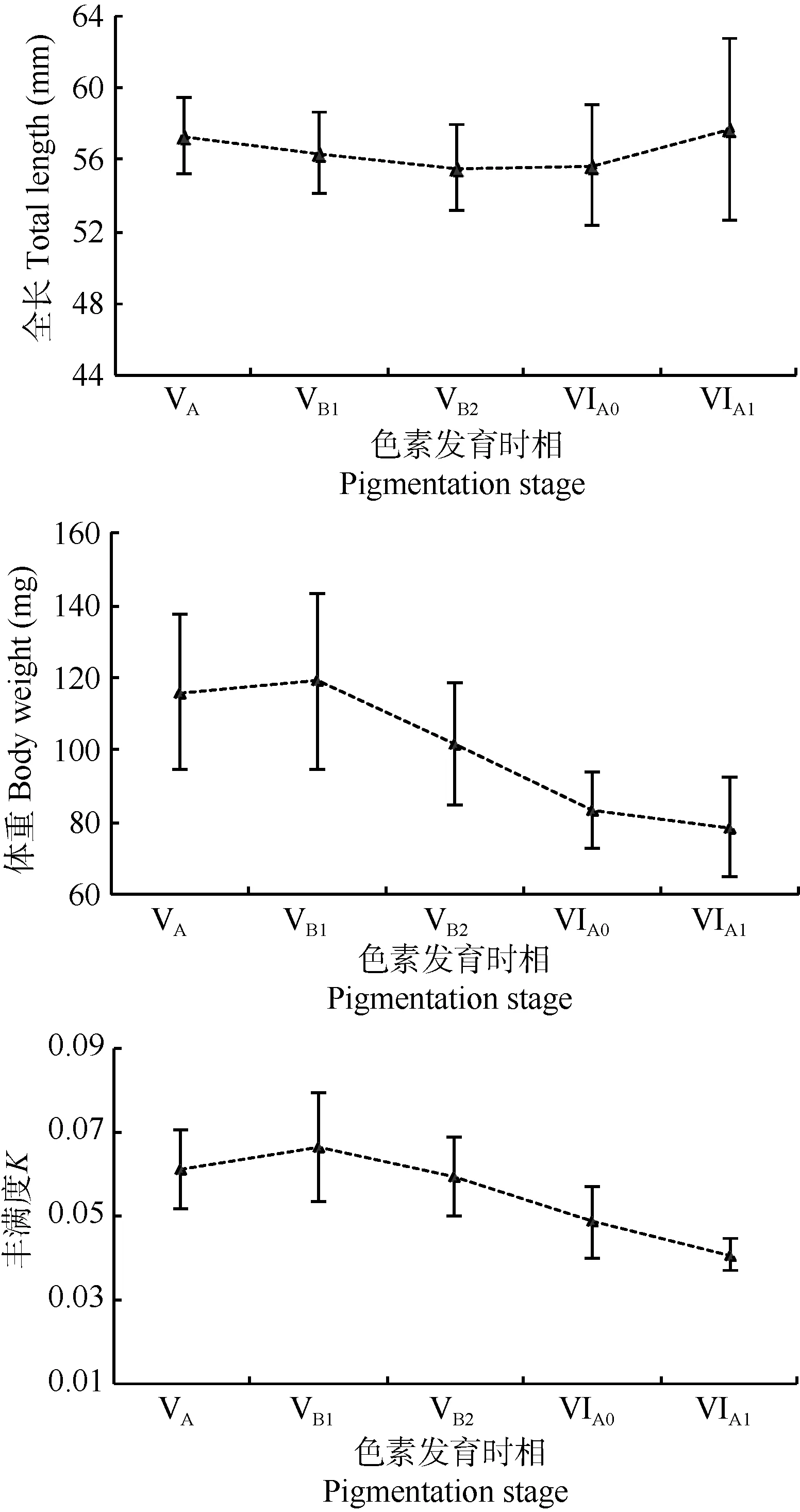
图7 玻璃鳗各色素发育时期平均全长、体重和丰满度变化Fig. 7 Mean ± SD total length, body weight and condition factor of A. japonica glass eels according to pigmentation stages
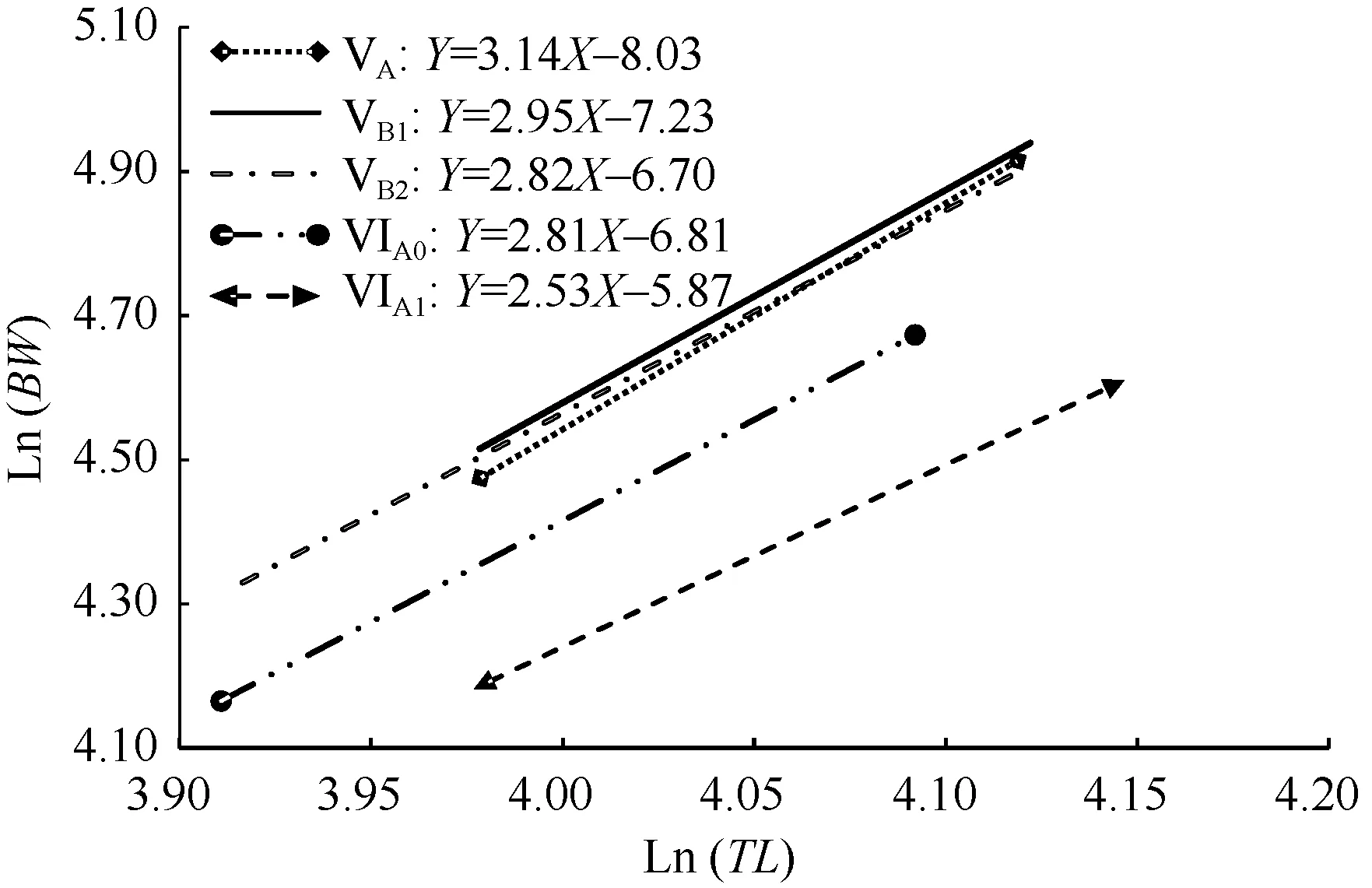
图8 玻璃鳗各色素发育时相全长和体重关系式Fig. 8 Linear regression lines of log-transformed total length(LnTL) and log-transformed body weight (LnBW) in each pigmentation stage of A. japonica glass eels
3 讨论
幼鳗早期的色素发育特征是识别其个体发育阶段的有效标志[3], 已应用于欧洲鳗鲡(A. anguilla)、美洲鳗鲡(A.rostrata)和日本鳗鲡早期生活史柳叶鳗至黄鳗阶段中发育时相的鉴定。欧洲鳗鲡的色素发育过程最早被报道[3],日本鳗鲡的色素发育过程与其基本一致, 仅在神经索色素发育进程和时间上与其存在差异: 欧洲鳗鲡神经索色素起始于II期, 由体后端向前连续发育; 而日本鳗鲡神经索色素起始于VA后期, 由体前段向后呈不连续发育[12]。本研究显示, 长江口汛期的日本鳗鲡幼鱼均处于柳叶鳗变态完成后的玻璃鳗期, 包括VA—VIA15个时相, 色素斑最先出现在尾鳍端部、吻端和神经索(VA), 随着脑颅背壁卤门闭合[3], 脑部顶区出现色素斑(VB1)。接着, 吻端色素延伸过眼部(VB2)和脑部(VIA0), 最后蔓延至背鳍与尾部延伸至背鳍的色素交汇(VIA1)。Spearman相关分析亦示, 各区域色素发育程度间具有显著正相关关系(P<0.01, 表4), 表明色素发育在身体各部是协同渐进的过程。
Cantrelle[19]研究结果显示, 欧洲鳗鲡色素发育程度与河口或淡水中环境刺激信号的强弱相关, 而与进入河口或者淡水后逗留时间无关。Han[20]研究表明, 室内养殖条件下, 日本鳗鲡幼鳗色素发育主要受水温影响, 而与日龄无关。Jessop[8]研究认为, 美洲鳗鲡幼鳗的色素发育进程不仅反映水温的增加, 亦反映在河口逗留时间。本研究结果与Jessop[8]的结果较为一致, ANCOVA分析显示,水温和日龄对长江口日本鳗幼鳗色素发育均有显著影响(P<0.01)。采用协方差模型扣除水温的影响后, 修正日龄仍与色素发育时相呈显著正相关关系(r=0.902, P<0.001),表明同一捕获条件下采集群体中, 色素发育时相可以作为日龄的指示标志。
本研究结果还显示, 随着色素发育进程(VA期—VIA1期), 长江口幼鳗群体的平均体长基本保持不变, 而平均体重和丰满度呈急剧递减趋势, 体型亦随之趋于纤细。Tesch和White[3]以及Fukuda等[12]在欧洲鳗鲡和日本鳗鲡研究中亦发现类似体型变化规律。幼鳗抵达河口直至开始溯河迁徙之间, 存在几天乃至数月的时滞, 以适应河口新环境, 逐步将游泳方式由大洋性的漂游转变为利用潮汐的选择性迁移[21,22], 最终主动逆流上游, 此期间形态和生理上同时发生相应的适应性改变。这段适应期的长短不仅取决于河口环境, 亦取决于幼鳗的个体发育程度和营养状况。同时, 研究表明抵达河口的初期, 幼鳗并不立即开始摄食, 仅以消耗体内柳叶鳗阶段积累的内源性营养维持代谢耗能, 直至适应河口环境或其发育到一定时相, 才开始摄食[9]。解剖结果亦证实, 部分色素发育早期的欧洲鳗幼鱼, 消化道和齿系尚未完全发育[8]。由此推断, 摄食的延迟和内源性营养的消耗是色素发育进程中个体平均体重的降低的原因, 而色素发育时相的日龄差值可作为其滞留河口时间长度的佐证。而在色素发育进程中, 丰满度的降低和体型的趋于纤细则是由于平均体重降低和平均体长基本保持不变造成的, Fukuda等[12]室内养殖实验结果显示日本鳗鲡幼鱼体型的降低趋势将持续至 VIA2或VIA3期。本研究 425尾幼鳗中, 玻璃鳗最初期 VA期占16.3%, VB1和 VB2期分别占60.2%和21.4%, VIA0和VIA1期个体极少, 仅占1.4%和0.7% (表3)。平均体重的急剧降低起始于VB1期(图7)。由上述结果结合日龄变化可以推断, 幼鳗抵达长江口日龄约为 144d, 大部分幼鳗快速渡过生理适应期, 逗留 5d左右, 色素发育至 VB期(平均日龄 149d)起始溯河; 仅极少数个体(2.1%), 逗留17d—37d, 发育至 VIA0—VIA1期开始溯河。由此也表明,长江口的水环境极适合于幼鳗由海洋生活史向淡水生活史的过渡。
