白屈菜红碱对铜绿微囊藻生长和光合系统的影响
2015-11-05刘彦彦邵继海刘德明李锦龙陈峻峰
刘彦彦 邵继海 刘德明 李锦龙 陈峻峰
(1. 湖南农业大学资源环境学院, 长沙 410128; 2. 湖南农业作物种质创新与资源利用国家重点实验室培育基地,长沙 410128)
随着现代工农业的发展, 许多水体呈现富营养化状态, 水体富营养化导致水体中藻类过度繁殖,在水体中形成水华。20世纪90年代以来, 我国淡水水体富营养化日趋严重。2012年中国环境状况公报显示, 我国62个国控重点湖泊(水库)中, Ⅳ以上的水体占有的比例高达38.7%。一些大型湖泊都先后暴发了严重的蓝藻水华, 如滇池、太湖等。目前, 城市及周边的小型水体有90%以上均处于富营养化和严重营养化水平, 蓝藻水华频频暴发[1,2]。因此蓝藻水华的削减与消除对于保证水体水质安全非常重要。
化学除藻是目前水体特别是小型水体, 蓝藻水华去除的主要方法, 该方法具有除藻效果好、见效快的优点。然而, 绝大部分化学除藻剂如CuSO4、除草剂等会给环境带来二次污染[3]。通过对水体环境中藻类生长繁殖机理的分析, 以及对各类抑藻技术优劣的比较, 生物源抑藻物质在抑藻方面的作用相对于化学方法具有安全和对水环境生态系统危害小等优点, 已引起各国学者的高度重视[4]。生物碱是存在于自然界中的一类含氮的天然有机化合物, 具有丰富的结构和生物活性多样性。白屈菜红碱是从中草药白屈菜(Chelidonium majus L)中提取的一种具有显著生理活性的生物碱, 具有多种药理学作用,如抗肿瘤、抑菌、抗炎作用[5]等。铜绿微囊藻是我国最常见的水华蓝藻种类, 也是产微囊藻毒素的主要种类之一。我们的研究结果显示白屈菜红碱对铜绿微囊藻具有很强的抑制作用, 因此利用白屈菜红碱削减水体蓝藻水华具有一定的应用潜力[6]。
光合放氧生物的叶绿素光诱导荧光与PSⅡ及反应中心电子供体侧和受体侧氧化还原状态密切相关[7]。Strasser和Strasser[8]在生物膜能量流动理论基础上建立了叶绿素光诱导荧光动力学曲线分析方法—JIP-test。JIP-test能较好的反应PSⅡ反应中心及电子供体侧和受体侧的生理状态, 现已广泛应用于环境胁迫对蓝藻PSⅡ结构与功能的影响等方面的研究[9,10]。为了研究白屈菜红碱对铜绿微囊藻生长和光合系统的影响, 本文探讨了白屈菜红碱胁迫下铜绿微囊藻生长、光合色素含量及叶绿素光诱导荧光动力学特征。本试验为阐明白屈菜红碱的抑藻机理提供了重要的信息。
1 材料与方法
1.1 试验材料
试验选用的铜绿微囊藻(Microcystis aeruginosa NIES-843)来自于日本国立环境研究所。藻株用CT完全培养基培养, 培养条件为光强30 μmol protons/(m2×s), 温度(25±1)℃, 光周期12h︰12h (L︰D)。白屈菜红碱(Chelerythrine)购自Sigma公司。
1.2 白屈菜红碱抑藻试验
用二甲基亚砜配制10、20、40、80、160、320 μg/mL的白屈菜红碱母液。实验在250 mL的三角瓶中进行,取各浓度的母液100 μL加入到无菌的CT培养基中, 另取100 μL二甲基亚砜做空白, 再向其中加入用CT培养的处于对数生长期的M. aeruginosa NIES-843, 终体积为100 mL, 白屈菜红碱最终浓度为0、10、20、40、80、160、320 μg/L, M. aeruginosa NIES-843起始OD680值为0.090。所有处理均置于光强30 μmol protons/(m2×s),温度(25±1)℃, 光周期12h︰12h(L︰D)条件下培养,在实验的第2、第4、第6天取样。藻细胞密度用血球计数板在显微镜下计数。藻细胞叶绿素和类胡萝卜素用80%丙酮提取测定, 测定藻细胞OD450、OD645、OD663吸光值, 按照以下关系式计算: 叶绿素浓度Ca=12.72×A663—2.7×A645; 类 胡 萝 卜 素 浓 度 Cx.c=4.1×A450—0.0435×Ca[11—12]。M. aeruginosa NIES-843叶绿素光诱导荧光多相瞬态上升动力学用Handy-PEA (Handy-Plant Efficiency Analyser, Hansatech Instruments, UK)测定, 荧光测定前所有样品暗适应15min, 光化光强度为3000 μmol potons/(m2×s), 荧光瞬时上升曲线的记录时间为50 μs—1 s, 采样速率在前2 ms之内是105次/s,2 ms之后为103次/s[6]。
1.3 叶绿素荧光多相瞬态上升动力学参数分析
根据 Strasser和 Strasser[8]的能量流动模型, 分析 PSⅡ单位反应中心能量流动比活性能参数(ABS/RC、TR0/RC、ET0/RC)和 PSⅡ能量分配比率参数(ψ0、j P0、j E0)。各参数具体含义如表 1 所示[13]。
1.4 数据统计分析
实验数据用SPSS 13.1进行线性回归分析和单因素方差分析(One-Way ANOVA, LSD), P小于0.05被认为具有显著差异。

表1 叶绿素荧光多相瞬态上升动力学参数Tab. 1 Parameters derived from polyphasic rise in chlorophyll fluorescence transients
2 结果
2.1 白屈菜红碱对M. aeruginosa NIES-843生长的影响
图 1显示了白屈菜红碱胁迫下 M. aeruginosa NIES-843在第2和第6天细胞数变化情况。在白屈菜红碱胁迫的第 2天, 当浓度为 10 μg/L时, M.aeruginosa NIES-843的生长即受到显著抑制。随着白屈菜红碱浓度增加, M. aeruginosa NIES-843生长被抑制的现象也愈加严重。到第6天, 10—80 μg/L白屈菜红碱胁迫处理组的细胞数还是显著低于对照,但是10—80 μg/L处理组间无明显差异。采用SPSS 13.1分析软件, 以白屈菜红碱的浓度的对数值为横坐标, 第2天白屈菜红碱的生长抑制率为纵坐标, 做回归分析和统计推断, 得到第 2天白屈菜红碱对 M.aeruginosa NIES-843 生长的EC50为(30.62±1.32) μg/L。
2.2 白屈菜红碱对M. aeruginosa NIES-843细胞色素含量的影响
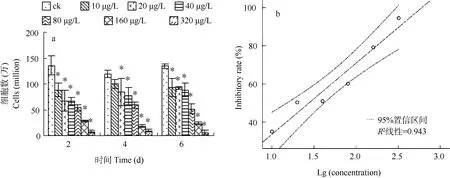
图1 白屈菜红碱胁迫对M. aeruginosa NIES-843细胞数(a)和生长抑制率-浓度回归分析(b)的影响“*”代表 P<0.05; 下同Fig.1 Effect of chelerythrine stress on the cells and growth inhibition rate of M. aeruginosa NIES -843 (a) and the regress analysis of inhibitory rae versus Lg (concentration) on day 2 (b) “*” is P<0.05; the same applies bellow

图2 白屈菜红碱胁迫对M. aeruginosa NIES -843单位细胞内Chl.a含量(a)和类胡萝卜素含量(b)的影响Fig. 2 Effect of chelerythrine stress on the cellular Chl. a contents (a) and cellular carotenoids contents (b) of M. aeruginosa NIES -843
图2分别显示了白屈菜红碱胁迫下M. aeruginosa NIES-843单位细胞内 Chl. a和类胡萝卜素含量在第2和第6 天的变化情况。单位细胞内Chl. a与类胡萝卜素含量变化的趋势基本相似。当白屈菜红碱浓度为10和20 μg/L时, M. aeruginosa NIES- 843单位细胞内Chl. a与类胡萝卜素含量在第2 与第6 天均显著高于对照。在40 μg/L时, M. aeruginosa NIES-843单位细胞内Chl. a含量在第2 和第6 天均显著高于对照,其类胡萝卜素含量只有在第2 天显著高于对照。当白屈菜红碱浓度为 80和 160 μg/L时, M. aeruginosa NIES-843单位细胞内Chl. a与类胡萝卜素含量都低于对照, 并且在160 μg/L时, M. aeruginosa NIES-843单位细胞内Chl. a含量显著低于对照, 在第6 天, 该浓度下其类胡萝卜素含量也显著低于对照。
2.3 白屈菜红碱胁迫下 M. aeruginosa NIES-843叶绿素光诱导荧光动力学特征
图 3分别显示了白屈菜红碱胁迫下 M. aeruginosa NIES-843 叶绿素光诱导荧光多项瞬态上升动力学特征在第2和第6 天的变化情况, 均呈典型的O-J-I-P特征。各个浓度处理的叶绿素光诱导荧光多项瞬态上升动力学曲线均有典型的 J、I、P三个波峰。在第 2天, 各个浓度处理下的 M. aeruginosa NIES-843 叶绿素光诱导荧光都低于对照, 10、20 μg/L处理的OJIP曲线基本重合。到了第6天, 这种趋势并没有什么变化, 并且随着浓度的升高, 低于对照的幅度越大。
2.4 白屈菜红碱对M. aeruginosa NIES-843 PSⅡ单位反应中心能量流动比活性能的影响
图4分别显示了白屈菜红碱胁迫下M. aeruginosa NIES-843 PSⅡ单位反应中心能量流动比活性能参数(ABS/RC、TR0/RC、ET0/RC)在第 2和第 6 天的变化情况。在白屈菜红碱胁迫后的第 2 天, 白屈菜红碱浓度为40 μg/L时, M. aeruginosa NIES-843 PSⅡABS/RC 值显著高于对照, 浓度为40、80 μg/L时,M. aeruginosa NIES-843 PSⅡET0/RC 值显著高于对照; 到了第 6 天, 白屈菜红碱浓度为 20 μg/L时TR0/RC、ET0/RC 值都显著低于对照, 白屈菜红碱浓度为80 μg/L时, ABS/RC、TR0/RC 值显著低于对照, 而ET0/RC 值却显著高于对照。

图3 白屈菜红碱胁迫下M. aeruginosa NIES -843叶绿素光诱导荧光动力学特征 (a. 2d; b. 6d)Fig. 3 Chlorophyll fluorescence transients of M. aeruginosa NIES -843 under chelerythrine stress (a. 2d; b. 6d)
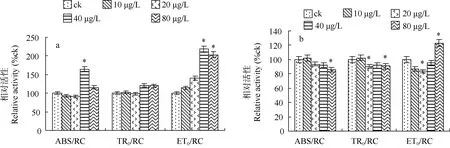
图4 白屈菜红碱胁迫对M. aeruginosa NIES -843 PSⅡ单位反应中心能量流动比活性能参数的影响(a: 2d; b: 6d)Fig. 4 Effect of chelerythrine stress on the parameters of energy fluxes per reaction centre of M. aeruginosa NIES -843 PSⅡ(a: 2d; b: 6d)

图5 白屈菜红碱胁迫对M. aeruginosa NIES -843 PSⅡ单位反应中心能量流动比活性能参数的影响Fig. 5 Effect of chelerythrine stress on the parameters of energy fluxes per reaction centre of M. aeruginosa NIES -843 PSⅡ
图 5显示了白屈菜红碱胁迫下 M. aeruginosa NIES-843 PSⅡ单位反应中心能量流动比活性能参数(RC/CS0)在第2和第6 天的变化情况。在白屈菜红碱胁迫后的第 2 天, 白屈菜红碱浓度为 40 μg/L时, M. aeruginosa NIES-843 PSⅡRC/CS0值显著低于对照; 到了第6 天, 白屈菜红碱浓度为40、80 μg/L时RC/CS0值都显著低于对照。
2.5 白屈菜红碱对M.aeruginosa NIES-843 PSⅡ能
量流动分配比率的影响
图 6分别显示了白屈菜红碱胁迫下 M.aeruginosa NIES-843 PSⅡ能量分配比率参数(ψ0、j P0、j E0)在第 2 和第 6 天的变化情况。第 2 天, 在白屈菜红碱浓度为40 μg/L时, ψ0值显著高于对照,而j P0值显著低于对照, 在白屈菜红碱浓度为 10、20 μg/L时, j E0值显著高于对照; 到了第6天, 在白屈菜红碱浓度为 80 μg/L 时, ψ0、j P0、j E0值均显著高于对照。
3 讨论
通过线性回归分析, 在第 2天白屈菜红碱胁迫M. aeruginosa NIES-843生长的EC50为(30.62±1.32) μg/L。而几种典型的生物源抑藻物质如连苯三酚(Pyrogallol) EC50为 650 μg/L, 壬酸(Nonanoic acid)EC50为 500 μg/L, 2-甲基乙酰乙酸乙酯 EC50为650 μg/L[14,15]。由此可见, 白屈菜红碱是一种抑藻效应极强的生物源物质。
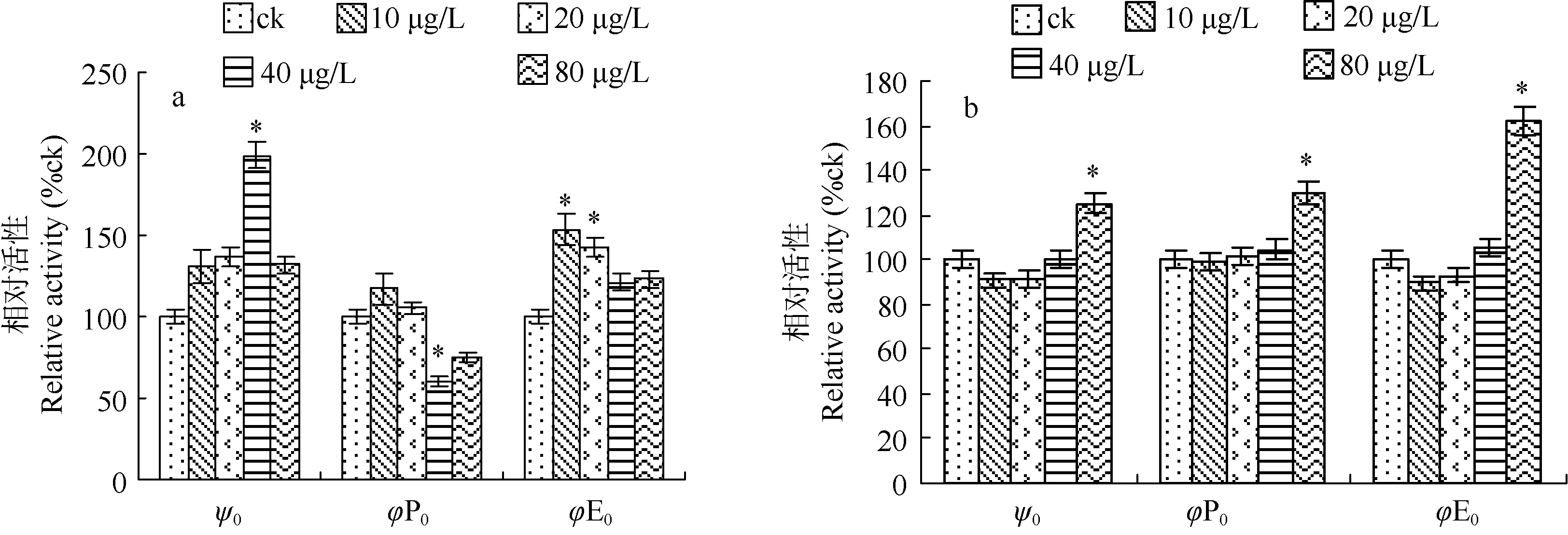
图6 白屈菜红碱胁迫对M. aeruginosa NIES -843 PSⅡ能量分配比率参数的影响(a: 2d; b: 6d)Fig. 6 Effect of Chelerythrine stress on the parameters of flux ratios of M. aeruginosa NIES -843 PSⅡ(a: 2d; b: 6d)
研究表明藻类和植物PSⅡ对环境胁迫很敏感,叶绿素荧光不仅能反映光能吸收、激发能传递和光化学反应等光合作用的原初反应过程, 而且与电子传递、质子梯度的建立及ATP的合成和CO2固定等过程有关。由于叶绿素光诱导荧光对环境胁迫响应非常灵敏, 所以叶绿素光诱导荧光动力学现在已被广泛应用于植物和蓝藻对环境胁迫的响应[14]。
根据Strasser和Strasser的能量流动模型图, j P0可以反应 PSⅡ反应中心电子供体侧的电子传递性能。在白屈菜红碱胁迫的第二天, 当其浓度为40 μg/L时, j P0值显著低于对照, j P0综合了 ABS/RC 和TR0/RC 两个指标, 即(TR0/RC)/(ABS/RC)。从图 3可以看出, 当白屈菜红碱浓度为 40 μg/L时,ABS/RC值显著升高, 而TR0/RC值却变化不大, 这说明此时单位反应中心吸收的光能显著增加, 而单位反应中心捕获的用于还原 QA的能量却没有很大变化, 由此我们可以推测, 微囊藻光合系统反应中心电子供体侧电子为白屈菜红碱作用的把位点之一。RC/CS0可以反应PSⅡ反应中心的状态, 从图5可以看出白屈菜红碱胁迫导致了 RC/CS0的降低, 这说明PSⅡ反应中心也是白屈菜红碱作用的把位点之一。ψ0可以反应 PSⅡ反应中心电子受体侧的性能, 代表了光和系统电子传递超过 QA的概率。实验结果显示,在第2天, 在白屈菜红碱各个处理浓度下ψ0值均高于对照, 并在20、40 μg/L时显著高于对照。这一升高现象可能是因为M. aeruginosa NIES-843受到胁迫后需要更多的生物能来对抗胁迫, 而微囊藻 PSⅡ反应中心电子供体侧受到损伤, 导致 PSⅡ反应中心电子受体侧处于过氧化状态, 进而引起ψ0值升高。
