DHA合成途径中关键酶基因在毕赤酵母中的表达研究
2015-11-05李松岩徐摇光张晓东
李松岩, 徐摇光, 张晓东*
1.首都师范大学生命科学院,北京 100037;
2.北京市农林科学院北京农业生物技术研究中心,北京 100097
二十二碳六烯酸(DHA)是一种ω3系列的多不饱和脂肪酸,对人体健康有着十分重要的作用。DHA是神经系统细胞生长及维持的一种重要元素,是大脑和视网膜的重要组成成分,对胎儿及婴儿的智力和视力发育至关重要,因此又被称为“脑黄金”[1]。DHA同时也是一种全世界比较稀缺的资源。它在人体内参与磷脂的合成,是构成人体组织细胞的成分,对增强记忆力、保护视力有显著作用,对婴幼儿及青少年的生长发育有重要作用,同时有减弱炎症,调节免疫,改善老年痴呆、精神分裂症、抗过敏和衰老等多种功能,对降低血脂和防治心脑血管疾病也有作用[2,3]。
毕赤酵母表达系统是近年来建立起来的一种真核表达系统,已成功地表达了大量的分泌蛋白[4],它既具有原核表达系统繁殖快、操作简单的优点,同时又具有原核表达系统所没有的优势:如能对表达的目的蛋白进行正确加工、折叠及适度糖基化,分泌表达的杂蛋白少、易于分离纯化等,因此越来越广泛地用于分泌蛋白的表达。本实验克隆了来源于深海藻类基因组的5个DHA合成相关基因,并通过密码子优化,为了验证优化后序列是否能在真核细胞中正确表达,利用毕赤酵母表达这些蛋白,以克服用E.coli表达可能遇到的表达量低、难以纯化的问题,从而进一步验证其功能。本研究为后续DHA合成关键酶基因在禾谷类高等植物的高效稳定表达奠定了可靠的基础。
1 材料与方法
1.1 菌株与质粒
大肠杆菌菌株(E.coli)DH5α、巴斯德毕赤酵母(Pichia pastors)GS115(His-Mut+)菌株和分泌型表达载体pPIC9K,均由本实验室保存;带有目的基因的质粒由人工合成。
1.2 酶与试剂
Taq DNA聚合酶、PET-30A载体、T4 DNA连接酶、脱氧核苷三磷酸(dNTP)、去磷酸化酶、DNA Marker购自TaKaRa公司;限制性内切酶EcoRI、XhoI、NotI购于NEB公司;DNA回收试剂盒、质粒提取试剂盒购于上海捷瑞生物公司;彩色预染蛋白质分子量标准购于北京康润生物公司;基因与PCR引物合成、重组子的测序由北京博迈德生物公司完成;tryptone、yeast extract、酵母氮基(含硫酸铵/无氨基酸yeast nitrogen base)、D-生物素、D-山梨醇 (D-sorbitol)、SDS、TEMED、N,N-甲叉双丙烯酰等试剂购于北京鼎国生物公司,预染蛋白Marker购于New England Biolabs公司。
培养基:大肠杆菌培养基为LB培养基;酵母培养基为 YPD、RDB、BMGY、BMMY 培养基,配方参照Invitrogen公司毕赤酵母操作手册。
1.3 方法
1.3.1 合成DHA途径中相关酶基因的克隆 高等作物自身不能合成DHA,但大多可以合成亚麻酸,由亚麻酸到DHA需要5种酶,分别是Δ4脱饱和酶(D4)、Δ5脱饱和酶(D5)、Δ6脱饱和酶(D6)、C18延长酶(E18)和 C20延伸酶(E20)(图 1)。根据已发表的文章或专利[5~12],通过比较这些基因的生物来源及酶活性等,最后选择来自Eutreptiellacf gymnastica的Δ4脱饱和酶基因、来自Peridinium sp.CCMP626的Δ5脱饱和酶基因、来自Phaeodactylum tricornutum的Δ6脱饱和酶基因、来自Traustochytrium aureum的C18延长酶基因和来自Euglena gracilis的C20延长酶基因作为基础,将这些基因序列通过GeneDesigner软件进行密码子优化,由上海捷瑞生物工程有限公司进行人工合成,并在 http://www.genscript.com/cgi-bin/tools/rare_codon_analysis上进行CAI分析,使之在玉米中高效表达。优化后的核苷酸序列进行人工合成,最后获得携带有目的基因的重组质粒pGH-D4/D5/D6E18/E20。
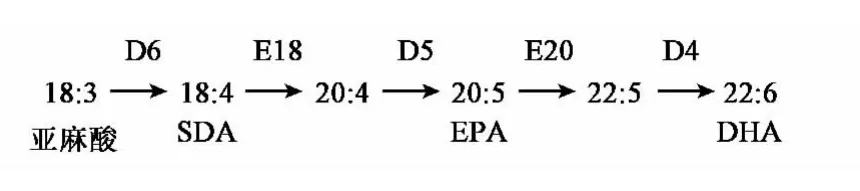
图1 DHA在藻类生物中的合成示意图 Fig.1 Diagrammatic sketch of DHA synthesis in microalgae.
1.3.2 重组表达质粒载体的构建 本实验所需要的载体构建方案如图2所示:以携带有目的基因的重组质粒pGH-D4/D5/D6/E18/E20为模板,用表1所示引物进行PCR扩增,去除终止密码子,同时引入EcoRI和XhoI两个酶切位点,产物连接T载体并测序正确后,用EcoRI和XhoI酶切,然后与pET-30a载体(XhoI位点后有His-Tag)相连,构建成pET-D4/D5/D6/E18/E20;再以HisR(表1)为反向引物(引物中加入 NotI位点),正向引物(D4F/D5F/D6F/E18F/E20F)不变进行扩增,得到D4his/D5his/D6his/E18his/E20his等片段;最后再通过EcoRI和NotI两个酶切位点构建到pPIC9K载体上。将这些质粒命名为pPIC9K-D4his、 pPIC9K-D5his、 pPIC9K-D6his、pPIC9K-E18his和 pPIC9K-E20his。
PCR反应所用试剂为 KOD-Plus-Neo酶(ToYoBo公司),PCR体系参照说明书。扩增反应的条件为:95℃预变性1 min;95℃变性10 s,58~62℃退火 10 s,72℃ 延伸 1 min,30 个循环;72℃延伸10 min。实验中所有引物均由上海生工生物有限公司合成。
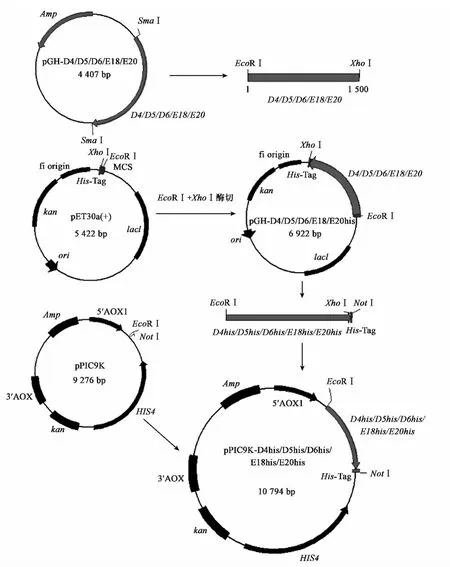
图2 pPIC9K-D4his/D5his/D6his/E18his/E20his载体构建示意图 Fig.2 Construction of pPIC9K-D4his/D5his/D6his/E18his/E20his vectors.
1.3.3 重组表达质粒载体的线性化及电击转化 将获得的重组载体质粒 pPIC9K-D4his、pPIC9K-D5his、pPIC9K-D6his、pPIC9K-E18his 和pPIC9K-E20his,分别用限制性内切酶SacI进行酶切线性化,37℃保温1 h,回收已被线性化的质粒,随后电击转化巴斯德毕赤酵母(毕赤酵母感受态准备、电击转化均参照Invitrogen公司毕赤酵母操作手册)。取80 μL新鲜制备的感受态酵母细胞与5 μg线性化的重组质粒混合,混匀后转移至0.2 cm预冷的电击杯中,冰浴5 min,电击转化(电击条件:2 000 V,25 μF,200Ω),电击完毕后,加入1 mL预冷的山梨醇溶液,将菌体混匀,转至新的EP管中;将菌体悬液涂布于RDB平板上,每200~600 μL涂布一块平板;将平板置于30℃培养,直至单个菌落出现。
1.3.4 筛选稳定表达的毕赤酵母重组质粒 将除了模板之外的其他PCR反应液的组分准备好,并分装。由于受体菌酵母GS115为组氨酸缺陷型(his),pPIC9k载体携带HIS4基因,所以只有线 性 化 pPIC9K-D4his、pPIC9K-D5his、pPIC9KD6his、pPIC9K-E18his和 pPIC9K-E20his片段整合到酵母基因组中才能在RDB平板上生长,因此在RDB平板上生长迅速的为阳性转化子。在组氨酸缺陷型培养基上进行筛选,平板上的菌落长到肉眼可见时(约12 h);用灭菌的牙签挑取菌落,在PCR管中涮一下,PCR扩增,电泳检测。

表1 DHA相关基因引物序列 Table 1 Primers of genes involved in DHA synthesis pathway.
1.3.5 重组毕赤酵母的培养与诱导表达 挑选一单菌落,接种于装有50 mL BMGY培养基的250 mL三角瓶中,于 28℃、230 r/min培养至OD600=2~6(约 24 h),4℃、4 000 r/min 离心5 min,收集菌体重悬于10 mL BMMY培养基,加入甲醇至终浓度0.5%,用双层纱布封口,放置于28℃、230 r/min的摇床上继续生长,每24 h向培养基中添加100%甲醇至终浓度为0.5%。分别在诱导后的2 d、3 d、4 d和5 d取样2 mL,置于EP管中,9 100 r/min、4℃离心 5 min,收集上清用于分析表达水平及确定诱导后收集细胞的最佳时间。
1.3.6 表达产物的浓缩处理SDS-PAGE及蛋白定量 三氯乙酸(TCA)沉淀法将表达上清液浓缩10倍:10 mL表达上清液中加入1 mL 100%三氯乙酸,振荡混匀,放入4℃冰箱沉淀2~3 h,12 000 g离心15 min,去上清,再用10%三氯乙酸洗涤沉淀2~3遍,最大转速离心,倒掉洗涤液,晾干沉淀,经分离胶浓度11%,浓缩胶浓度5%,用考马斯亮蓝R-250染色,在电泳过程中,浓缩胶中恒流10 mA,分离胶中恒流 20 mA,样品上样量为20 mg/μL,预染蛋白 Marker上样量为 5 μL,根据电泳结果,利用微孔酶标仪对目的蛋白定量。
2 结果与分析
2.1 目的基因的克隆和重组表达载体构建
按照图1所示以pPIC9K为基础载体构建在毕赤酵母中表达的载体,目的基因的克隆和最终载体的鉴定如图3所示。经过测序鉴定,显示结果与预期相符。
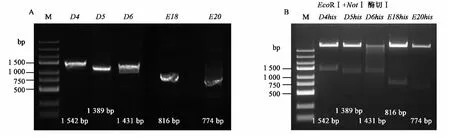
图3 酵母表达载体pPIC9K-D4his/D5his/D6his/E18his/E20his的构建 Fig.3 Construction of pPIC9K-D4his/D5his/D6his/E18his/E20his vectors expressed in Pichia pastoris.
2.2 重组表达载体质粒的线性化及筛选
重组质粒pPIC9K-D4his、pPIC9K-D5his、pPIC9K-D6his、pPIC9K-E18his 和 pPIC9K-E20his经SacI线性化后,通过电激转化至巴斯德毕赤酵母GS115中,在RDB平板上筛选转化子。挑取上述甲醇利用型(Mut+)酵母转化子经PCR鉴定,结果见图4。
2.3 重组酵母菌蛋白的诱导表达及上清液SDSPAGE检测鉴定
收集部分经甲醇诱导的pPIC9K-D4his诱导蛋白上清,经SDS-PAGE检测,发现在约75 kDa下方出现明显的新生蛋白带,由于以酶切连接转化方式整合到毕赤酵母染色体上的目的基因上游含有甲醇诱导型启动子AOX1,在培养基中只存在甲醇为碳源的情况下,能被诱导高效表达。而转化空载体pPIC9K(CK-)的酵母菌经诱导获得的上清液在相应位置未见蛋白带,可断定此处的蛋白带为pPIC9K-D4his重组酵母菌的特征带(图5A),其他位置的蛋白带应该为杂蛋白。
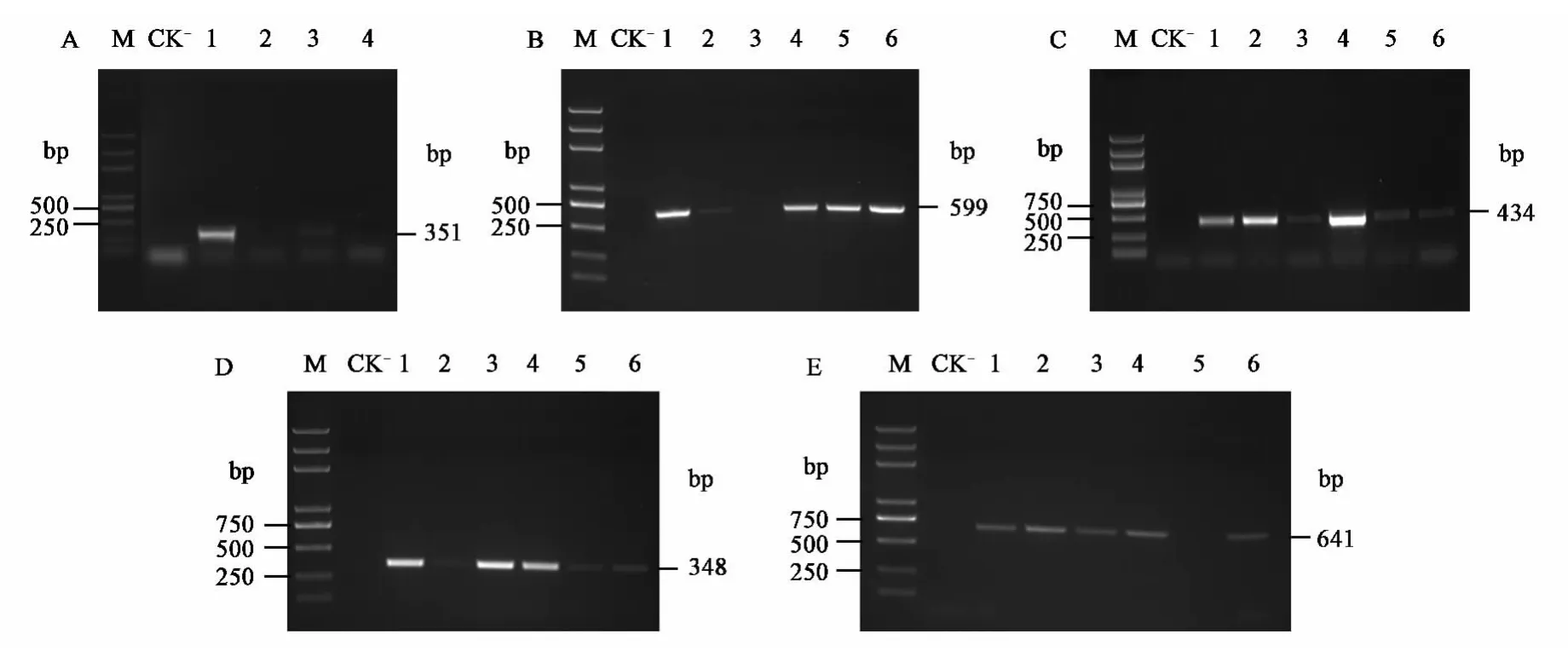
图4 PCR检测毕赤酵母重组子 Fig.4 PCR identification of yeast recombinants.
同上类似,收集部分经甲醇诱导的pPIC9KD5his、pPIC9K-D6his、pPIC9K-E18his 和 pPIC9KE20his诱导蛋白上清,经SDS-PAGE检测,发现分别在约70 kDa和35 kDa下方出现明显新生蛋白带(图5B~E),这些条带大小与预测的该目的蛋白的分子质量大小一致。
由上图5B可以看出,当培养至120 h时,酵母菌开始裂解死亡,同时游离出的蛋白酶可降解目的蛋白,在泳道3中弥散的蛋白条带明显增多,因此选择的最佳诱导时间为96 h。
由图5D可见,在72 h、96 h培养上清液中,在 25.0~35.0 kDa 之间,大约 30 kDa 的位置有蛋白带,而在对照组中未出现该条带,可判断此处表达蛋白带为E18his蛋白。虽然在72 h培养上清液中仍然存在30 kDa左右的条带,但考虑到该条带不如96 h的条带颜色深,因此选择的最佳诱导时间为96 h。
2.4 重组酵母菌蛋白诱导上清液Western Blot检测鉴定
通过上一步SDS-PAGE的初步验证,经甲醇诱导的 pPIC9K-D4his、pPIC9K-D5his、pPIC9KD6his、pPIC9K-E18his和 pPIC9K-E20his诱导蛋白上清均有目的条带出现,其中pPIC9K-D6his的目的条带效果强于另外几个样品的目的条带效果。因此对pPIC9K-D6his样品的不同诱导时间收集到的表达上清进行Western Blot检测。图6显示,除空载体对照外,pPIC9K-D6his的3 d、4 d样品在64 kDa处均有明显的杂交带,这一条带大小与预测的该分泌蛋白的分子质量大小一致。同时,随着诱导时间的增加,分泌蛋白的表达量有所升高。

图5 转化载体酵母表达蛋白的SDS-PAGE检测 Fig.5 SDS-PAGE analysis of proteins from transgenic yeasts with vectors.
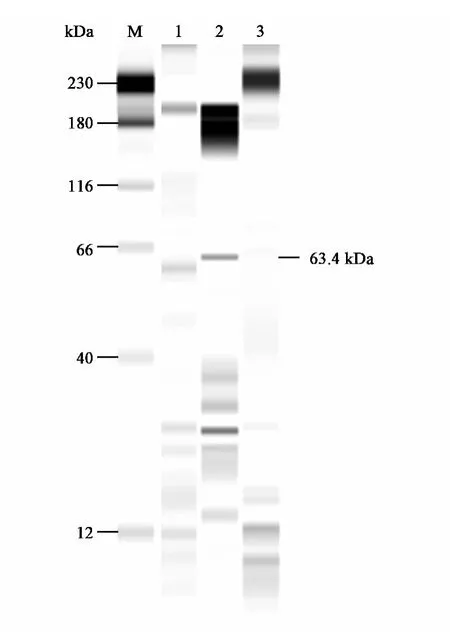
图6 D6his重组酵母分泌蛋白的Western Blot分析 Fig.6 Western Blot analysis of recombinant protein with D6his protein.
3 讨论
本研究采用的毕赤酵母表达系统是利用甲醇作为唯一碳源和能源,能稳定表达外源蛋白的一种较为理想的真核蛋白表达系统,使用该表达系统,具有实验结果稳定、可靠、表达蛋白水平高,且不易被污染等特点[13]。本实验所用的巴斯德毕赤酵母GS115菌株作为一种新型外源基因表达系统,该表达系统受由甲醇调控的AOXl基因强启动子启动,能对外源蛋白进行加工、折叠、翻译后修饰,并将其分泌到培养基中,分泌的外源蛋白不会过度糖基化,毕赤酵母自身产生的分泌蛋白很少,使外源蛋白的分离纯化较为简便,正因为有这些优点,该表达系统已被广泛应用。
由已有报道得知,毕赤酵母表达外源蛋白的适宜温度为28~30℃,在此温度范围毕赤酵母细胞生长速度最快,理论上外源蛋白的表达量与菌体密度呈正相关[14]。一些文献资料记载,毕赤酵母在较低温度下有利于外源蛋白的表达,可能是外源蛋白在较高温度下的稳定性下降,不利于蛋白质折叠,也可能是死细胞释放更多的蛋白酶降解外源蛋白[15]。毕赤酵母pH生长范围一般在3.0~7.0,pH 通过影响蛋白酶活性,改变蛋白酶对外源蛋白的降解作用,来影响外源蛋白的表达量和活性[16]。毕赤酵母利用甲醇表达外源蛋白时需要消耗大量的氧气,溶氧不足会抑制菌体繁殖和外源蛋白的表达,保证其通气量充足[17]。甲醇是酵母表达的诱导物和唯一碳源,在甲醇诱导期间,由于甲醇的消耗和挥发,应及时向培养基中连续补加甲醇。但是甲醇浓度太高会对毕赤酵母细胞产生毒害,浓度太低则诱导表达的外源蛋白太少,一般甲醇的添加量为培养基体积的0.5%~1.0%为宜[18]。甲醇诱导时间也会影响外源基因的表达量,诱导时间太短则表达的外源蛋白量少,诱导时间太长外源蛋白容易被蛋白酶降解,外源蛋白的表达量少,因此要选择最合适的诱导时间。通过对筛选出的阳性菌株进行诱导培养基、pH、培养时间和甲醇浓度等条件的优化,以得到三角瓶内诱导的最佳表达产物,为之后的表达产物活性分析奠定条件[19~22]。
本实验在设计上根据酵母系统中分泌型表达载体pPIC9K的多克隆位点,设计了与其相应的一对引物,并在其上游引物部分引入EcoRI位点,下游引物部分引入NotI位点,将合成DHA途径中的相关酶基因克隆至载体pPIC9K中,经测序分析正确,用限制性内切酶SacI酶切质粒DNA线性化,电击转化法酵母宿主菌GS115,筛选到阳性的转化子,进一步鉴定得到甲醇利用型(Mut+)转化子,提取酵母菌转化子DNA用PCR法鉴定,结果证明目的基因已经稳定地整合到毕赤酵母GS115染色体基因组中,收集部分经甲醇诱导的蛋白上清,经SDS-PAGE及Western Blot检测,这些条带大小与预测的目的蛋白的分子质量大小一致,最佳诱导时间为96 h。
在此研究基础上,我们拟将这些来自海洋微藻的DHA合成相关基因,包括Δ4、Δ5、Δ6脱饱和酶基因和C18、C20延伸酶基因分别转入玉米基因组中,再通过杂交等遗传育种方式最终获得可合成DHA的转基因玉米,改良玉米油的品质,提升玉米油的保健功能价值,扩大玉米油在食品加工与保健食品等方面的应用。
[1]郑秋甫.Omega-3多不饱和脂肪酸的研究进展[J].中华保健医学杂志,2011,13(5):357-360.
[2]Pereira S L,Vandana P,Tripathi C K M,et al..Identification of two novel microalgal enzymes involved in the conversion of the omega3-fatty acid,eicosapentaenoic acid,into docosahexaenoic acid[J].Biochem.J.,2004,384(2):357-366.
[3]Qiu X,Hong H,MacKenzie S L.Identification of a Delta 4 fatty acid desaturase from Thraustochytrium sp.involved in the biosynthesis of docosahexanoic acid by heterologous expression in Saccharomyces cerevisiae and Brassica juncea[J].J.Biol.Chem.,2001,276(34):31561-31566.
[4]李晓莉.玉米油,新一代的“长寿油”[J].家庭医药,2012,2:83.
[5]Lu H,Li M,Ma H,et al..Identification and characterization of a novel delta6-fatty acid desaturase gene from Rhizopus nigricans[J].Mol.Biol.Rep.,2009,36(8):2291-2297.
[6]Wan X,Zhang Y B,Wang P,et al.Molecular cloning and expression analysis of a delta 6-fatty acid desaturase gene from Rhizopus stolonifer strain YF6 which can accumulate high levels of gamma-linolenic acid[J].J.Microbiol.,2011,49(1):151-154.
[7]Bowler C, Allan A E , BadgerJH , et al..The Phaeodactylum genome reveals the evolutionary history of diatom genomes[J].Nature,2008,456(7219):239-244.
[8]Cho H P,Nakamura M,Clarke S D.Cloning,expression,and fatty acid regulation of the human delta-5 desaturase[J].J.Biol.Chem.,1999,274(52):37335-37339.
[9]Leonard A E,Bruce K,Emil G B,et al.cDNA cloning and characterization of human Delta5-desaturase involved in the biosynthesis of arachidonic acid[J].Biochem.J.,2000,347(3):719-724.
[10] Zolfaghari R,Cifelli C J,Banta M D,et al..Fatty acid delta(5)-desaturase mRNA is regulated by dietary vitamin A and exogenous retinoic acid in liver of adult rats[J].Arch.Biochem.Biophys.,2001,391(1):8-15.
[11] Hong H,Datla N,MacKenzie S L,et al..Isolation and characterization of a delta5 FA desaturase from Pythium irregulare by heterologous expression in Saccharomyces cerevisiae and oilseed crops[J].Lipids,2002,37(9):863-868.
[12] Saito T,Morio T,Ochiai H.A second functional delta5 fatty acid desaturase in the cellular slime mould Dictyostelium discoideum[J].Eur.J.Biochem.,2000,267(6):1813-1818.
[13] Shen B,William B A,Zheng P Z ,et al..Expression of Zm-LEC1 and ZmWRI1 increases seed oil production in maize[J].Plant Physiol.,2010,153(3):980-987.
[14]郝希成,汪丽萍,张蕊.玉米油脂肪酸成分标准物质的研制[J].粮食储藏,2011,40(1):41-44.
[15] Yang X,Guo Y Q ,Yan J B,et al.Major and minor QTL and epistasis contribute to fatty acid compositions and oil concentration in high-oil maize[J].Theor.Appl.Genet.,2010,120(3):665-678.
[16] Domergue F,Jens L,Ulrich Z,et al..Cloning and functional characterization of Phaeodactylum tricornutum front-end desaturases involved in eicosapentaenoic acid biosynthesis[J].Eur.J.Biochem.,2002,269(16):4105-4113.
[17] Girke T,Hermann S,Ulrich Z,et al..Identification of a novel delta 6-acyl-group desaturase by targeted gene disruption in Physcomitrella patens[J].Plant J.,1998,15(1):39-48.
[18] Kajikawa M,Yamato K T,Kohzu Y,et al..Isolation and characterization of delta(6)-desaturase,an ELO-like enzyme and delta(5)-desaturase from the liverwort Marchantia polymorpha and production of arachidonic and eicosapentaenoic acids in the methylotrophic yeast Pichia pastoris[J].Plant Mol.Biol.,2004,54(3):335-352.
[19] Meyer A,Petra C,Claudia O,et al..Biosynthesis of docosahexaenoic acid in Euglena gracilis:biochemical and molecular evidence for the involvement of a Delta4-fatty acyl group desat-urase[J].Biochemistry,2003,42(32):9779-9788.
[20] Rogers M B,Hilley J D,Dickens N J,et al..Chromosome and gene copy number variation allow major structural change between species and strains of Leishmania [J].Genome Res.,2011,21(12):2129-2142.
[21] Tonon T,Harvey D,Larson T R,et al..Identification of a very long chain polyunsaturated fatty acid Delta4-desaturase from the microalga Pavlova lutheri[J].FEBS Lett.,2003,553(3):440-444.
[22] Li Y,Monroig O,Zhang L,et al..Vertebrate fatty acyl desaturase with Delta4 activity[J].Proc.Natl.Acad.Sci.USA,2010,107(39):16840-16845.
