单宁酸对三种天然色素辅色作用的评价
2015-11-05李小定华中农业大学食品科技学院环境食品学教育部重点实验室湖北武汉430070
刘 松,李小定,姜 红,李 杰(华中农业大学食品科技学院,环境食品学教育部重点实验室,湖北武汉430070)
单宁酸对三种天然色素辅色作用的评价
刘松,李小定*,姜红,李杰
(华中农业大学食品科技学院,环境食品学教育部重点实验室,湖北武汉430070)
本文运用紫外-分光光度计法和CIELab法评价单宁酸对甘蓝红色素、黑米色素和红树莓色素三种天然色素的辅色作用。结果表明,随着辅色剂浓度的增加,红树莓色素和黑米色素最大吸收波长发生红移,总色差逐渐变大,而甘蓝红色素的总色差也逐渐变大,但最大吸收波长未发生移动。在pH2.0~6.0的范围内,随着缓冲溶液的pH变化,加入辅色剂后,体系的亮度、彩度和色相都发生变化,且亮度对于总色差变化的相对贡献率最大。在单宁酸的辅色过程中pH=4时,甘蓝红色素和红树莓色素总色差的变化最明显;黑米色素则在pH=3和5时变化明显。
天然色素,辅色,总色差,单宁酸
花色苷是一类在自然界中分布最为广泛的水溶性色素,大量存在于水果、蔬菜、花、叶、种子、根、块茎等植物组织器官中,具有C6-C3-C6碳骨架结构,为羟基和甲氧基化的2-苯基-苯并吡喃阳离子与1个或多个糖分子通过糖苷键结合而成的一类化合物。花色苷色素是食用色素中应用普遍的一类色素。花色苷在溶于水后,存在盐离子、醌基、假碱、査尔酮四种互变体而使花色苷所呈现出的颜色易受理化性质改变的影响,尤其是溶液pH的变化[1-2]。为了维持花色苷的稳定性,通常利用辅色[3-4]、结构修饰[5]和微胶囊化技术[6]等手段,其中辅色法通过添加氨基酸、有机酸、生物碱、肉桂酸衍生物等辅色剂来提高稳定性,相对于其他方法更加实用、简便和经济[7]。
辅色是维持天然花色苷稳定性最有效和最常见的方法之一,因为通过辅色手段可以得到稳定的目标颜色。目前文献中所见的辅色作用研究均选取某一花色苷纯品或某一富含花色苷的植物提取物为研究对象,辅色剂则以多酚和有机酸为主,辅色效应评价方法有分光光度法、CIELab法及辅色后进行热稳定性研究。Malaj等采用分光光度法研究了对香豆酸、香草酸和丁香酸对锦葵色素3-葡萄糖苷的辅色效应,这些有机酸能显著增强花色苷色素溶液的颜色强度和稳定性[8]。评价辅色效果方法最常见的是紫外-可见分光光度计法,这种方法虽然简便快捷,但并不能准确全面的揭示颜色变化的程度。有时候发生了增色和红移效应,但是溶液颜色却是变蓝,因此单一波长下的变化不能完全解释颜色的变化。借用色彩方法学中的CIELab法来对颜色的变化进行定性和定量的分析,从亮度、彩度和色相三个方面的变化对辅色过程中颜色的变化进行全面的分析[9]。因此,本实验室选取了市场上比较常见的三种天然色素和常见的辅色剂单宁酸,通过光谱法和CIELab色彩空间法对单宁酸与三种色素的辅色作用进行评价,以便为研究辅色作用中的颜色变化提供理论依据。
1 材料与方法
1.1材料与仪器
甘蓝红色素湖北紫鑫生物科技有限公司提供;红树莓色素大兴安岭嘉迪欧营养原料有限公司提供;黑米色素西安裕华生物科技有限公司提供;单宁酸、柠檬酸、磷酸二氢钠、醋酸和醋酸钠分析纯。
UV-1750型紫外-可见分光光度计日本岛津公司;FE20 pH计梅特勒-托利多仪器有限公司;ZE6000色差计日本电色工业株式会社;液质联用仪美国安捷伦仪器有限公司。
1.2实验方法
1.2.1花色苷种类与含量测定pH示差法[10]分别测定红树莓色素、甘蓝红色素和黑米色素溶液的花色苷含量,LC-MS分析[11-13]红树莓色素、甘蓝红色素和黑米色素主要含有的花色苷单体。
1.2.2不同摩尔比的单宁酸对三种天然色素的辅色效果称取一定量的色素溶于pH=4.0的醋酸-醋酸钠缓冲溶液中,使最终的花色苷浓度为2.5×10-4mol/L(相对分子质量以含有主要的花色苷单体计)。然后分别取1 mL加入到1 mL醋酸-醋酸钠缓冲溶液配制的单宁酸溶液(浓度分别为2.5×10-4、12.5×10-4、25× 10-4、50×10-4、100×10-4mol/L)中混合,使花色苷与单宁酸的摩尔比分别为1∶1、1∶5、1∶10、1∶20、1∶40,将混合溶液稀释10倍后,暗置2 h,在380~770 nm处进行波长扫描并用色差计测定记录L、a、b值。以不添加辅色剂的色素溶液作为空白[14]。
1.2.3不同pH的缓冲溶液中单宁酸对三种天然色素辅色效果的影响配制pH为2.0、3.0、4.0、5.0、6.0的柠檬酸-磷酸二氢钠缓冲溶液,分别用不同pH的缓冲溶液溶解色素溶液,所得溶液的花色苷浓度为2.5×10-4mol/L,取1mL不同pH柠檬酸-磷酸二氢钠缓冲溶液配制的色素溶液加入到1 mL不同pH柠檬酸-磷酸二氢钠缓冲溶液配制的单宁酸溶液(浓度为12.5×10-4mol/L)中,使辅色剂单宁酸与花色苷的摩尔比为1∶5,混合溶液稀释10倍后,暗置2 h,紫外-可见分光光度计在380~770 nm处进行波长扫描并用色差计记录L、a、b值。以不添加辅色剂的色素溶液作为空白,每个样品溶液取三次平行。
1.2.4颜色分析[15]在得到L、a、b值时,需要对其颜色变化进行概述,因此通过ΔE(总色差)的变化来定性和定量的研究辅色过程的颜色变化,计算公式如下。

其中,LC:辅色剂与色素混合溶液的亮度值;L0:无辅色剂的色素溶液亮度值;aC:辅色剂与色素混合溶液的红黄程度表示值;a0:无辅色剂的色素溶液红黄程度表示值;bC:辅色剂与色素混合溶液的蓝绿程度表示值;b0:无辅色剂的色素溶液蓝绿程度表示值。
另外,通过计算ΔL(亮度)、ΔC(彩度)、ΔH(色相)来评价辅色过程中,ΔL、ΔC、ΔH对总色差变化的相对贡献率,分别表示为A、B、C,计算公式如下。
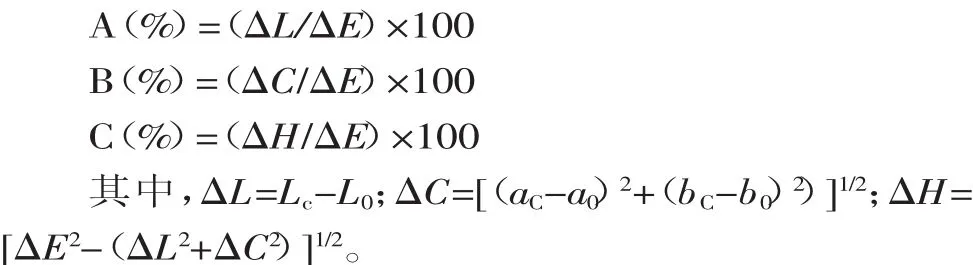
1.2.5统计与分析实验操作重复三次,采用SPSS 19.0软件进行多重比较分析。
2 结果与分析
2.1三种色素中花色苷种类与含量测定
经pH示差法测定红树莓色素、甘蓝红色素和黑米色素溶液的花色苷含量为26.36%、12.30%和23.9%。经HPLC-MS分析红树莓色素、甘蓝红色素和黑米色素主要含有的花色苷单体分别为矢车菊-3-葡萄糖苷、矢车菊色素-3-香豆酸酰化槐糖-5-葡萄糖苷和矢车菊-3-葡萄糖苷。
2.2单宁酸的摩尔比对辅色效果的影响
2.2.1紫外-可见光谱分析结合图1和表1可知,以不加单宁酸的色素溶液为空白对照,当花色苷与单宁酸摩尔比为1∶1时,黑米色素组的吸光度与空白组相比差异显著(p<0.05),甘蓝红色素组和红树莓色素组与空白组相比差异不显著;当摩尔比≥1∶5时,同一色素各组不同摩尔比之间差异显著(p<0.05),说明单宁酸对三种色素产生了辅色效应,但在低的花色苷与单宁酸摩尔比时,辅色效果不明显,摩尔比增大辅色效果增强,且摩尔比为1∶40的时候辅色效果最明显。并且从表1中可以看出,摩尔比从1∶0到1∶40变化时,黑米色素的最大吸收波长从519 nm迁移到526 nm,红树莓色素的最大吸收波长从518 nm迁移到525 nm,都发生了红移,而甘蓝红色素的最大吸收波长未发生迁移。
2.2.2颜色分析从表2中可知,以不加单宁酸的色素溶液为空白对照,三种色素的L值随摩尔比的增大逐渐减小,差异显著(p<0.05)。a和b值均增大,差异不显著。甘蓝红色素a值随摩尔比增加而增大,但差异不显著。黑米色素在摩尔比1∶0和1∶1时,a值差异不显著;摩尔比为1∶1和1∶5时,a值差异不显著;摩尔比为1∶5~1∶40时,a值差异不显著。红树莓色素在摩尔比>1∶5时,a值差异显著(p<0.05);摩尔比<1∶5时,差异不显著。b值随摩尔比增大而增大,甘蓝红色素在1∶40时,与其他摩尔比相比,b值差异显著(p<0.05)。黑米色素在1∶40时与其他摩尔比相比,b值差异显著(p<0.05);其余摩尔比之间,b值差异不显著。红树莓色素在1∶40时与其他摩尔比相比,b值差异显著(p<0.05),其余摩尔比之间差异不显著。说明体系颜色在亮度方面变化明显,而彩度有变化,但不明显。在辅色作用发生时,黑米色素和红树莓色素与单宁酸体系的L、a、b值的变化幅度要大于甘蓝红色素与单宁酸体系的变化。与紫外扫描图谱得到的结论一致。三种色素在浓度等其他条件都相同时,黑米色素和红树莓色素的颜色更为相近,甘蓝红色素的颜色则呈现偏暗、偏红、偏蓝。
为了更全面的分析单宁酸对三种色素的辅色作用的颜色变化,计算了各溶液的总色差、亮度、彩度、色相,然后分析了其变化。结果如图2、图3所示。

表1 三种色素加入不同摩尔比的单宁酸辅色时的最大吸收波长和吸光度Table 1 The λmax and absorption of different pigments when added with different molar ratio of tannin acid

图1 三种色素加入不同摩尔比的单宁酸辅色时的紫外扫描图Fig.1 The UV-vis of three pigments when added with different molar ratio of tannin acid

表2 三种色素加入不同摩尔比的单宁酸辅色辅色时的L、a、b值Table 2 The CIELab difference of different pigments in different molar ratio of tannin acid
由图2可知,三种色素总色差的变化与单宁酸的摩尔比有关系,摩尔比越大,总色差越大,在摩尔比为1∶40三种色素都达到最大总色差值。在低摩尔比时,三种色素之间的总色差差异不显著,在摩尔比增大到≥1∶20时,红树莓色素和黑米色素总色差差异不显著,但两者与甘蓝红色素的总色差差异显著(p<0.05)。图3表示的是三种色素的总色差中亮度、彩度和色相的相对贡献率。红树莓色素与单宁酸的辅色作用中,亮度是对总色差影响最大的因素,说明有明显的明暗变化,其次是彩度,辅色剂浓度增加,彩度相对贡献率变大,而色相的贡献率变化不稳定。甘蓝红色素与单宁酸的辅色作用中,色相对总色差的相对贡献率较小,而彩度对总色差的相对贡献率较大,亮度次之。这也很好的解释了在紫外可见扫描光谱图中,甘蓝红色素与单宁酸的辅色未发生明显的红移和蓝移,但是仍判定有辅色的效果。黑米色素与单宁酸的辅色过程中,色相对总色差相对贡献率相较于另外两色素明显增加,但主要的仍然是亮度的变化,彩度变化的相对贡献率则相对较小。

图2 不同摩尔比的单宁酸与色素体系的总色差变化Fig.2 The changes of total color in the magnitude of copigmentation of pigments with different molar ratio of tannin acid
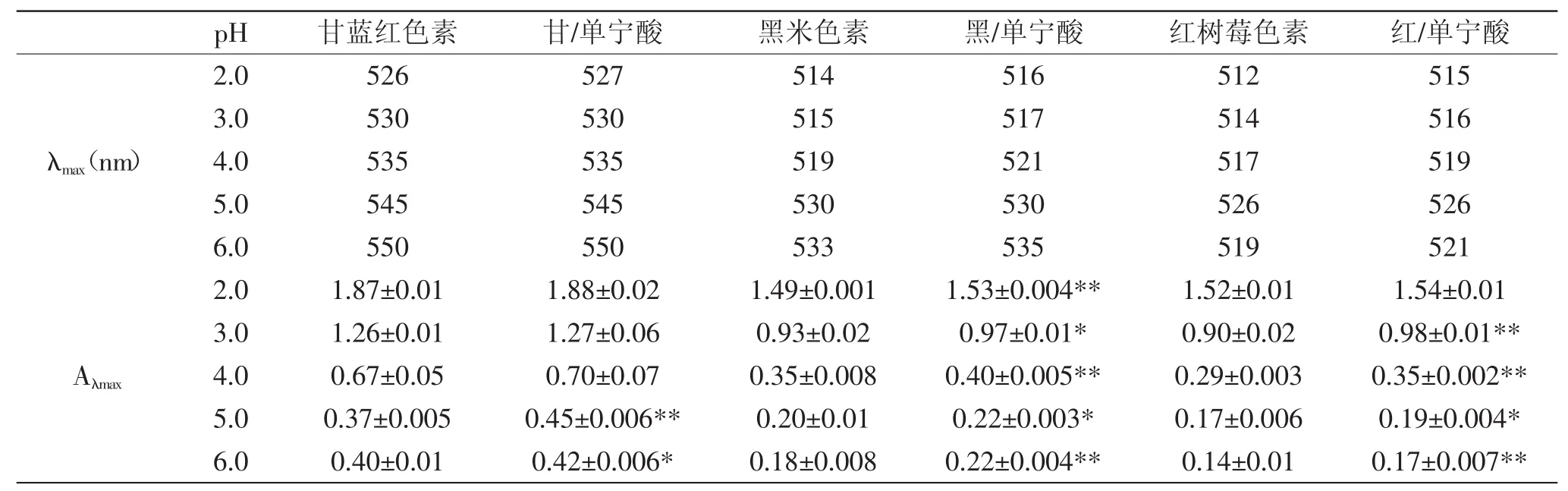
表3 pH对加入单宁酸色素体系的最大吸收波长和吸光度的影响Table 3 The λmax and absorption of different pigments with tannin acid in different pH
2.3pH对辅色作用的影响
2.3.1紫外-可见光谱分析由表3可知,pH变化时,甘蓝红色素、黑米色素和红树莓色素在未添加辅色剂的情况下溶液颜色不同。而在加入单宁酸后,与相同pH未添加单宁酸的色素溶液相比,黑米色素和红树莓色素的最大吸收波长发生红移,黑米色素色素在pH3.0和pH5.0最大吸收波长处的吸光度差异显著(p<0.05),在pH2.0、4.0和6.0时差异极显著(p<0.01);红树莓色素在pH2.0时最大吸收波长处的吸光度差异不显著,在pH5.0时差异显著(p<0.05),在pH3.0、4.0和6.0时差异极显著(p<0.01);而甘蓝红色素仅在pH5.0时差异极显著(p<0.01),在pH6.0时差异显著(p<0.05),且最大吸收波长不发生偏移。
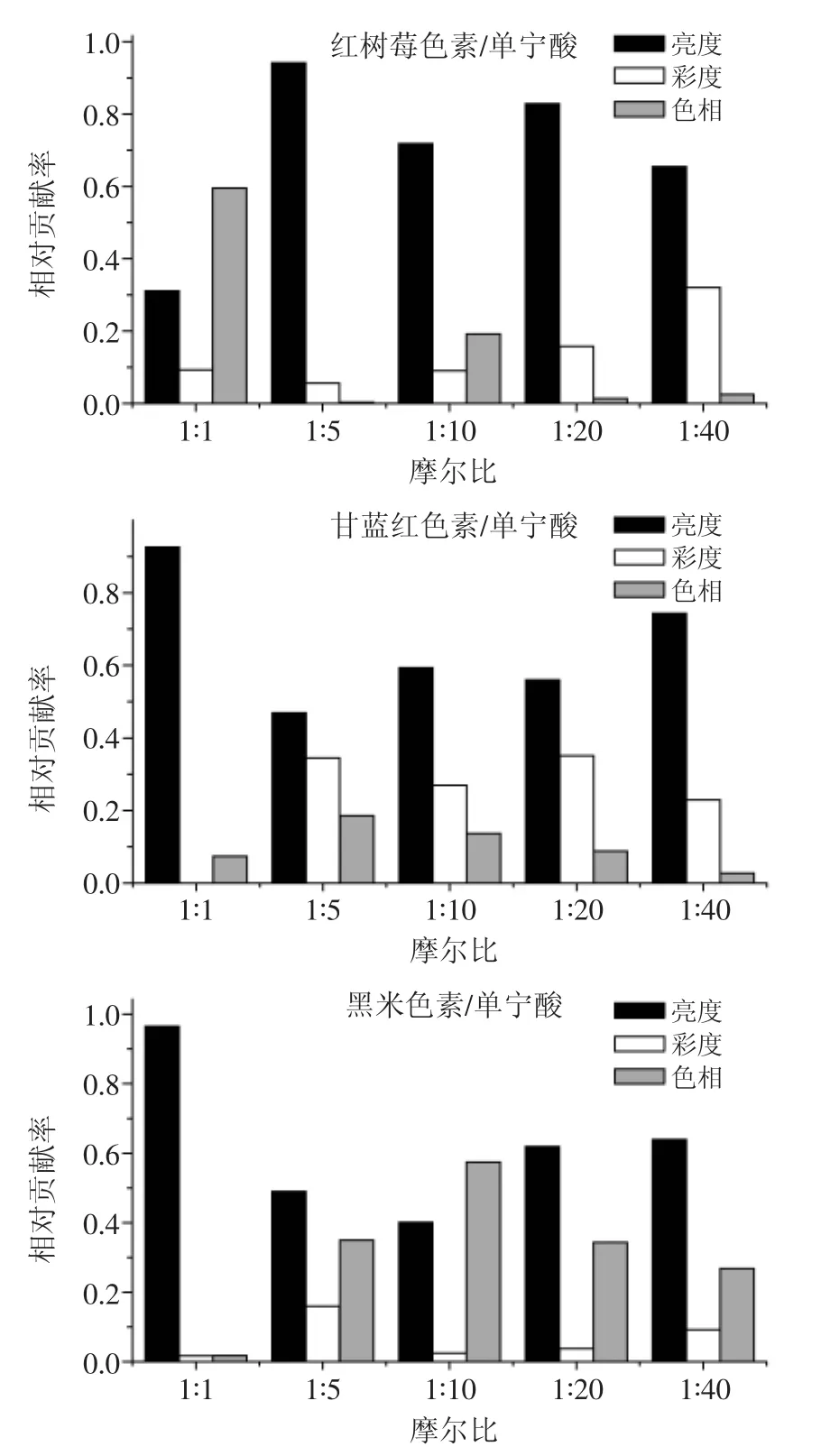
图3 红树莓色素、甘蓝红色素和黑米色素加入不同摩尔比单宁酸后亮度、彩度和色相在总色差变化中的相对贡献率Fig.3 Relative contribution of lightness,chroma,and hue to the total color difference for each pigment/copigment as a function of the different molar ratio
2.3.2pH对单宁酸辅色的CIELab分析由表4可知,在pH2.0~6.0范围内,同一色素溶液的L、a、b因为pH不同而发生变化,说明溶液呈现不同的颜色。甘蓝红色素溶液在加入单宁酸后,L、a、b值均有变化,说明单宁酸有辅色作用,L值在pH2.0~5.0有显著性差异(p<0.05),pH3.0时差异极显著(p<0.01),pH6.0时差异不显著;a值在pH4.0时差异显著(p<0.05),其余pH条件下差异不显著;而b值在pH2.0~6.0差异均不显著。黑米色素溶液在加入单宁酸后,L、a、b值都有变化,说明单宁酸具有辅色作用,其中L值在pH2.0、3.0和5.0时差异显著(p<0.05),在pH4.0和6.0时差异极显著(p<0.01);a值在pH3.0时差异显著(p<0.05);b值在pH3.0、6.0差异显著(p<0.05),pH2.0时差异极显著(p<0.01)。红树莓色素溶液在加入单宁酸后,L、a、b值都有变化,说明单宁酸具有辅色作用,L值只有在pH3.0时差异极显著(p<0.01);a值在pH2.0~6.0差异不显著;而b值在pH2.0和6.0时差异显著(p<0.05),pH5.0时差异极显著(p<0.01)。总的来看,单宁酸对三种色素溶液都有辅色效果。
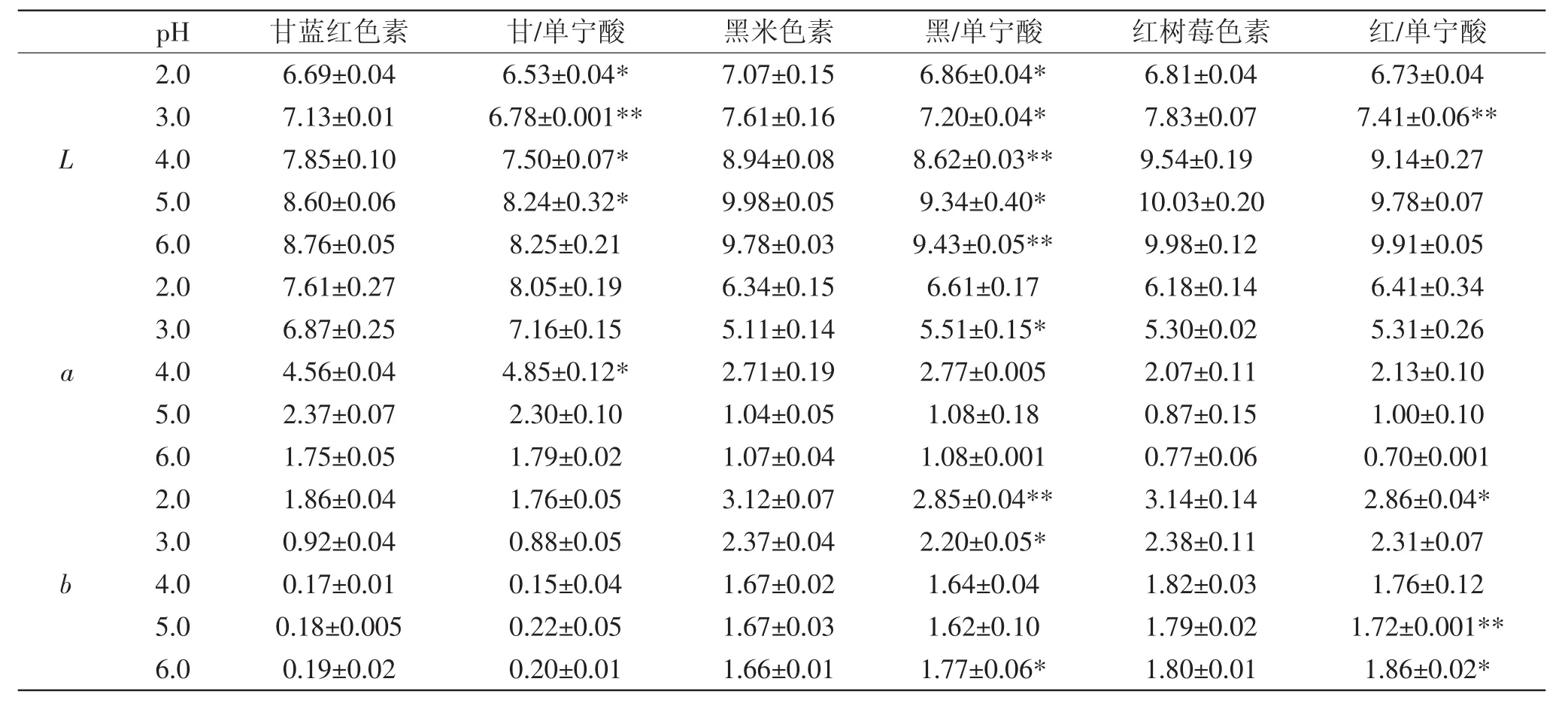
表4 pH对加入单宁酸色素体系L、a、b值变化的影响Table 4 The CIELab difference of different pigments with tannin acid in different pH
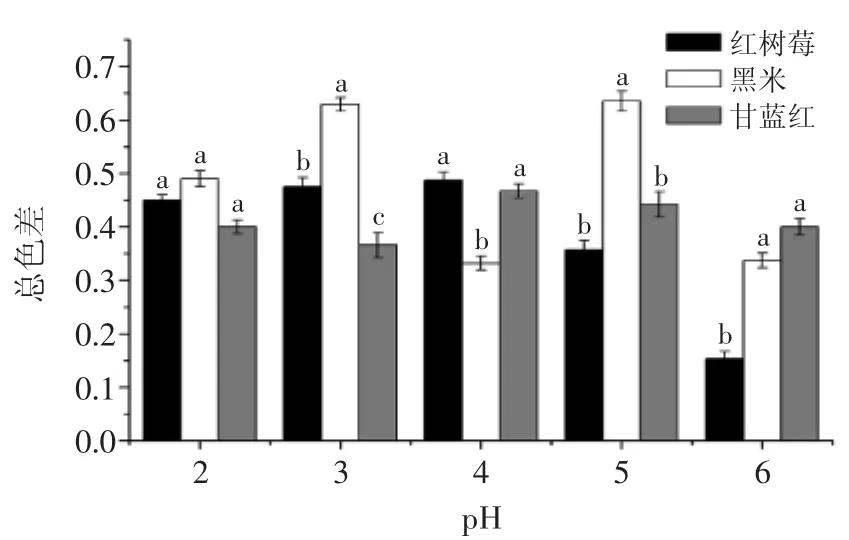
图4 pH对单宁酸辅色总色差的影响Fig.4 The changes of total color in the magnitude of copigmentation of pigments with tannin acid at different pH
由图4可知,在pH2.0~6.0的范围内单宁酸与三种色素都有辅色作用,而总色差的大小是跟pH有关系的。添加单宁酸后黑米色素在pH3.0、5.0时,总色差最大,而红树莓色素和甘蓝红色素在pH4.0时总色差最大。在pH2.0时,三种色素的总色差差异不显著;而pH3.0时三种色素的总色差差异显著(p<0.05);pH4.0时,甘蓝红色素和红树莓色素的总色差差异不显著,而二者与黑米色素的总色差差异显著(p<0.05);pH5.0时,黑米色素与红树莓色素总色差有显著差异(p<0.05),而甘蓝红色素与红树莓色素差异不显著;pH6.0时,黑米色素与甘蓝红色素差异不显著,而二者与红树莓色素的总色差差异显著(p<0.05)。
同样,计算了各pH溶液的总色差、亮度、彩度、色相,然后分析了其变化。结果见图5所示。
由图5可知,黑米色素溶液中,pH为3~6时,亮度对总色差的相对贡献率最大,而pH=2时,色相对于总色差的贡献更大。红树莓色素溶液中,依然是亮度的变化对总色差的贡献最大,而彩度和色相的变化很小,但在pH=2时的色相和彩度的变化相对于亮度的变化影响更大。甘蓝红色素溶液中,pH为2和3时,彩度的变化对总色差的相对贡献率较大,而pH增大时,亮度的变化对于总色差的变化较大。而色相的变化相对较小。
3 结论
单宁酸对黑米色素、红树莓色素和甘蓝红色素三种物质中提取的天然色素都有辅色效果,相同条件下,黑米色素和红树莓色素的总色差变化大,甘蓝红色素的总色差变化不显著,在两种评价辅色效果的方法中,CIELab法更全面的解释了颜色变化中色相、彩度和亮度的变化,这有助于解释在不同的辅色过程中对颜色产生影响的因素。
在紫外光谱的分析中,黑米色素和红树莓色素在辅色过程中最大吸收波长发生偏移,推断发生了分子内辅色,而甘蓝红色素在辅色过程中未发生最大吸收波长偏移,推断发生了分子间辅色。根据LCMS分析的结果,红树莓色素和黑米色素的所含主要为未酰化的花色苷单体,而甘蓝红色素含有酰化的花色苷单体,导致在辅色过程中不能与单宁酸分子相结合,发生了分子间辅色。本实验对不同的天然色素进行了研究,为选取效果良好的天然色素着色剂以及提高其辅色效果提供了理论依据。
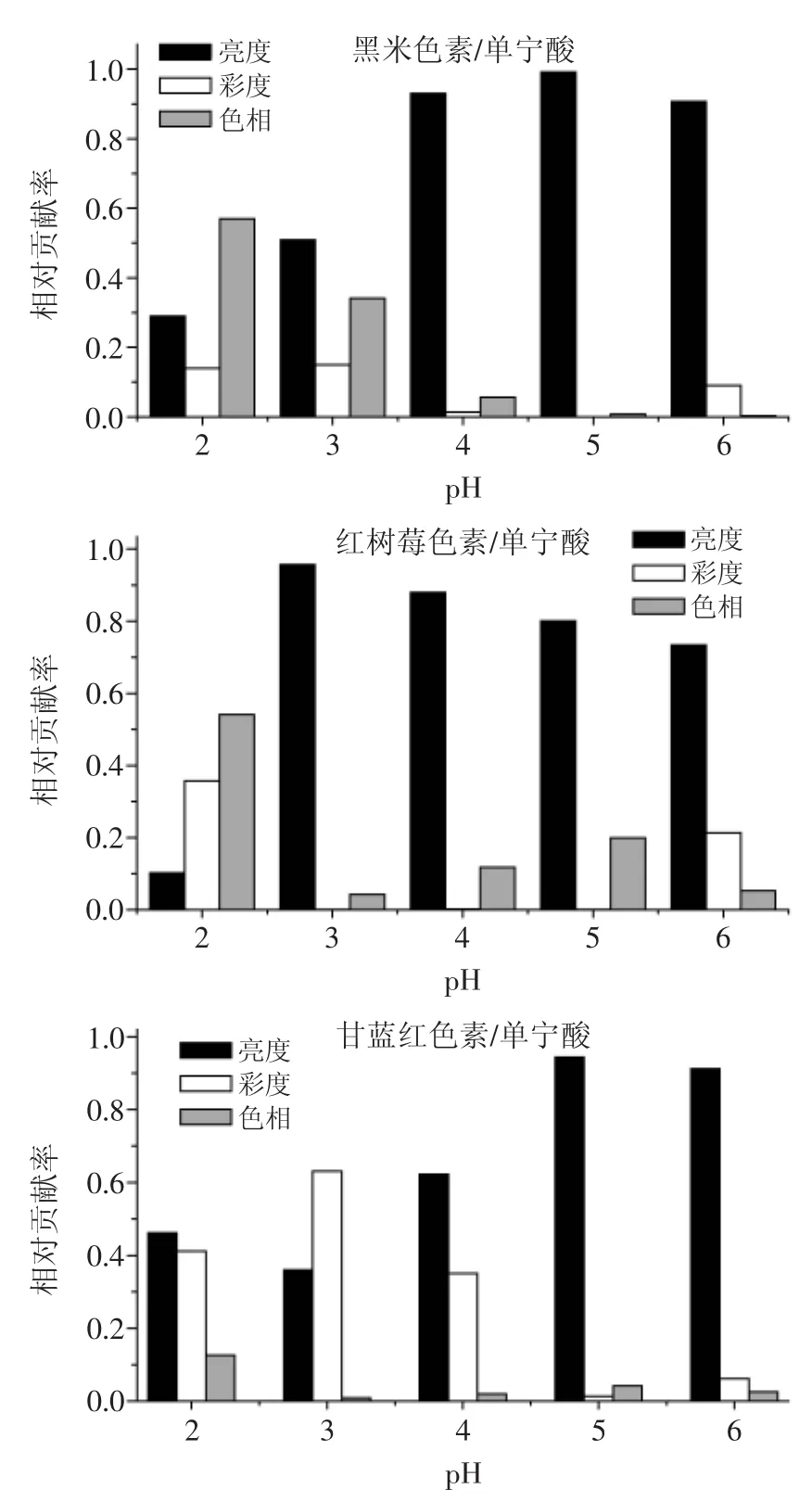
图5 加入单宁酸的黑米色素、红树莓色素和甘蓝红色素在不同pH下亮度、彩度和色相对总色差的相对贡献率Fig.5 Relative contribution of lightness,chroma,and hue to the total color difference for each pigment/copigment as a function of the pH value
[1]钟瑞敏.花色苷结构与稳定性的关系及其应用研究[J].韶关学院学报,2001,22(12):79-83.
[2]李颖畅,吕春茂,孟宪军,等.辅色剂对蓝莓花色苷的辅色作用及其稳定性的影响[J].食品工业科技,2010,31(9):301-309.
[3]赵辰辰,吕晓玲,梁宇航,等.辅色剂提高红米红色素稳定性研究[J].中国食品添加剂,2014(7):116-122.
[4]朱洪梅,韩永斌,顾振新,等.单宁对紫甘薯花色苷的辅色作用研究[J].南京农业大学学报,2006,29(30):98-102.
[5]李颖畅,李冰心,吕春茂,等.酰基化蓝莓花色苷的稳定性和对氧自由基清除能力[J].食品工业科技,2012,33(6):212-214.
[6]李颖畅,齐凤元,樊严蓝.莓花色苷的微胶囊化[J].食品与发酵工业,2010,36(6):71-75.
[7]王萌,李小定,刘硕,等.有机酸对紫甘薯花色苷的辅色作用[J].食品科学,2014,35(23):119-124.
[8]Malaj N,Simone B C D,Quartarolo A D,et al. Spectrophotometric study of the copigmentation of malvidin 3-O-glucoside with p-coumaric,vanillic and syringic acids[J]. Food Chemistry,2013,141:3614-3620.
[9]Jime'nez-Aguilar D M,Ortega-Regules A E,Lozada-Ramı'rez J D.Color and chemical stability of spray-dried Blueberry extract using mesquite gum as wall material[J].Journal of Food Composition and Analysis,2011,24:889-894.
[10]宋德群,孟宪军,王晨阳,等.蓝莓花色苷的pH示差法测定[J].沈阳农业大学学报,2013,43(2):231-233.
[11]Gordillo B,Francisco J,Pulido R.Comprehensive Colorimetric Study of Anthocyanic Copigmentation in Model Solutions.Effects of pH and Molar Ratio[J].Journal of Agriculuture and Food Chemistry,2012,60:2896-2905.
[12]Hou Z H,Qin P Y,Yan Z.Identification of anthocyanins isolated from black rice(Oryza sativa L.)and their degradation kinetics[J].Food Research International,2013,50:691-697.
[13]李蕊,王萍,王振宇.野生红树莓花色苷的提取分离和成分鉴定[J].食品与发酵工业,2010,36(10):203-207.
[14]Jing P,Zhao S J,Ruan S Y.Anthocyanin and glucosinolate occurrences in the roots of Chinese red radish(Raphanus sativus L.),and their stability to heat and pH[J].Food Chemistry,2012,133:1569-1576.
[15]Wiczkowski W,Szawara-Nowak D,Topolska J.Red cabbage anthocyanins:Profile,isolation,identification,and antioxidant activity[J].Food Research International,2013,51:303-309.氨酸[J].天然产物研究与开发,2006,17(6):784-789.
[14]席冬华,李维霞,高晶,等.液相色谱-质谱法和高效液相色谱法定性定量籽瓜中的L-瓜氨酸[J].食品科学,2014,35(24):271-276.
[15]何炳林,黄文强.离子交换与吸附树脂[M].上海:上海科技教育出版社,1995:172-174.
[16]Zhang H C,Liang H,Kuang P Q,et al.Simultaneously preparative purification of Huperzine A and Huperzine B from by macroporous resin and preparative high performance liquid chromatography[J].JournalofChromatographyB,2012,904:65-72.
[17]李娜,鲁晓翔.大孔吸附树脂分享纯化红花总黄酮的研究[J].食品工业科技,2011,32(4):276-279.
[18]Li B,Wang C L,Chen X M,et al.Highly specific separation forantitumorSpiropreussioneAfromendophyticfungal fermentation broth by one-step macroporous resins AB-8 treatment[J].Journal of Chromatography B,2013,938:1-7.
[19]王中来,林森炜,卢燕梅.L-酪氨酸在732阳离子交换树脂上吸附平衡与动力学研究[J].离子交换与吸附,2008,24(1):55-63.
[20]赵丽萍,江岩.AB-8,NKA两种大孔树脂对药桑椹花青素分离纯化的比较[J].食品科技,2013,38(4):219-223.
[21]曹少谦,潘思轶,姚晓琳,等.柱层析法分离纯化血橙花色苷[J].中国农业科学,2009,42(5):1728-1736.
[22]Liu Y F,Liu J X,Chen X F,et al.Preparative separation and purification of lycopene from tomato skins extracts by macroporous adsorption resins[J].Food Chemistry,2010,123(4):1027-1034.
Evaluation of copigmentation effects of tannin acid on three kinds of pigments
LIU Song,LI Xiao-ding*,JIANG Hong,LI Jie
(Key Laboratory of Environment Correlative Dietology,Ministry of Education,College of Food Science and Technology,Huazhong Agricultural University,Wuhan 430070,China)
The pigments which were extracted from cabbage,black rice and red raspberry were studied on the copigmentation with tannin acid by UV-vis spectrophotometer and CIELab color space assay.The results showed that the maximum absorption wavelength of red raspberry and black rice pigments exhibited bathochromic shift as the increase of molar ratio,whereas cabbage pigment had no deviation.Along the pH variation from pH 2.0 to pH 6.0,the value of lightness,chroma and hue differences were changed with the addition of tannin acid,and lightness made the main contribution of copigmentation to the total color.In the copigmentation,at pH 4,the cabbage and red raspberry pigments exhibited the obvious change of the total color difference with tannin acid,while the value of black rice pigment was at pH 3 and pH 5.
pigment;copigmentation;total color;tannin acid
TS201.1
A
1002-0306(2015)20-0320-06
10.13386/j.issn1002-0306.2015.20.057
2015-03-20
刘松(1989-),男,在读硕士研究生,研究方向:天然产物化学,E-mail:liusong865@163.com。
李小定(1968-),男,博士,副教授,主要从事粮食油脂与植物蛋白工程及天然产物化学方面的研究,E-mail:lixd@mail.hzau.edu.cn。
国家科技支撑计划项目(2013BAD20B06)。
