草鱼冷藏过程中肌原纤维蛋白的变化
2015-11-04王发祥张付兰刘永乐王建辉李向红长沙理工大学化学与生物工程学院湖南省水生资源食品加工工程技术研究中心湖南长沙410114
王发祥,张付兰,刘永乐,俞 健,王建辉,李向红,陈 奇(长沙理工大学化学与生物工程学院,湖南省水生资源食品加工工程技术研究中心,湖南长沙410114)
草鱼冷藏过程中肌原纤维蛋白的变化
王发祥,张付兰,刘永乐*,俞健,王建辉,李向红,陈奇
(长沙理工大学化学与生物工程学院,湖南省水生资源食品加工工程技术研究中心,湖南长沙410114)
通过亚基组成、热力学性质、表面疏水性和Ca2+-ATPase活性的变化分析,评价了草鱼(Ctenopharyngodon idellus)肌原纤维蛋白在冷藏过程中的变化。结果表明:冷藏前期草鱼肌原纤维表面疏水性增加,说明蛋白逐渐变性导致更多的疏水性基团暴露出来,而第6 d后又大幅降低,可能与其部分降解为小分子并聚合有关;而Ca2+-ATPase活性在冷藏前6 d显著下降,进一步说明冷藏前期肌原纤维蛋白变性程度增加;SDS-PAGE分析表明草鱼肌原纤维蛋白的亚基组成变化不大,但其蛋白含量在冷藏过程中呈先增加后下降的趋势,同时部分蛋白条带信号时有时无,也说明冷藏过程中既存在大分子亚基一定程度的降解,也存在小分子亚基聚合的情况;冷藏过程中草鱼肌原纤维蛋白的热力学性质没有明显的变化,表明冷藏对其热稳定性影响不大。
草鱼,肌原纤维蛋白,表面疏水性,差示扫描量热法,冷藏
草鱼(Ctenopharyngodon idellus)肉质鲜美,价格适中,深受消费者喜爱,是我国产量和消费量最大的淡水鱼之一。然而,草鱼肉水分含量高,组织酶活性强,很难保鲜和贮藏,即使在冷藏条件下,肌肉也极易软化、汁液流失甚至腐败。蛋白质为草鱼肌肉组织的最重要组成部分,其冷藏过程中的降解和变性均会导致其功能丧失,从而直接决定了鱼肉质量的好坏[1-3]。肌原纤维蛋白是组成肌肉中肌原纤维的蛋白质,不溶于水,仅溶于高盐溶液,种类包括肌球蛋白、肌动蛋白、原肌球蛋白、肌钙蛋白、辅肌动蛋白等15种以上的蛋白质。草鱼肌肉蛋白质中60%~75%为肌原纤维蛋白,其不仅与鱼体死后僵硬和肌肉的收缩有关,还与鱼肉加工、储运过程中的蛋白质变性和凝胶形成能力及其稳定性有密切关系[4-5]。已有研究关注到草鱼冷藏过程中肌肉蛋白质的变化[3],但尚未具体到肌原纤维蛋白变化规律的研究。因此,研究冷藏过程中草鱼肌原纤维蛋白理化性质和结构变化规律,对研究淡水鱼肌肉质量的变化及品质劣化机制具有重要意义。
目前,聚丙烯酰胺凝胶电泳(SDS-PAGE)和差示扫描量热(DSC)等方法已被用作评估肌肉蛋白质在贮藏过程中变化和稳定性的有力工具。冷藏过程中,肌原纤维蛋白的Ca2+-ATPase活性、表面疏水性和热力学性质等作为判定肌肉蛋白质变性的重要指标,其随时间延长的改变也能直接反映肌肉蛋白质理化性质和微结构的变化情况。本文通过SDS-PAGE、DSC、反相高效液相色谱(RP-HPLC)和Ca2+-ATPase活性测定等方法,研究了冷藏过程中草鱼肌原纤维蛋白的变性特征及其亚基、热力学性质的变化规律,旨在从肌原纤维蛋白变化角度阐述冷藏对草鱼肉的影响,为草鱼的保鲜或加工提供参考。
1 材料与方法
1.1材料与仪器
新鲜草鱼购于当地农贸市场,每尾约1.5 kg;甘氨酸、SDS、三羟甲基氨基甲烷、聚乙二醇6000、盐酸胍、尿素、对苯二酚、亚硫酸钠、钼酸铵分析纯,国药集团化学试剂有限公司;5,5’-二硫代-2-硝基苯甲酸分析纯,潍坊华实药业有限公司。
Centrifuge 5430R型高速冷冻离心机德国eppendorf公司;AUY120分析天平日本岛津公司;DTS系列双频超声波清洗机、微波光波超声波萃取仪宁波新芝生物科技股份有限公司;THX-05低温恒温循环泵宁波天恒仪器厂;STA449PC型综合热分析仪德国耐驰公司;LC20高效液相色谱日本岛津公司。
1.2实验方法
1.2.1不同冷藏时间肌原纤维蛋白样品的制备新鲜草鱼致死后去头、尾、鳞,洗净后去骨,将肌肉分割成10 g左右的小块,自封袋包装(100 g)后于2~4℃冰箱冷藏,分别在0、2、4、6、8和10 d的同一时间点取出,参考Chen[6]方法制备肌原纤维蛋白样品。
1.2.2肌原纤维蛋白SDS-PAGE分析在1.2.1中所收集的上清液中吸取肌原纤维蛋白上清液400 μL于1.5 mL Eppendorf管中,1∶1加入2倍还原上样缓冲液(Tris-HCl,pH6.8,100 mmol/L;SDS,4%;溴酚兰,0.2%;甘油,20%;β-巯基乙醇,200 mmol/L),混匀煮沸3 min,12000 r/min离心5 min,吸取上清液,上清液即为电泳样品。电泳条件:分离胶浓度为12%,浓缩胶浓度5%,恒压电压120 V,考马斯亮蓝G250染色,Gel-Pro 4.5软件分析电泳图,比较其光密度(IOD)和蛋白条带。
1.2.3蛋白质表面疏水性分析各个贮藏时间的鱼肉肌原纤维蛋白溶液样品用磷酸盐缓冲液(15.6 mmol/L Na2HPO4,3.5 mmol/L KH2PO4,0.5 mol/L NaCl,pH7.5)做50倍稀释,12000 r/min离心5 min,上清液用0.45 μm的微孔滤膜过滤备用。样品以高效液相色谱进行反相色谱(PRLC)分析,根据出峰时间、峰面积判断蛋白质的疏水性[7-8]。色谱条件:Symmetry-C18色谱柱,柱温为30℃,SPD-M20A二级管阵列检测器,检测波长为280 nm,进样量为20 μL。流动相为甲醇—水溶液,以水为流动相A,以甲醇为流动相B,洗脱梯度:0 min,5%B;0~30 min,5%~90%B;30~33 min,90%~5%B;33~40 min,5%B。根据出峰时间和特征以8.5 min为分界点,可将8.5~30 min的峰面积与总峰面积的比值作为疏水性系数用于判断其表面疏水性强弱的依据。
1.2.4热力学性质变化分析采用示差扫描量热(DSC)分析,间接反映蛋白结构的变化。配对好铝坩埚,在铝坩埚中加入2.5 mg的草鱼肌原纤维蛋白质样品,压盖密封,以综合热分析仪扫描曲线。温度扫描范围:30~120℃;扫描速率:10℃/min。
1.2.5Ca2+-ATPase活性的变化分析参考Benjakul[9-10]关于Ca2+-ATPase活性的测定方法。
1.2.6数据统计分析每组实验进行3个平行,实验数据采用DPS数据处理系统进行统计分析。
2 结果与分析
2.1SDS-PAGE电泳分析
不同冷藏时间草鱼肌原纤维蛋白的SDS-PAGE图谱如图1所示。可见,草鱼肌原纤维蛋白主要由分子量约为215 ku的肌球蛋白重链、43 ku的肌动蛋白和33~36 ku的原肌球蛋白等组成[11];而且,除了从第2 d开始新增了一条98 ku的新条带外,所有样品的蛋白条带分布模式几乎无肉眼可辨的差别,说明冷藏过程中,组成肌原纤维蛋白的亚基变化不大。

图1 草鱼冷藏过程中肌原纤维蛋白SDS-PAGE图谱Fig.1 SDS-PAGE pattern of myofibrillar protein of Ctenopharyngodon idellus during refrigerated storage
用Gel-Pro Analyzer 4.0凝胶分析软件对图1进行分析,得到各个泳道中蛋白质条带与其相应的分子量和光密度,如表1所示。可见从第2 d新增的98 ku的蛋白质条带随着冷藏时间的延长,光密度不断降低;与此同时,第0 d样品中分子质量为88 ku的蛋白条带在第2 d未检测出信号,表明冷藏过程中存在部分蛋白亚基持续降解过程;另外,分子质量为73 ku和41 ku的蛋白条带IOD值呈先增加后降低的趋势,至第8 d已检测不到信号;而且,每个样品检测到蛋白条带的总IOD值也呈现先升高,第4 d到达峰值,然后再降低的趋势。由于蛋白样品从提取到上样都严格保证了一致性,因此,表1结果可说明冷藏过程中草鱼肌原纤维蛋白的含量呈先增加后下降的趋势,可能是因为前期蛋白质变性引起肌球蛋白聚合体解开,溶解性增加,而后期下降则可能与蛋白质的降解有关。这一趋势也与Wang等[12]报道的大西洋鲑鱼的变化趋势基本相似。此外,分子量在122~147 ku的蛋白条带信号时有时无,表明冷藏过程中不仅存在大分子亚基逐渐降解,也可能存在小分子亚基聚合的情况。

表1 各个蛋白带的光密度分子量分析表Table 1 Analysis of optical density of each protein band with molecular weight
2.2热力学性质变化分析
DSC方法是分析蛋白质的热稳定性最有力的工具,蛋白质变性过程中的起始温度T0,峰值温度Tg,结束温度Te和热焓ΔH,可以间接反映蛋白质在冷藏过程中结构的变化[13-14]。冷藏过程中草鱼肌原纤维蛋白的热力学性质的变化如表2所示。由表2可知,在本实验中,随着冷藏时间的延长,热变性的结束温度Te在小幅度的降低,热焓ΔH呈现先降低再增加,而后继续降低的趋势,峰值温度Tg则没有明显的变化规律。总体而言,冷藏过程中草鱼肌原纤维蛋白的热力学性质变化不大。

表2 不同冷藏时间的草鱼肌原纤维蛋白热特性表Table 2 Time-dependent changes of thermal characteristics of Ctenopharyngodon idellus myofibrillar protein during different refrigerated storage time
2.3表面疏水性的变化分析
蛋白质表面疏水性不仅反映其表面疏水性氨基酸的相对含量,也可反映蛋白质的变性程度,表面疏水性的增加表明其变性程度增加[15]。反相高效液相色谱是根据样品疏水性的不同而进行的分离,样品的出峰时间、出峰面积和峰强度反映出样品疏水性的强弱,出峰时间越短,峰面积越大,峰强度越强,说明蛋白质的疏水性越弱[16]。
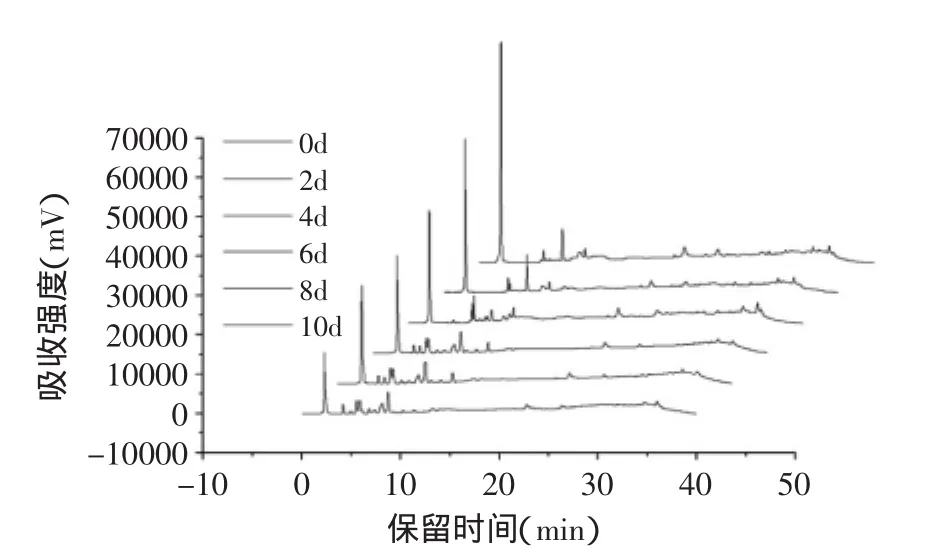
图2 草鱼肌原纤维蛋白不同冷藏时期的凝胶色谱图Fig.2 Gel chromatogram of myofibrillar proteins of Ctenopharyngodon idellus during different refrigerated storage ice protein
图2为草鱼肌原纤维蛋白不同冷藏时期的凝胶色谱图,草鱼肌原纤维蛋白不同冷藏时间点的表面疏水性变化规律如图3所示。可见,随着冷藏时间的延长,反相色谱的第一个洗脱峰的面积逐渐减小,根据色谱的双保留机理,有机相为低浓度时,蛋白质保留主要受疏水作用影响,因此,在反相色谱中先洗脱出来的部分亲水性强,说明冷藏过程中草鱼肌原纤维蛋白的亲水性组分逐渐减少;然而,蛋白质的疏水性系数并没有呈现出一直上升的规律,在冷藏前4 d,草鱼肌原纤维蛋白的疏水性系数逐渐增加,印证了冷藏过程中蛋白质变性伸展,埋藏在分子内部的部分疏水性氨基酸暴露出来,从而导致表面疏水性的增加;但从第4 d开始,疏水性系数有所下降,这可能是因为冷藏后期部分蛋白质降解为更小的蛋白质分子后,又因为疏水相互作用缔合,其疏水性氨基酸又被包埋在更大的蛋白质聚集体内部,从而导致表面疏水性基团减少。这与Soottawat等[17]报道的冻藏过程中比大目狗母鱼肌肉蛋白表面疏水性变化规律类似。

图3 冷藏过程中草鱼肌原纤维蛋白表面疏水性变化Fig.3 Changes in surface hydrophobicity of grass carp myofibrillar protein during cold storage
2.4Ca2+-ATPase活性的变化分析
肌球蛋白是肌原纤维蛋白的主要部分,ATPase位于肌球蛋白的头部,当肌球蛋白在冷藏过程中发生变性时,ATPase活性已因受到影响而随之变化,从而失去活性[18]。因此Ca2+-ATPase活性是评定蛋白质品质的重要指标,测定ATPase活性的变化可以反映出肌球蛋白的变化情况,继而反映出肌肉的变化情况[19]。图4为不同冷藏时间草鱼肌动球蛋白Ca2+-ATPase的活性测定结果。可见,随着草鱼肌肉冷藏时间的延长,其肌原纤维蛋白的Ca2+-ATPase活性呈下降趋势,尤其是前6 d内下降非常显著(p<0.01)。

图4 不同冷藏温度下草鱼肌原纤维蛋白Ca2+-ATPase活性的变化Fig.4 Changes of Ca2+-ATPase activities in Ctenopharyngodon idellus muscle at different temperatures
3 结论
对冷藏条件下草鱼肌原纤维蛋白的亚基分布、热力学性质、表面疏水性和Ca2+-ATPase活性等理化性质的变化进行了分析。结果表明:冷藏前期,草鱼肌原纤维蛋白逐渐变性导致更多的疏水性基团暴露出来,表面疏水性增加,第6 d后开始大幅降低,可能与其部分降解为小分子并聚合有关;而Ca2+-ATPase活性在冷藏前6 d显著下降,进一步说明冷藏前期肌原纤维蛋白变性程度增加;SDS-PAGE分析表明草鱼肌原纤维蛋白的亚基组成变化不大,但其蛋白含量在冷藏过程中呈先增加后下降的趋势,同时部分蛋白条带信号时有时无,也说明冷藏过程中既存在大分子亚基一定程度的降解,也存在小分子亚基聚合的情况;另外,冷藏过程中草鱼肌原纤维蛋白的热力学性质没有明显的变化,表明冷藏对肌原纤维蛋白的热稳定性影响不大。以上结果说明,草鱼冷藏前期,原有维持肌原纤维蛋白稳定的作用力被破坏,导致其空间构象改变而发生变性,表面疏水性和Ca2+-ATPase活性均下降;同时变性引起部分聚合体解开,溶解性增加,表现为光密度(IOD)总和增加。冷藏后期,肌原纤维蛋白逐渐降解,总IOD值降低,降解成的小分子蛋白质重新聚合,导致表面疏水性重新下降。
[1]Addis M F,Cappuccinelli R,Tedde V,et al.Proteomic analysis of muscle tissue from gilthead sea bream(Sparus aurata)farmed in offshore floating cages[J].Aquaculture,2010,309(1):245-252.
[2]Polati R,Menini M,Robotti E,et al.Proteomic changes involved in tenderization of bovine Longissimus dorsi muscle during prolonged ageing[J].Food Chemistry,2012,135(3):2052-2069.
[3]李强,刘永乐,王发祥,等.草鱼肌肉蛋白质在冷藏过程中的变化[J].食品科学,2013,3:55-58.
[4]刘红英.水产品加工与贮藏[M].北京:化学工业出版社,2006.
[5]Arashisar S,,Hisar O,Kaya M,et al.Effects of modified atmosphere and vacuum packaging on microbiological and chemical properties of rainbow trout(Oncorynchus mykiss)fillets[J].International journal of food microbiology,2004,97(2):209-214.
[6]Chen T Y,Hwang D F.Electrophoretic identification of muscle proteins in 7 puffer species[J].Journal of food science,2002,67(3):936-942.
[7]曾茂茂,王霄,陈洁.蛋白质疏水性测定方法的相关性及适用性[J].食品科学,2011,15:117-120.
[8]Qing C Meng,Helen Zou,Jonas S,et al.Determination of the HydrophobicityofLocalAnestheticAgents[J].Analytical Biochemistry,2001,292:102-106.
[9]Benjakul S,Seymour T A,MORRISSEY M T,et al. Physicochemical changes in Pacific whiting muscle proteins during iced storage[J].Journal of Food Science,1997,62(4):729-733.
[10]Benjakul S,Visessanguan W,Aewsiri,et al.ATPase activities and autolysis of kuruma prawn Penaeus japonicus muscle proteins[J].Int Aquat Res,2011(3):53-61.
[11]熊善柏.水产品保鲜储运与检验[M].北京:化学工业出版社,2007.
[12]Wang H,Liceaga-Gesualdo A M,Li-Chan E C Y. Biochemical and physicochemical characteristics of muscle and natural actomyosin isolated from young Atlantic salmon(Salmosalar)fillets stored at 0 and 4℃[J].Journal of food science,2003,68(3):784-789.
[13]E C Y Li-Chan,C Y Ma.Thermal analysis of flaxseed(Linum usitatissimum)proteins by differential scanning calorimetry[J]. Food Chemistry,2002,77(4):495-502.
[14]于源,张敏,邵弘.差示扫描量热法在大豆蛋白产品品质检测中的应用[J].大豆通报,2008(1):26-28.
[15]Paredi M E,Crupkin M.Biochemical and physicochemical properties of actomyosin from pre-and post-spawned flounder(Paralichtys patagonicus)stored on ice[J].LWT-Food Science and Technology,2007,40(10):1716-1722.
[16]尤娟.鲢鱼鱼肉蛋白抗氧化肽的制备及其糖基化产物功能特性的研究[D].北京:中国农业大学,2014.
[17]SoottawatBenjakul,WonnopVisessanguan, Chutima Thongkaew,et al.Comparative study on physicochemical changes of muscle proteins from some tropical fish during frozen storage[J].Food Research International,2003,36:787-795.
[18]Benjakul S,Visessanguan W,Aewsiri T,et al.ATPase activities and autolysis of kuruma prawn Penaeus japonicus muscle proteins[J].Int Aquat Res,2011,3:53-61.
[19]Gabriel Antonio Sánchez,Daniel Eduardo Di Croce,Ana Clara Casadoumecq,et al.Characterization of the sarcoplasmic reticulum Ca-ATPase from rabbit temporalis muscle[J].Archives of Oral Biology,2012,57:1429-1437.
Changes in myofibrillar proteins of grass carp during chilling storage
WANG Fa-xiang,ZHANG Fu-lan,LIU Yong-le*,YU Jian,WANG Jian-hui,LI Xiang-hong,CHEN Qi
(Hunan Provincial Engineering Research Center for Food Processing of Aquatic Biotic Resources,College of Chemisty and Biology Engineering,Changsha University of Science and Technology,Changsha 410114,China)
Through analyzing the variation of protein subunit composition,thermodynamic properties,surface hydrophobicity and Ca2+-ATPase activity of myosin,the changes in myofibrillar proteins of grass carp during chilling storage were investigated.The results showed that with the extension of chilling storage time,the surface hydrophobicity of myofibrillar proteins was increased at first and then descended sharply and the Ca2+-ATPase activity of myosin was declined significantly,indicating that the degree of myofibrillar protein denaturation was augmented gradually.SDS-PAGE analysis revealed that there was little change in subunits composition of myofibrillar protein,but its total content increased at first but later decreased,and at the same time,part of the protein band signal was occasionally detected,suggesting some degree of degradation with macromolecular subunits and polymerization with small molecular subunit might coexist during cold storage period.Besides,there was no apparent change in thermodynamic properties of the myofibrillar protein of different storage time,indicating that cold storage had little effect on its thermal stability.
grass carp;myofibrillar proteins;hydrophobicity;differential scanning calorimetry;chilling storage
TS201.1
A
1002-0306(2015)18-0082-05
10.13386/j.issn1002-0306.2015.18.008
2015-01-16
王发祥(1978-),男,博士,副教授,研究方向:食品生物技术,E-mail:wfaxiang@163.com。
刘永乐(1962-),男,博士,教授,研究方向:食品生物技术与大宗农产品加工,E-mail:lyle19@163.com。
国家自然科学基金项目(31201427,31301564);国家科技支撑计划项目(2012BAD31B08);湖南省自然科学基金项目(12JJ6028)。
