魔芋葡甘聚糖及其衍生物肠道益生性的体外发酵评价
2015-11-02秦清娟徐小青王小燕
秦清娟,邓 利,徐小青,王小燕,钟 耕,2,3,*
(1.西南大学食品科学学院,重庆 400716;2.西南大学 食品科学与工程国家级本科实验教学示范中心,重庆 400716;3.重庆市特色食品工程技术研究 中心,重庆 400716)
魔芋葡甘聚糖及其衍生物肠道益生性的体外发酵评价
秦清娟1,邓 利1,徐小青1,王小燕1,钟 耕1,2,3,*
(1.西南大学食品科学学院,重庆 400716;2.西南大学 食品科学与工程国家级本科实验教学示范中心,重庆 400716;3.重庆市特色食品工程技术研究 中心,重庆 400716)
目的:评价魔芋葡甘聚糖(konjac glucomannan,KGM)及其衍生物脱乙酰基魔芋葡甘聚糖(D-KGM)、魔芋葡甘露低聚糖(konjac oligosaccharide,KOS)的肠道益生性。方法:分别以1 g/100 mL的KGM、KOS和D-KGM为碳源,通过小鼠盲肠内容物体外厌氧发酵,测定发酵液的pH值、微生物和短链脂肪酸,评价肠道益生效果。结果:与阳性对照组(以葡萄糖作为碳源)相比,KGM和KOS发酵液pH值明显降低,短链脂肪酸(short-chain fatty acids,SCFAs)和乳酸菌、双歧杆菌的数量显著增加,肠道潜在致病菌(大肠杆菌、梭状杆菌、拟杆菌)的增殖不明显,而D-KGM发酵液中pH值、肠道微生物、SCFAs与阴性对照组(不含碳源)均无显著性差异。结论:KOS和KGM具有显著的肠道益生性,而D-KGM没有肠道益生性。
魔芋葡甘聚糖;魔芋葡甘低聚糖;脱乙酰基魔芋葡甘聚糖;肠道益生性;体外发酵
魔芋(konjac),天南星科魔芋属多年生草本植物,主要生长在山地和丘陵地区,在我国西南部及长江中下游一带,资源相当丰富。现代研究表明其主要成分有:魔芋葡甘露聚糖(konjac glucomannan,KGM)、淀粉及粗蛋白,其中KGM含量可达到湿质量的10%~30%[1]。KGM是一种优良的膳食纤维,由β-D-葡萄糖与β-D-甘露糖以1.5~1.6的比例,通过β-l,4-糖苷键连接而成的杂多糖[2],在主链的C3位上存在通过β-l,3-糖苷键键合的支链结构,每32 个糖残基上有3 个左右的支链,支链只有几个残基的长度,并且每19 个糖残基上有一个乙酰基团,质量分数可以达到15%[3-4]。KGM的分子质量很大,光散射法测得其重均分子质量为8×105~2.2×106D,分子质量高达109D,是一种天然的高分子化合物[5]。
魔芋葡甘低聚糖(konjac oligosaccharide,KOS)和脱乙酰基魔芋葡甘聚糖(deacetylation konjac glucomannan,D-KGM)是KGM两种重要的衍生物。D-KGM是KGM在碱性物质或机械力作用下,脱去乙酰基得到的一种不可逆凝胶。D-KGM力学性能和热稳定性能较KGM都有显著性提高[6],在食品、包装、涂料、生物医药及化妆等领域有广泛应用。如魔芋豆腐、魔芋仿生食品等[7]。KOS是KGM可通过物理法[8]、化学法[9]或(和)生物法[10]将KGM降解而生成的低聚糖。尽管KGM有多种生理功能,但由于KGM的分子质量太高,溶于水中形成的液体黏度大,限制了KGM的应用范围,而通过降解生成的KOS不但溶解度得到提高,保持KGM原有的一些性能[11-12],同时还具有一些新的已知[13]或未知的功能。
众所周知,魔芋葡甘聚糖是优质的膳食纤维,能促进胃肠蠕动,有“肠道清道夫”作用,加快排泄体内有害毒素,预防和减少疾病的发生,还能有效保护胃黏膜,清洁胃壁,还具有良好的肠道益生性[14-16],然而以哪种形式食用才能发挥更好的作用,目前尚未见报道。而益生元发挥肠道益生性的作用机制主要有:通过增加肠道益生菌的活性,调节肠道上皮屏障发挥益生作用[17];降低肠道pH值,抑制有害菌的生长,防止肠道功能紊乱[18];促进短链脂肪酸(short-chain fatty acids,SCFAs)产生,为肠黏膜细胞提供能量,促进细胞的代谢、生长,还可增大肠道渗透压,提高粪便含水率[19]。本实验拟通过小鼠盲肠内容物体外厌氧发酵模拟肠道,比较不同发酵液pH值、肠道微生物和短链脂肪酸的差异,研究KGM、D-KGM和KOS的肠道益生性,评价KGM及其衍生物的食用价值。
1 材料与方法
1.1材料
KGM由四川绵阳魔力科技有限公司提供,符合NY/T 494—2010《魔芋粉》;D-KGM参照魔芋豆腐制作方法以上述KGM经碱化、加热、烘干、粉碎、过筛而成[7];KOS以上述魔芋粉经酶解、醇提、干燥、粉碎、过筛制备而成[20]。
1.2试剂
乙酸、丙酸、丁酸、正戊酸、异戊酸(色谱纯)阿拉丁试剂(上海)有限公司;胆汁酸盐、氯化血红素合肥博美生物科技有限责任公司;荧光定量PCR扩增试剂盒SYBR Premix Ex TaqTM、RR820A、DNA提取试剂盒9763 日本TaKaRa公司;总细菌、大肠杆菌、双歧杆菌、拟杆菌、乳酸菌、梭状杆菌的DNA引物由生工生物工程(上海)股份有限公司合成[21],具体序列及信息见表1。

表1 细菌16S rDNA引物序列Table 1 Primer pairs for bacterial 16S rDNA
1.3仪器与设备
LightScanner32型定量PCR仪 美国Idaho公司;BioSpec-mini生化分析型紫外分光光度计、GC-2010气相色谱仪 日本岛津公司;厌氧培养箱 美国Sheldon Manufacturing公司;5810型台式离心机 德国Eppendorf公司;Spectrum 100型红外光谱分析仪 美国Perkin Elmer公司;VD-650型桌上式洁净工作台 苏州精华设备有限公司;Rtx-wax毛细管柱 美国Restek公司;ES-315高压蒸汽灭菌锅 日本Kagoshima Seisakusyo公司;PHS-3C型精密酸度计 上海大普仪器有限公司。
1.4动物
清洁级KM小鼠、饲料 重庆腾鑫比尔实验动物销售有限公司,许可证号:SCXK(渝)2012-0003。
1.5方法
1.5.1KGM及其衍生物红外光谱扫描
分别取上述KGM、KOS和D-KGM干燥粉末5 mg,与100 mg KBr粉末在玛瑙研钵中充分研磨均匀,压片上机测定,红外光谱扫描范围为4 000~450 cm-1。
1.5.2体外厌氧发酵
无菌取20 只健康KM小鼠盲肠内容物于灭菌离心管中,9 倍(V/m)无菌生理盐水稀释,涡旋振荡3 min使其分散均匀,4 层纱布过滤,即为盲肠内容物稀释液。基础发酵液的配制参照Longland等[22]的方法,灭菌,分成5 份,其中3 份分别加入1 g/100 mL的KGM、KOS、D-KGM作为碳源,一份加入1 g/100 mL的葡萄糖(glucose,GLU)作为阳性对照组,另外一组不加任何碳源作为阴性对照,4 ℃稳定过夜,每个样品各做3 个平行。向上述发酵液中加入体积分数10%盲肠内容物稀释液混合均匀,将其放于37 ℃厌氧发酵箱中发酵24 h,终止发酵进行各项指标的测定。
1.5.3发酵液pH值测定
参考GB/T 1601-1993《农药pH值的测定方法》[23]标准方法测定。
1.5.4发酵液中短链脂肪酸含量测定
短链脂肪酸的提取参考贾益群等[24]的方法,用气相色谱测定发酵液中乙酸、丙酸、丁酸、戊酸及总酸含量。以乙酸、丙酸、正丁酸、异丁酸、正戊酸及异戊酸标准品做标准曲线,总酸为以上各种酸的总和。
气相色谱条件:进样量1 ☒L;进样口温度220 ℃;柱流量0.95 mL/min,柱温90 ℃、平衡时间0.5 min,5 ℃/min升温至150 ℃,保留时间7 min;检测器温度230 ℃;氢气流量40 mL/min,空气流量400 mL/min,尾吹流量40 mL/min。
1.5.5发酵液中微生物数量测定
1.5.5.1细菌基因组总DNA提取
将发酵液3 000 r/min离心5 min,取上清液5 mL,12 000 r/min离心3 min,弃上清液,之后按照DNA提取试剂盒说明书进行细菌基因组总DNA提取,提取的DNA经微量紫外分光光度计测得A260nm/A280nm值在1.8~2.0,说明可以作为荧光定量聚合酶链式反应(polymerase chain reaction,PCR)的DNA模板。
1.5.5.2荧光定量PCR
发酵液中微生物含量的测定采用SYBR GreenⅠ染料法,在定量PCR仪上进行。反应体系为SYBR GreenⅠ染料10 ☒L,上下游引物各1 ☒L,DNA模板4 ☒L,最后以双蒸水补足10 ☒L;反应程序:95 ℃ 1 min,95 ℃ 5 s,56 ℃ 30 s,72 ℃ 1 min,40 个循环。循环结束后进行熔解,熔解程序:95 ℃ 5 s,65 ℃ 15 s,95 ℃ 0.1 ℃/s降温。用定量PCR得出的Ct值,采用2-△△Ct法[25]计算大肠杆菌、双歧杆菌、拟杆菌、梭状杆菌、乳酸菌的相对含量。其中-△△Ct的计算见下式。
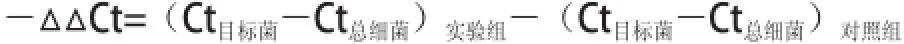
2 结果与分析
2.1KGM及其衍生物红外光谱分析

图1 魔芋葡甘聚糖及其衍生物的红外光谱图Fig.1 Infrared spectra of KGM and its derivatives
由图1可知,KGM及其衍生物红外光谱曲线走向大致相同,有共同的吸收峰,但也有不同的吸收峰。其中KOS与KGM相比在1 252、1 153、1 061 cm-1处产生了特征峰,结构与KGM变化不大,而聚合度显著降低[26];而D-KGM与KGM相比,除1 730 cm-1左右的乙酰基峰外消失外,其他峰完全相同,说明用碱处理KGM主要作用在乙酰基上,即将乙酰基脱除,得到D-KGM。
2.2发酵液pH值测定结果

图2 发酵液最终pH值的比较Fig.2 Comparison of pH in final anaerobic fermentation broths
由图2可知,经过24 h发酵,含有不同碳源的发酵液pH值存在一定的差异,其中阴性对照组与D-KGM组pH值最大,KGM组最小。阴性对照组显著高于阳性对照组(P<0.05),而D-KGM组与阴性对照组没有显著性差异,KGM组和KOS组显著低于阳性对照组(P<0.05),且KGM组与KOS组之间pH值差异不显著。发酵液pH值变化与微生物生长代谢密切相关[27],D-KGM组pH值没有显著差异的可能原因是碱处理改变了KGM的结构,使其成为水不溶性物质,肠道微生物较难利用。脱乙酰基引发的魔芋葡甘聚糖对肠道微生物的影响涉及其构效关系,还未见相关的研究报道,也值得后续深入探索。
2.3短链脂肪酸含量
表2 发酵液中短链脂肪酸含Table 2 The contents of short-chain fatty acids (SCFAs) in anaerobic fermentation broths

表2 发酵液中短链脂肪酸含Table 2 The contents of short-chain fatty acids (SCFAs) in anaerobic fermentation broths
注:同行小写字母不同表示差异显著(P<0.05)。
项目阴性对照组阳性对照组KGM组KOS组D-KGM组乙酸含量/(mmol/L)8.526±0.913a22.651±0.831b32.275±1.054c47.267±1.218d10.045±1.278a丙酸含量/(mmol/L)0.432±0.093a1.079±0.087b1.987±0.084c2.175±0.130c0.466±0.098a丁酸含量/(mmol/L)1.285±0.053a2.304±0.060b3.393±0.071c3.513±0.076c1.305±0.069a戊酸含量/(mmol/L)3.151±0.128a5.159±0.123b6.943±0.141c6.853±0.143c3.259±0.119a总酸含量/(mmol/L)13.393±1.187a31.192±1.101b44.597±1.350c59.808±1.567d15.074±1.564a
由表2可知,KGM组、KOS组和阳性对照组发酵液中乙酸、丙酸、丁酸和戊酸均高于阴性对照组(P<0.05),而在各发酵液中乙酸含量最高,戊酸含量次之,丙酸含量最低。另外可以发现D-KGM组乙酸、丙酸、丁酸和戊酸含量均显著低于阳性对照组(P<0.05),与阴性对照组无显著性差异(P>0.05);KOS组与KGM组相比,KOS组中乙酸含量显著高于KGM组(P<0.05),而对于丙酸、丁酸,KOS组均略高于KGM组,KGM组中戊酸较KOS组高,差异不显著(P>0.05)。从总酸含量可以看出,KOS组显著高于其他各组(P>0.05),D-KGM组和阴性对照组不存在显著性差异(P>0.05)。
2.4微生物数量变化
表3 发酵液中微生物相对含量Table 3 Microbial quantities in anaerobic fermentation broth
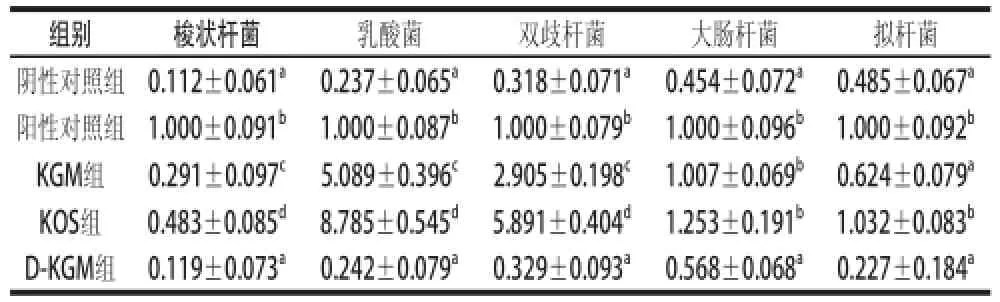
表3 发酵液中微生物相对含量Table 3 Microbial quantities in anaerobic fermentation broth
注:同列小写字母不同表示差异显著(P<0.05)。表中数据是相对阳性对照组的微生物含量。
组别梭状杆菌乳酸菌双歧杆菌大肠杆菌拟杆菌阴性对照组0.112±0.061a0.237±0.065a0.318±0.071a0.454±0.072a0.485±0.067a阳性对照组1.000±0.091b1.000±0.087b1.000±0.079b1.000±0.096b1.000±0.092bKGM组0.291±0.097c5.089±0.396c2.905±0.198c1.007±0.069b0.624±0.079aKOS组0.483±0.085d8.785±0.545d5.891±0.404d1.253±0.191b1.032±0.083bD-KGM组0.119±0.073a0.242±0.079a0.329±0.093a0.568±0.068a0.227±0.184a
由表3可知,KGM组、KOS组和阳性对照组中梭状芽孢杆菌、乳酸菌、双歧杆菌、大肠杆菌和拟杆菌的数量均显著高于阴性对照组(P<0.05),而D-KGM组中的细菌数量与阴性对照组无显著性差异(P>0.05);对于双歧杆菌和乳酸菌来说,KGM组和KOS组均显著高于阳性对照组(P<0.05),KGM组中乳酸菌和双歧杆菌相对含量分别约为阳性对照组的5 倍和3 倍,KOS组中乳酸菌和双歧杆菌的数量分别是阳性对照组的9 倍和6 倍;从KGM和KOS两组比较发现,KOS组中双歧杆菌和乳酸菌的数量都显著高于KGM组(P<0.05),同样的现象也在梭状芽孢杆菌、拟杆菌和大肠杆菌中可以观察到。通过对扩增产物熔解曲线的检验,样品的扩增曲线、熔解曲线较好,不存在杂峰,可以证明实验选用的PCR引物没有非特异性扩增的影响。
3 结 论
本实验通过盲肠内容物体外厌氧发酵,从发酵液pH值、短链脂肪酸、微生物数量来研究KGM及其衍生物--KOS和D-KGM的发酵特性,进而评价其肠道益生作用。
从实验结果可以看出,KGM和KOS对双歧杆菌和乳酸菌有明显的增殖作用,乳酸菌的含量分别为阳性对照的5 倍和9 倍,双歧杆菌为阳性对照组的3 倍和6 倍,远远大于对肠道中潜在的致病菌梭状芽孢杆菌、大肠杆菌和拟杆菌的增殖作用,同时可以促进乙酸、丙酸、丁酸和戊酸的产生,降低发酵液pH值,这些都可以说明KOS 和KGM对肠道健康有潜在积极作用,具有显著的益生功能。
综上所述,以KOS和KGM形式食用,可以很好的发挥肠道益生功能,而以碱处理KGM脱乙酰基得到D-KGM后,这可能是由于碱处理改变了魔芋葡甘聚糖的分子结构,并使其形成较大的颗粒状,难溶于水,使其难以被肠道微生物利用。
[1] 潘廷跳, 陈丽萍, 王博华, 等. 魔芋葡甘聚糖的改性研究进展[J]. 中国粮油学报, 2012, 27(6): 124-128.
[2] LIU Feng, LUO Xuegang, LIN Xiaoyan. Adsorption of tannin from aqueous solution by deacetylated konjac glucomannan[J]. Journal of Hazardous Materials, 2010, 178: 844-850.
[3] KATO K, MATSUDA K. Studies on the chemical structure of konjac glucomannan[J]. Agricultural and Biological Chemistry, 1989, 33:1446-1451.
[4] LI Bin, XIE Bijun. Study on molecular chain morphology of konjac glucomannan[J]. Agricultural Sciences in China, 2003, 2(7): 798-803.
[5] TATIRAT O, CHAROENREIN S. Physicochemical properties of konjac glucomannan extracted from konjac ☒our by a simple centrifugation process[J]. LWT-Food Science and Technology, 2011,44(10): 2059-2063.
[6] 贺珂, 潘志东, 王燕民. 魔芋葡甘聚糖脱除乙酰基的机械力化学效应[J]. 高分子材料科学与工程, 2009, 25(2): 134-137.
[7] 丁保淼, 徐焱春, 熊洪录, 等. 以黄原胶为改良剂的复配胶魔芋豆腐的制备[J]. 食品科技, 2014, 39(1): 65-69.
[8] JIN Weiping, XU Wei, LI Zhenshun, et al. Degraded konjac glucomannan by γ-ray irradiation assisted with ethanol: preparation and characterization[J]. Food Hydrocolloids, 2014, 36: 85-92.
[9] JIN Weiping, MEI Ting, WANG Yuntao, et al. Synergistic degradation of konjac glucomannan by alkaline and thermal method[J]. Carbohydrate Polymers, 2014, 99: 270-277.
[10] MICHAEL L C, JULIE A L, KIERANM T. Konjac glucomannan hydrolysate beneficially modulates bacterial composition and activity within the faecal microbiota[J]. Journal of Functional Foods, 2010, 2:219-224.
[11] ALGHAZZEWI F H, TESTER R F. Efficacy of cellulase and mannanase hydrolysates of konjac glucomannan to promote the growth of lactic acid bacteria[J]. Journal of the Science of Food and Agriculture, 2012, 92: 2394-2396.
[12] AL-GHAZZEWI F H, TESTER R F. Effect of konjac glucomannan hydrolysates and probiotics on the growth of the skin bacterium Propionibacterium acnes in vitro[J]. International Journal of Cosmetic Science, 2010, 32: 139-142.
[13] YEH Shulan, LIN Mengsgen, CHEN Hsiaoling. Partial hydrolysis enhances the inhibitory effects of konjac glucomannan from Amorphophallus konjac C. Koch on DNA damage induced by fecal water in Caco-2 cells[J]. Food Chemistry, 2010, 119(2): 614-618.
[14] ZHANG Yingqing, XIE Bijun, GAN Xin. Advance in the applications of konjac glucomannan and its derivatives[J]. Carbohydrate Polymers,2005, 60: 27-31.
[15] CHUA M, BALDWIN T C, HOCKING T J, et al. Traditional uses and potential health benefits of Amorphophallus konjac K. Kochex N. E. Br.[J]. Journal of Ethnopharmacology, 2010, 128: 268-278.
[16] ALONSO-SANDE M, TEIJEIRO-OSORIO D, OLEA-SAFRINAT, et al. Glucomannan, a promising polysaccharide for biopharmaceutical purposes[J]. European Journal of Pharmaceutics and Biopharmaceutics,2009, 72: 453-462.
[17] 高侃, 汪海峰, 章文明, 等. 益生菌调节肠道上皮屏障功能及作用机制[J]. 动物营养学报, 2013, 25(9): 1936-1945.
[18] ARAYA K, YAESHIMA T, ISHIBASHI N, et al. Inhibitory effects of Bifi dobacterium longum BB536 on harmful intestinal bacteria[J]. Bifidobacteria Microflora, 1995, 14: 59-66.
[19] 刘松珍, 张雁, 张名位, 等. 肠道短链脂肪酸产生机制及生理功能的研究进展[J]. 广东农业科学, 2013(11): 99-103.
[20] 秦清娟, 张媛, 刘倍毓, 等. 半干法酶解制备魔芋葡甘低聚糖工艺及其抗氧化性能研究[J]. 食品工业科技, 2013, 34(23): 186-191.
[21] 周笑犁. 大豆寡糖对肠道微生态与免疫功能的调控作用及机制研究[D]. 南昌: 南昌大学, 2013.
[22] LONGLAND A C, THEODOROU M K, SANDERSON R, et al. Non-starch polysaccharide composition and in vitro fermentability of tropical forage legumes varying in phenolic content[J]. Animal Feed Science Technolo gy, 1995, 55: 161-177.
[23] 国家技术监督局. GB/T 1601-1993 农药pH值的测定方法[S]. 北京: 中国标准出版社, 1993.
[24] 贾益群, 叶福媛, 王双, 等. 生物样品中短链脂肪酸的快速提取与分析方法[J]. 实验室研究与探索, 2012, 31(7): 262-264.
[25] LIVAK K J, SCHMITTGEN T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2-△△CTmethod[J]. Methods, 2001, 25: 402-408.
[26] 邓利玲, 钟耕, 刘倍毓, 等. 半干法酶解制备的魔芋葡甘低聚糖性质[J].食品科学, 2013, 34(15): 115-119. doi: 10.7506/spkx1002-6630-201315024.
[27] 吕娇, 苏昕峰, 方国珊, 等. 果胶改善辣椒素对肠道发酵环境的影响[J].食品科学, 2013, 34(17): 273-277. doi: 10.7506/spkx1002-6630-201317058.
Evaluation of Prebiotic Functions of Konjac Glucomannan and Its Derivatives by Fermentation in vitro
QIN Qingjuan1, DENG Li1, XU Xiaoqing1, WANG Xiaoyan1, ZHONG Geng1,2,3,*
(1. College of Food Science, Southwest University, Chongqing 400716, China; 2. National Undergraduate Experiment Teaching Demonstration Center of Food Science and Engineering, Southwest University, Chongqing 400716, China;3. Chongqing Special Food Engineeri ng Technology Research Center, Chongqing 400716, China)
Objective: To evaluate the prebiotic functions of konjac glucomannan (KGM), konjac oligosaccharides, and deacetyled konjac glucomannan (D-KGM) in the intestine. Methods: Anaerobic fermentation in vitro with the fresh mouse cecum contents was carried out using 1 g/100 mL KGM, KOS and D-KGM as carbon sources, respectively. The pH,bacterial enumeration, and short-chain fatty acids (SCFAs) of the fermented broth were measured. Results: Compared with the positive control (with GLU as carbon source), the pH of the fermented broths with KGM and KOS was much lower. Meanwhile, SCFAs, lactobacilli and bifidobacteria increased significantly, while the potentially pathogenic bacteria(Escherichia coli, Bacterium fusiformis and Bacteroidetes) did not change obviously. The broth of D-KGM presented no obvious difference compared with the negative control (without carbon source). Conclusion: The prebi otic functions of KGM and KOS are conspicuous, but D-KGM has no prebiotic function.
konjac glucomannan (KGM); konjac oligosaccharides (KOS); deacetyled konjac glucomannan (D-KGM);prebiotic function; fermentation in vitro
TS202.1
A
1002-6630(2015)15-0217-04
10.7506/spkx1002-6630-201515040
2014-09-10
重庆市“121”科技示范工程项目(cstc2014zktjccxyyBX0032)
秦清娟(1989—),女,硕士研究生,研究方向为食品科学。E-mail:825681973@qq.com
钟耕(1964—),男,教授,博士后,研究方向为粮食、油脂、植物蛋白。E-mail:zhongdg@126.com
