海带多糖对人肝癌细胞Bel-7402增殖的抑制作用及其机制
2015-11-02姜艳霞纪朋艳朱文赫徐俊杰雷钧涛
姜艳霞,纪朋艳,朱文赫,张 巍,徐俊杰,李 妍,雷钧涛
(1.吉林医药学院生物化学与分子生物学教研室,吉林 吉林 132013;2.吉林医药学院药剂学教研室,吉林 吉林 132013)
海带多糖对人肝癌细胞Bel-7402增殖的抑制作用及其机制
姜艳霞1,纪朋艳1,朱文赫1,张 巍1,徐俊杰1,李 妍1,雷钧涛2
(1.吉林医药学院生物化学与分子生物学教研室,吉林 吉林 132013;2.吉林医药学院药剂学教研室,吉林 吉林 132013)
目的:探讨不同质量浓度的海带多糖对人肝癌细胞Bel-7402增殖的抑制作用。方法:分别以质量浓度为5、10、20、30 mg/mL的海带多糖处理Bel-7402细胞,48 h后观察海带多糖对细胞增殖的抑制情况,Annexin V-FITC试剂盒检测细胞凋亡状况,酶联免疫吸附(enzyme-linked immunosorbent assay,ELISA)法检测Caspase-3活性,Western blotting法检测细胞内Caspase-3和甲胎球蛋白(alpha-fetoprotein,AFP)表达量。结果:海带多糖对Bel-7402细胞的增殖有明显抑制作用,最佳抑制剂量为30 mg/mL;随着海带多糖质量浓度的升高,细胞凋亡率明显增加(P<0.05),海带多糖处理组Bel-7402细胞内的Caspase-3表达水平同正常对照组细胞相比呈上升趋势,差异具有统计学意义(P<0.05);AFP蛋白表达水平呈下降趋势。结论:海带多糖对人肝癌细胞Bel-7402增殖具有抑制作用,其机制可能是激活Caspase-3,引起细胞凋亡和AFP蛋白表达水平下降所致。
海带多糖;细胞凋亡;甲胎球蛋白;Caspase-3
全世界每年新发病的肝癌患者约有60万,居恶性肿瘤的第五位。肝癌是死亡率仅次于胃癌、食道癌的第三大常见恶性肿瘤,初期症状并不明显,晚期主要表现为肝痛、乏力、消瘦、黄疸、腹水等症状。临床上一般采取西医的手术、放化疗与中药结合疗法,但晚期患者因癌细胞扩散而治愈率较低,临床上通过检测甲胎球蛋白(alpha-fetoprotein,AFP)辅助诊断肝癌及判断治疗效果[1-4],寻找一种低毒有效的抗肝癌药物已成为当前治疗肝癌的一个重要研究内容。
海带是一种在低温海水中生长的大型海生褐藻植物,属海藻类植物,是一种营养价值很高的蔬菜,具有一定的药用价值;海带热量低,含有藻胶酸、昆布素、半乳聚糖等多糖类,以及谷氨酸、天冬氨酸、脯氨酸等氨基酸,还含有VB1、VB2、VC、烟酰胺、胡萝卜素等维生素以及碘、钾、钙等无机盐[5-8]。海带具有降血脂、降血糖、调节免疫功能、抗凝血、抗肿瘤、排铅解毒和抗氧化等多种生物功能[9-12]。海带多糖是海带的主要药理成分,宋剑秋等[13]研究发现海带多糖对S180肉瘤小鼠的抑瘤率达86.5%,Menshova等[14]研究显示海带多糖对黑色素瘤细胞SK-MEL-28和结肠癌细胞DLD-1有抑制作用,Ji Chengfeng等[15]研究显示海带多糖对人结肠癌细胞LoVo有抑制作用,但目前还未见海带多糖抗肝癌的研究,本实验以人肝癌细胞Bel-7402为对象,观测不同质量浓度海带多糖对肝癌细胞增殖抑制率的影响,初步探讨海带多糖对人肝癌细胞Bel-7402的作用机制,为海带多糖的深入应用研究提供实验依据。
1 材料与方法
1.1材料与试剂
Bel-7402 细胞 中国医学科学院肿瘤细胞库;海带多糖(纯度95%) 陕西慈缘生物技术有限公司。
RPMI-1640培养基 美国Gibco公司;胎牛血清(fetal bovine serum,FBS) 天津灏洋生物制品科技有限责任公司;AFP抗体、Caspase-3抗体 北京中杉金桥生物技术有限公司;RIPA蛋白质裂解液、二喹啉甲酸(bicinchoninic acid,BCA)试剂盒 碧云天生物技术研究所;蛋白质分子质量Marker 美国Lithuania公司;噻唑蓝(methyl thiazolyl tetrazolium,MTT) 美国Sigma公司;二甲基亚砜(dimethyl sulfoxide,DMSO)天津永大化学试剂开发中心;胰酶 美国Amresco公司;其他试剂均为国产分析纯。
1.2仪器与设备
Model 680酶标仪 美国Bio-Rad公司;DYCZ-24DN型电泳仪 北京六一仪器厂;MCO-18AIC CO2培养箱 日本Sanyo公司;BZ01倒置显微镜 德国莱卡显微镜公司;DL-CJ-IN医用型洁净工作台 北京东联哈尔仪器制造有限公司;FAM1104N型电子天平 上海民桥精密科学仪器有限公司;BXM-30R立式压力蒸汽灭菌器 上海博讯实业有限公司医疗设备厂;Z36HK低温离心机 英国Hermle公司。
1.3方法
1.3.1Bel-7402细胞培养及分组
将人肝癌细胞系Bel-7402细胞培养于含10%胎牛血清、100 U/mL青霉素和 100 U/mL链霉素的RPMI-1640培养基中,置于37 ℃、5% CO2、饱和湿度的细胞培养箱中培养。每周更换培养液2 次,待细胞长至对数生长期,以0.25%胰酶(含有乙二胺四乙酸)消化传代。
后续实验分为5 组:正常对照组(C组)、海带多糖各剂量组(5、10、20、30 mg/mL)。
1.3.2MTT法检测海带多糖对Bel-7402细胞的增殖抑制率[16-17]
取对数生长期的Bel-7402细胞按5×103个/孔的密度接种于96 孔板,每组设6 个复孔。培养24 h后,加入海带多糖使其终质量浓度分别为5、10、20、30 mg/mL,以不加海带多糖的Bel-7402细胞为对照组。培养48 h后,每孔加入5 mg/mL的MTT溶液20 μL,37 ℃孵育4 h,吸弃孔内液体,每孔再加入DMSO 150 μL,振荡10 min,用酶标仪在490 nm波长处检测各孔吸光度A490nm,按照下式计算细胞增殖抑制率。
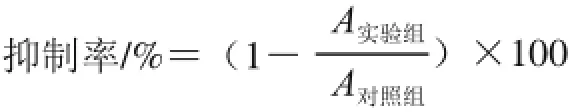
1.3.3Annexin V-FITC/碘化丙啶(propidium iodide,PI)双染色法检测细胞凋亡率[18-20]
将正常对照组及海带多糖各剂量组细胞用胰酶消化后收集于离心管,细胞用磷酸盐缓冲液(phosphate buffered saline,PBS)清洗3 次,按照Ebioscience Annexin VFIFC凋亡试剂盒说明书方法,将细胞重悬于100 μL结合剂中,加入Annexin V-FITC 5 μL,室温闭光孵育1 5 m i n,离心弃去上清液,细胞重悬于200 μL结合剂中,加入10 μL PI,于Nucleo-Counter NC-3000细胞分析仪测定细胞凋亡率。
1.3.4Caspase-3活性测定[21-22]
将正常对照组及海带多糖各剂量组细胞培养液收集于离心管,2 500 r/min离心10 min,取上清液测定Caspase-3活性。将海带多糖各剂量组细胞培养液和包被液按1∶1(V/V)比例加入到96 孔酶标板中,100 μL/孔,4 ℃过夜;正常对照组为100%包被液,以下操作各组相同:吸出孔中液体后加入封闭液,200 μL/孔,37 ℃孵育1.5 h;PBST洗板3 次;加入1∶200(V/V)稀释的一抗,100 μL/孔,37 ℃孵育1.5 h后弃去一抗,PBST洗板3 次;加入1∶1 000(V/V)稀释的二抗,100 μL/孔,37 ℃孵育1.5 h后弃去二抗,PBST洗板3 次;加显色剂100 μL/孔,室温避光孵育3~5 min,当有颜色变化时,加入终止液50 μL/孔,以对照管调零,用酶标仪在490 nm波长处测定吸光度。
1.3.5Western boltting法检测Bel-7402细胞内Caspase-3和AFP蛋白的表达量
以胰酶消化正常对照组及海带多糖各剂量组细胞,1 000 r/min离心5 min离心收集细胞,以PBS洗2 次,用RIPA细胞裂解液冰上裂解30 min,12 000 r/min离心5 min,收集上清液。经BCA法进行蛋白质定量分析,取等量样品以12% SDS-PAGE进行电泳。电泳后将蛋白转印至PVDF膜上,5%脱脂奶粉封闭1 h后,兔抗人Caspase-3和鼠抗人AFP抗体(1∶1 000,V/V)孵育过夜,再以相应的辣根过氧化酶标记的二抗封闭液孵育1 h,用ECL发光液显影,凝胶成像系统进行处理结果,以目标蛋白质与β-actin灰度的比值表示蛋白质的表达水平(相对表达量)。
1.4统计学分析
采用SPSS 16.0统计软件分析数据,结果以±s表示,采用单因素方差分析进行显著性检验,组间比较采用LSD法或Dunnett-t检验,P<0.05为差异具有显著性。
2 结果与分析
2.1海带多糖对Bel-7402细胞增殖的影响
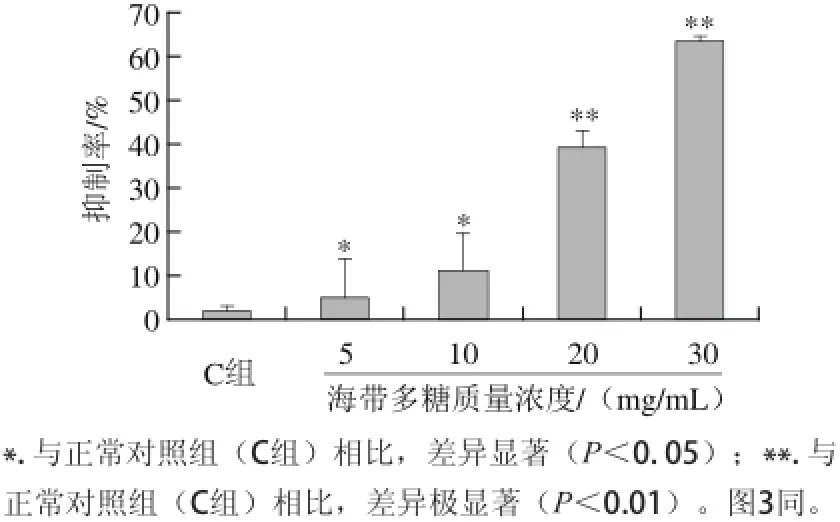
图1 不同质量浓度海带多糖对Bel-7402细胞增殖的抑制作用Fig.1 Inhibitory effect of laminarin at various concentrations on the proliferation of Bel-7402 cells
如图1所示,随着海带多糖质量浓度的增加,其对Bel-7402细胞增殖的抑制作用显著增加,且呈剂量依赖关系,其中30 mg/mL的海带多糖对Bel-7402细胞增殖的抑制作用最明显,抑制率达到了63.36%,与正常对照组(C组)相比,差异极显著(P<0.01)。
2.2海带多糖对Bel-7402细胞形态的影响
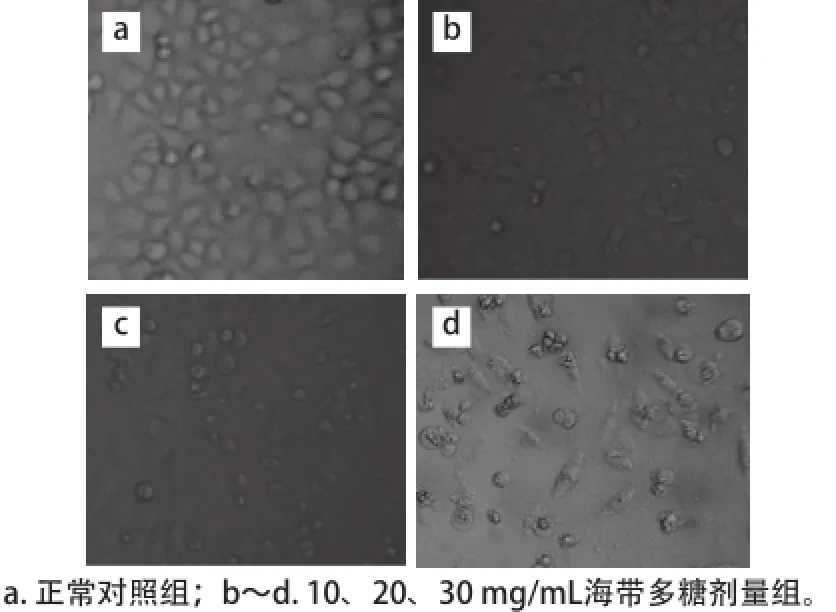
图2 Bel-7402细胞形态学变化(400×)Fig.2 Morphological change of Bel-7402 cells (40×)
如图2所示,正常对照组(图2a)Bel-7402细胞生长状态良好,轮廓清晰,贴壁生长,细胞之间排列紧密;经海带多糖作用后(图2b~2d),Bel-7402细胞生长受到抑制,细胞数量明显减少,体积缩小,细胞固缩变形,随着海带多糖质量浓度的增加,细胞形态发生明显变化,30 mg/mL海带多糖处理的Bel-7402细胞固缩变形最明显。
2.3海带多糖对Bel-7402细胞凋亡的影响
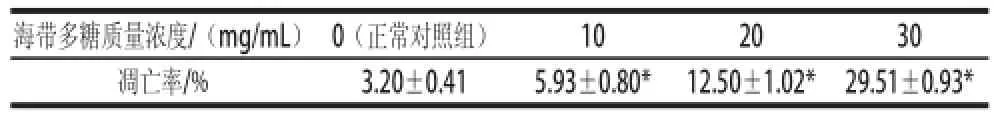
表1 海带多糖对Bel-7402细胞凋亡率的影响Table 1 Effect of laminarin on the apoptosis rate of hepatoma carcinoma Bel-7402 cells
如表1所示,经流式细胞仪检测海带多糖10、20、30 mg/mL剂量组的Bel-7402细胞凋亡率分别为(5.93±0.80)%、(12.50±1.02)%和(29.51±0.93)%,而正常对照组的Bel-7402细胞凋亡率仅为(3.20±0.41)%。与正常对照组相比,海带多糖各剂量组的Bel-7402细胞凋亡率显著升高(P<0.05)。
2.4海带多糖对Bel-7402细胞Caspase-3活性的影响

表2 海带多糖对Bel-7402细胞Caspase-3活性的影响Table 2 Effect of laminarin on the activity of Caspase-3 in hepatoma carcinoma Bel-7402 cells
如表2所示,Bel-7402细胞经过海带多糖处理后,细胞发生凋亡,Caspase-3活性明显升高。正常对照组、海带多糖10、20、30 mg/mL剂量组的Caspase-3活性(A490nm)分别为0.510 3±0.104 5、0.635 3±0.126 4、0.680 3±0.144 8、0.706 3±0.130 5。与正常对照组相比,海带多糖各剂量组的Caspase-3活性显著提高(P<0.05),且呈剂量依赖性。
2.5Bel-7402细胞内AFP和Caspase-3的表达水平
用不同质量浓度海带多糖处理Bel-7402细胞后,观察海带多糖质量浓度的增加对细胞内的蛋白表达的影响。如图3所示,与正常对照组相比,海带多糖20、30 mg/mL剂量组Bel-7402细胞内Caspase-3表达量显著上升,AFP表达量显著下降(P<0.05)。通过Caspase-3/β-actin及AFP/β-actin比较(图3b),变化趋势更明显,表明经海带多糖处理后Bel-7402细胞发生了凋亡。
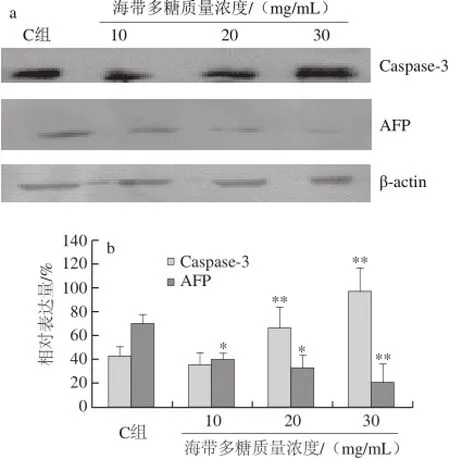
图3 经不同质量浓度海带多糖处理后Bel-7402细胞内Caspase-3和AAFFPP的Western blotting结果(a)和灰度值(bb)Fig.3 Effect of laminarin on electrophoresis (a) and gray value (b) of Caspase-3 and AFP in Bel-7402 cells
3 讨 论
本实验结果显示,海带多糖对Bel-7402细胞增殖具有明显的抑制作用,且随着海带多糖质量浓度的增加,对细胞增殖的抑制作用显著增加,且呈剂量依赖性,30 mg/mL海带多糖对Bel-7402细胞的48 h抑制率达到了63.36%。倒置显微镜下观察,海带多糖各剂量组细胞数量明显减少,细胞体积缩小,皱缩变形,说明海带多糖对人肝癌细胞Bel-7402增殖具有明显的抑制作用,且呈剂量依赖性。
细胞凋亡是由基因控制的细胞自主进行的程序性死亡,它涉及一系列基因的激活、表达以及调控等作用,当细胞凋亡时,细胞膜内侧的磷脂酰丝氨酸翻转到细胞膜的外侧,通过Annexin V-FITC/PI流式双染色法可检测到翻转的磷脂酰丝氨酸[23],通过两种不同荧光标记确定细胞是否凋亡,在本实验中,海带多糖处理后的Bel-7402细胞发生凋亡,随着海带多糖质量浓度的增加,凋亡比例显著提高。Caspase-3是细胞凋亡蛋白酶级联反应的关键酶和执行者[24],本研究分别通过ELISA法和Western blotting法检测海带多糖作用后Bel-7402细胞中Caspase-3表达的变化,结果显示海带多糖作用后,细胞分泌Caspase-3的水平比正常对照组明显升高,为了进一步研究海带多糖对Bel-7402细胞凋亡的作用机制,通过Western blotting检测Bel-7402细胞内AFP的变化,结果表明,海带多糖作用于Bel-7402细胞后,细胞内AFP表达量与正常对照组相比显著降低。AFP可以用作肝癌追踪观察的重要指标[25-26],手术切除或化疗后血清AFP水平明显下降,表示手术或化疗成功,肝癌无转移;过一段时间后若AFP水平重新升高,说明肿瘤可能复发,AFP水平对肝癌的诊断和治疗具有十分重要的意义。本实验结果表明,海带多糖导致Bel-7402细胞凋亡的机制可能与AFP水平的降低有关。综上所述,海带多糖对人肝癌细胞Bel-7402增殖具有抑制作用,其机制可能与诱导Caspase-3表达量升高从而引发细胞凋亡和降低细胞内AFP水平有关,但其具体作用机制还需要进一步深入研究。
[1] 盛家和, 曹伟娟, 焦扬. AFP, 铁蛋白, CEA, CA199的联合检测对原发性肝癌的诊断[J]. 中国卫生检验杂志, 2009(10): 2339-2341.
[2] 贾保昌, 罗小玲, 梁嵘, 等. 联合检测血清GP73和AFP对原发性肝癌诊断价值的探讨[J]. 中华肿瘤防治杂志, 2012, 19(11): 832-835.
[3] 李鹏, 翟云, 刘晖, 等. 血清AFP, GPC3, VEGF, IGF-Ⅱ单独及联合检测对原发性肝细胞癌的诊断价值[J]. 世界华人消化杂志, 2010,18(25): 2702-2706.
[4] 聂荣慧, 刘元元. 肿瘤标志物AFP, CA125, CA199和CEA检测在肝炎, 肝硬化患者诊断和治疗中的应用[J]. 吉林大学学报: 医学版,2012, 38(1): 119-122.
[5] 刘艳如, 李治. 海带的深加工及营养成分分析[J]. 食品工业科技,1998, 19(2): 54.
[6] 王利群, 董英. 海带的营养保健功能及其开发前景[J]. 包装与食品机械, 1999, 17(1): 28-31.
[7] 金嫘, 王宏. 海带的营养与保健[J]. 中国食物与营养, 2001(1): 41-42.[8] 曹小华. 海带的营养作用及其在水产动物生产中的应用[J]. 广东饲料, 2014(2): 39-41.
[9] 刘军, 罗琼, 阎俊, 等. 海带多糖对慢性局部电离辐射致大鼠睾丸细胞损伤的干预效应研究[J]. 营养学报, 2011, 33(1): 61-65.
[10] 孙文忠, 魏媛媛, 曾曼丽, 等. 海带多糖对人鼻咽癌HONE1细胞裸鼠移植瘤的抑制及凋亡相关基因的调控[J]. 实用医学杂志, 2013,29(4): 535-537.
[11] 姜文, 王亚男, 于竹芹, 等. 海带多糖对在2型糖尿病小鼠血糖水平的影响[J]. 临床医学工程, 2012, 19(9): 1465-1466.
[12] 丁国玉, 黄连光, 安斌, 等. 海带多糖降血脂, 血糖研究[J]. 保健医学研究与实践, 2010 (4): 10-11.
[13] 宋剑秋, 徐誉泰, 张华坤, 等. 海带硫酸多糖对小鼠腹腔巨噬细胞的免疫调节作用[J]. 中国免疫学杂志, 2000, 16(2): 70.
[14] MENSHOVA R V, ERMAKOVA S P, ANASTYUK S D, et al. Structure, enzymatic transformation and anticancer activity of branched high molecular weight laminaran from brown alga Eisenia bicyclis[J]. Carbohydrate Polymers, 2014, 99: 101-109.
[15] JI Chenfeng, JI Yubin, MENG Deyou. Sulfated modification and anti-tumor activity of laminarin[J]. Experimental and Therapeutic Medicine, 2013, 6(5): 1259-1264.
[16] 司徒镇强, 吴军正. 细胞培养[M]. 北京: 世界图书出版公司, 2007: 138.[17] 章静波. 组织和细胞培养技术[M]. 2版. 北京: 人民卫生出版社,2011: 106.
[18] 姜艳霞, 芦晓静, 徐俊杰, 等. 越橘花色苷对宫颈癌Hela细胞凋亡及抗氧化能力的影响[J]. 上海中医药杂志, 2011, 45(9): 62-65.
[19] 庞雪芹, 陈卫昌, 李锐, 等. CD40配体激活抑制胃癌细胞生长机制的实验研究[J]. 苏州大学学报: 医学版, 2006, 26(3): 354-357.
[20] 郑弘, 毕勇毅, 王群, 等. 阿魏酸钠对ox-LDL诱导人脐静脉内皮细胞凋亡及p53蛋白表达的影响[J]. 现代预防医学, 2010, 37(21): 4110-4113.
[21] 齐玲, 温娜, 杨淑艳, 等. 顺铂对胶质瘤神经球的凋亡诱导作用及其机制[J]. 吉林大学学报: 医学版, 2013(6): 1108-1111.
[22] 朱文赫, 张巍, 李妍, 等. 微波辐射对人胰腺癌JF305细胞增殖的抑制作用及其机制[J]. 卫生研究, 2013, 42(6): 1008-1011.
[23] 吴建勇, 赵德璋. 流式细胞仪检测细胞凋亡的几种方法的比较[J].重庆医科大学学报, 2010, 35(9): 1386-1389.
[24] CURTIN J F, DONOVAN M, COTTER T G. Regulation and measurement of oxidative stress in apoptosis[J]. Journal of Immunological Methods, 2002, 265(1): 49-72.
[25] CARR B I, GUERRA V, GIANNINI E G, et al. Low alpha-fetoprotein HCC and the role of GGTP[J]. The International Journal of Biological Markers, 2013, 29(4): e395-e402. doi: 10.5301/jbm.5000092.
[26] CRISSIEN A M, FRENETTE C. Current management of hepatocellular carcinoma[J]. Gastroenterology & Hepatology, 2014,10(3): 153-161.
Inhibitory Effect and Mechanism of Laminarin on Proliferation of Human Hepatoma Carcinoma Bel-7402 Cells
JIANG Yanxia1, JI Pengyan1, ZHU Wenhe1, ZHANG Wei1, XU Junjie1, LI Yan1, LEI Juntao2
(1. Department of Biochemistry and Molecular Biology, Jilin Medical University, Jilin 132013, China;2. Department of Pharmacy, Jilin Medical University, Jilin 132013, China)
Objective: To examine the inhibitory effect of different concentrations of laminarin on proliferation of human hepatoma carcinoma Bel-7402 cells. Methods: Bel-7402 cells were cultured with different concentrations of laminarin for 48 h. The inhibitory effect of laminarin on the proliferation of Bel-7402 cells was evaluated by MTT (methyl thiazolyl tetrazolium) assay. Cell apoptosis was detected using Annexin V-FITC Kit. The activity of Caspase-3 was examined by enzyme-linked immunosorbent assay (ELISA). The expression of Caspase-3 and alpha-fetoprotein (AFP) was detected by Western blotting. Results: Laminarin inhibited the proliferation of Bel-7402 cells in a concentration-dependent manner with an optimal concentration of 30 mg/mL. The increased concentration of laminarin could accelerate the apoptosis rate of cells (P < 0. 05). Caspase-3 activity significantly increased in the treatment groups when compared with the control group(P < 0.05). The expression of Caspase-3 increased significantly and AFP expression decreased significantly in the treatment groups. Conclusion: Laminarin can inhibit the proliferation of Bel-7402 cells, and the mechanism may be associated with cell apoptosis caused by the activation of Caspase-3, and reduced expression of AFP.
laminarin; cell apoptosis; alpha-fetoprotein (AFP); Caspase-3
R735.7
A
1002-6630(2015)15-0179-04
10.7506/spkx1002-6630-201515033
2014-09-08
吉林省教育厅“十二五”科学技术研究项目(吉教科合字2013-350);吉林省科技发展计划项目(20140101142JC)
姜艳霞(1969—),女,副教授,硕士,主要从事天然药物成分抗肿瘤研究。E-mail:jiangyx123@163.com
