干燥方法对苦瓜降糖成分含量的影响
2015-11-02秦樱瑞黄先智曾艺涛丁晓雯
秦樱瑞,黄先智,曾艺涛,杨 娟,丁晓雯,*
(1.西南大学食品科学学院,重庆市农产品加工及贮藏重点实验室,重庆 400716;2.家蚕基因组生物学国家重点实验室,重庆 400716)
干燥方法对苦瓜降糖成分含量的影响
秦樱瑞1,黄先智2,曾艺涛1,杨 娟1,丁晓雯1,*
(1.西南大学食品科学学院,重庆市农产品加工及贮藏重点实验室,重庆 400716;2.家蚕基因组生物学国家重点实验室,重庆 400716)
通过探讨不同干燥方式对苦瓜降糖成分含量的影响,为苦瓜保健食品生产提供一种较为理想的干燥方式。采用双缩脲法测定苦瓜多肽含量、苯酚-硫酸法测定苦瓜多糖含量、分光光度法测定苦瓜皂苷含量。结果表明:冷冻干燥的苦瓜颜色最好,主要降糖成分破坏较少;微波干燥的苦瓜颜色最差,且降糖成分破坏较多;真空干燥苦瓜所需时间较长,与热风干燥相比,苦瓜降糖成分破坏较多且颜色较差。60 ℃热风干燥8 h的苦瓜品质较好,主要降糖成分皂苷含量为(2.31±0.11)%,与冷冻干燥相比无显著差异(P>0.05),多糖含量为(7.43±0.04)%,显著高于冷冻干燥的苦瓜,多肽含量为(0.11±0.06)%,显著低于冷冻干燥的苦瓜。同时通过体外实验可知,干燥后的苦瓜粉对α-葡萄糖苷酶和α-淀粉酶具有明显的抑制作用。热风干燥法能较好地保存苦瓜的降糖成分,适宜用于苦瓜加工过程的干燥。
苦瓜;干燥;皂苷;多糖;多肽
苦瓜(Momordica charantia L.)别名凉瓜、癞瓜、锦荔枝,为葫芦科(Cueurbitaceae)苦瓜属攀援性草本植物,广泛分布于温带、亚热带和热带地区[1]。国内外大量研究表明,苦瓜具有降血糖、抗病毒、抗癌、抗生育、增强免疫力等功能[2],其中降血糖的作用尤其受到人们的关注。
近年来,国内外学者对苦瓜中皂苷类、多糖和多肽等降糖活性成分进行了大量的研究[3-5]。盛清凯等[6]从苦瓜中分离得到苦瓜多肽-P,皮下注射该多肽于糖尿病小鼠,2 h后尾静脉取血测定血糖值,发现注射苦瓜多肽-P能够显著降低糖尿病小鼠血糖值。董英等[7]分别采用水和碱溶剂提取苦瓜多糖,再分别给予链脲霉素诱导的糖尿病小鼠,发现苦瓜的碱提取物能够降低糖尿病小鼠的血糖值,提高口服葡萄糖的耐受量。石雪萍等[8]研究了苦瓜皂苷的降糖机理,发现苦瓜皂苷对α-葡萄糖苷酶的活力没有抑制作用,但能够显著提高正常和糖尿病小鼠口服葡萄糖的耐受量,恢复胰岛β细胞的活力,刺激肝糖原的合成同时抑制肝糖原的释放。
苦瓜口味较苦,许多消费者难以接受,且货架期相对较短,目前主要是鲜食,这让苦瓜的开发利用受到了极大的限制[9]。目前苦瓜主要被加工成低糖蜜饯、苦瓜汁或苦瓜茶[10]。在苦瓜加工过程中,干燥处理是一项非常重要的方式。本实验研究用不同的干燥方法处理苦瓜,比较干燥前后苦瓜中皂苷类、多糖和多肽等降糖成分的变化,以选择最优的干燥方法,为苦瓜降糖保健食品开发过程中干燥方式的选择提供较为理想的方法。
1 材料与方法
1.1材料与试剂
菠萝苦瓜,购于北碚雄风超市。
人参皂苷(纯度≥98%) 中国药品生物制品检定所;甘氨酸-甘氨酸-酪氨酸-精氨酸(Gly-Gly-Tyr-Arg)四肽(纯度≥97%)、α-葡萄糖苷酶(酶活力37.6 U/mg)、α-淀粉酶(酶活力1 144 U/mg)、4-硝基苯-α-D-吡喃葡萄糖苷(4-nitrophenyl-α-D-glucopyranoside,PNPG) 美国Sigma公司;D-葡萄糖、苯酚、三氯乙酸等常用试剂均为分析纯。
1.2仪器与设备
S22分光光度计 上海棱光技术有限公司;5810型台式高速离心机 德国Eppendor公司;GZX-9140MBE电热鼓风干燥机 上海博讯实业有限公司;DZF-6021真空干燥箱 上海齐欣科学仪器有限公司;WD700(MG-5033M)LG微波炉 天津乐金电子电器有限公司;SCANLAF Coolsafe55-4真空冷冻干燥机 香港基因有限公司。
1.3方法
1.3.1苦瓜前处理
将苦瓜清洗、去籽、去瓤、去两头,切成厚约0.2 cm的片备用。
1.3.2苦瓜干燥处理
为使苦瓜干燥后水分含量在安全水分含量(14%)以下[11],经过预实验,选取不同的干燥参数对苦瓜进行干燥处理。
1.3.2.1热风干燥
分别称取3 份苦瓜片,每份400 g左右,平铺于托盘中,在鼓风干燥机中干燥。干燥条件分别为45 ℃,18 h;60 ℃,8 h;75 ℃,5.5 h。将干燥后的苦瓜粉碎测定相关指标。
1.3.2.2微波干燥
分别称取3 份苦瓜片,每份150 g左右,平铺于玻璃盘中,在微波炉中干燥。干燥条件分别为微波功率280 W,50 min;420 W,30 min;560 W,25 min。将干燥后的苦瓜粉碎测定相关指标。
1.3.2.3冷冻干燥
分别称取3 份苦瓜片,每份300 g左右,采用苦瓜片直接冻干、苦瓜片85 ℃烫漂3 min后冻干、苦瓜片打浆后冻干、苦瓜片85 ℃烫漂3 min打浆后冻干。冻干条件:-80 ℃预冻12 h,再进行真空冷冻干燥,冷阱温度-50 ℃左右,真空度0.025 MPa,干燥24 h。将干燥后的苦瓜粉碎测定相关指标。
1.3.2.4热风联合真空干燥
称取400 g左右苦瓜片,平铺于托盘中,先在鼓风干燥机中干燥,干燥条件为45 ℃,6.5 h;60 ℃,4 h;75 ℃,2.5 h。然后进行真空干燥,干燥条件为45 ℃,16 h;60 ℃,11 h;75 ℃,9 h。真空度控制在0.09~0.1 MPa之间。将干燥后的苦瓜粉碎测定相关指标。
1.3.3苦瓜水分含量的测定
按照GB 5009.3-2010 《食品中水分的测定》[12]中直接干燥法测定。
1.3.4苦瓜降糖成分含量的测定
1.3.4.1苦瓜皂苷含量的测定
[13]的方法。测定不同质量浓度的人参皂苷标准溶液吸光度,以人参皂苷质量浓度为横坐标,吸光度为纵坐标绘制标准曲线,得到回归方程为y = 0.004 6x-0.013 8(R2= 0.999 5)。测定苦瓜皂苷吸光度,代入回归方程计算其皂苷含量。
1.3.4.2苦瓜多糖含量的测定
参考文献[14-15]的苯酚-硫酸法并略加修改。测定不同质量浓度的葡萄糖标准溶液吸光度,以葡萄糖质量浓度为横坐标,吸光度为纵坐标绘制标准曲线,得到回归方程为y = 0.030 1x+0.013 5(R2= 0.999 8)。称取苦瓜粉末1.0 g左右,加体积分数为80%的乙醇20 mL,90 ℃水浴回流1 h,趁热抽滤,滤渣用80%热乙醇洗涤(10 mL×2)。挥干乙醇后,滤渣连同滤纸置于烧瓶中,加30 mL蒸馏水,90 ℃水浴浸提l h,趁热过滤,滤渣重复提取1 次,合并滤液,以蒸馏水定容100 mL,摇匀。移取10 mL滤液于50 mL容量瓶中,以蒸馏水定容至刻度,摇匀备用。吸取所得样品溶液0.2 mL于具塞试管中,再加5%的苯酚溶液0.4 mL,摇匀,同时迅速滴加浓硫酸2.00 mL,摇匀后室温放置30 min,于490 nm波长处测定吸光度,代入回归方程计算苦瓜粉中葡萄糖含量。
1.3.4.3苦瓜多肽含量的测定
采用双缩脲法[16]。测定不同质量浓度的Gly-Gly-Tyr-Arg四肽标准溶液的吸光度,以四肽溶液质量浓度为横坐标,吸光度为纵坐标绘制标准曲线,得到回归方程为y = 0.472 9x+0.012 8(R2= 0.999 5)。称取1.0 g左右的苦瓜粉,加入质量分数10%的三氯乙酸20 mL,静置30 min后过滤,滤液用5%的三氯乙酸定容至50 mL,于540 nm波长处测定吸光度,代入回归方程计算苦瓜粉多肽含量。
1.3.5苦瓜粉颜色评定
组织5 人评定小组对苦瓜粉的颜色进行感官评价。以最接近新鲜苦瓜者得分最高,采用1~6 分评分法,褐色(1 分),黄褐色(2 分),黄色(3 分),褐绿色(4 分),黄绿色(5 分),绿色(6 分),色泽位于两者之间的酌情给分。
1.3.6苦瓜提取液的制备
称取不同剂量的苦瓜粉,放入蓝盖瓶中,加入40 mL 70%的乙醇溶液,60 ℃条件下超声提取40 min,抽滤,滤液用旋转蒸发仪蒸干后加入50 mL质量分数50%的二甲基亚砜溶液50 mL得提取液A。过滤后的滤渣再加入25 mL蒸馏水,90 ℃水浴回流提取1 h,过滤。滤渣重复提取1 次,合并滤液,蒸馏水定容至50 mL得提取液B[13-15]。
1.3.7苦瓜粉提取物对α-葡萄糖苷酶的抑制作用测定
参照文献[17-18]的方法并略作修改。在37 ℃反应体系中依次加入0.1 mol/L pH 6.8磷酸盐缓冲溶液3.0 mL、5 U/mL的α-葡萄糖苷酶液20 μL(0.1 mol/L pH 6.8的磷酸盐缓冲溶液配制),同时加入样品A、B各100 μL,每次测定的总体积为3.12 mL。把以上试液混匀后放入37 ℃恒温水浴中平衡15 min,然后加入100 μL 2.5 mmol/L的PNPG(0.1 mol/L pH 6.8的磷酸盐缓冲溶液配制)启动反应,恒温反应15 min后,加入5 mL 1 mol/L的Na2CO3终止反应,于400 nm波长处测定吸光度。同时做相同体系下的样品空白组(蒸馏水代替样品,加入Na2CO3后再加入PNPG)、样品对照组(蒸馏水代替样品,加入PNPG后再加入Na2CO3)、样品颜色干扰组(样品加入Na2CO3后再加入PNPG)。α-葡萄糖苷酶抑制率计算公式如下。
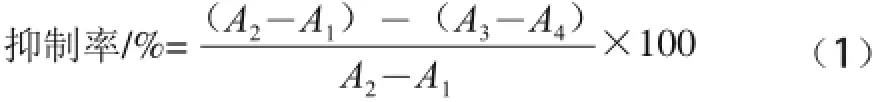
式中:A1为样品空白组吸光度;A2为样品对照组吸光度;A3为样品组吸光度;A4为样品颜色干扰组吸光度。
1.3.8苦瓜粉提取物对α-淀粉酶的抑制作用测定
参考文献[19-21]的方法,并略加修改。在37 ℃反应体系中依次加入200 μL 125 U/mL α-淀粉酶液 (0.1 mol/L pH 6.8的磷酸盐缓冲溶液配制),样品A、B各100 μL,置于37 ℃恒温水浴中平衡5 min,然后加入质量分数为1%可溶性淀粉500 μL启动反应,恒温反应5 min后加入500 μL 3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)显色剂,沸水浴5 min显色,然后立即加入冰水浴冷却,定容至25 mL后于540 nm波长处测定吸光度。同时做相同体系下的样品空白组(蒸馏水代替样品),样品颜色干扰组(蒸馏水代替酶液)。α-淀粉酶抑制率计算公式如下。
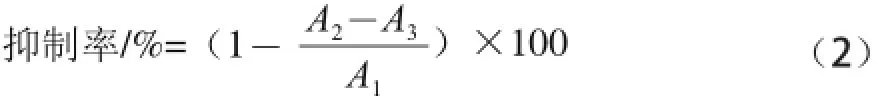
式中:A1为样品空白组吸光度;A2为样品组吸光度;A3为样品颜色干扰组吸光度。
2 结果与分析
2.1热风干燥对苦瓜中水分及降糖成分含量的影响
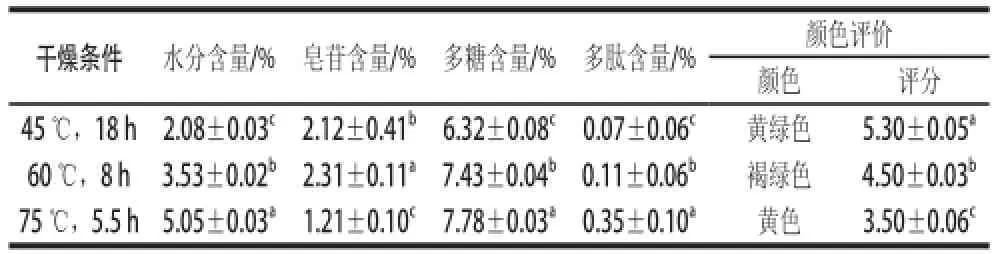
表1 热风干燥对苦瓜中水分及降糖成分含量的影响Table 1 Effect of hot air drying on the contents of moisture and hypoglycemic components in Momordica charantia L.
由表1可知,苦瓜经60 ℃干燥8 h时皂苷的含量最高为(2.31±0.11)%,多糖含量也较高,为(7.43±0.04)%;75 ℃干燥5.5 h,苦瓜皂苷含量最低,仅为(1.21±0.10)%,这可能是因为温度较高,使苦瓜皂苷遭到破坏[22];45 ℃干燥18 h,苦瓜水分、皂苷、多糖和多肽含量分别为(2.08±0.03)%、(2.12±0.41)%、(6.32±0.08)%和(0.07±0.06)%,与在60 ℃干燥8 h相比均显著下降(P<0.05)。
通过对得到的苦瓜粉进行颜色评定可知,当干燥温度为45 ℃时苦瓜粉为黄绿色,得分5.30±0.05;60 ℃时呈褐绿色,得分4.50±0.03;75 ℃时为黄色,得分3.50±0.06。这可能是在干燥过程当中由于水、酶、氧化反应和较高温度共同作用而引起的氧化性褐变、酶褐变以及热对色素的分解等所致[23]。
在苦瓜中皂苷的降糖效果要优于多糖和多肽[24],因此从苦瓜主要降糖成分含量、颜色考虑,热风干燥选择60 ℃为宜。
2.2微波干燥对苦瓜中水分及降糖成分含量的影响
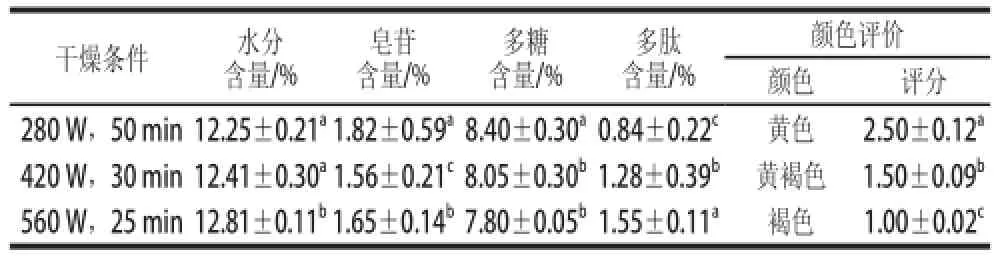
表2 微波干燥对苦瓜中水分及降糖成分含量的影响Table 2 Effect of microwave drying on the contents of moisture and hypoglycemic components in Momordica charantia L.
由表2可知,微波干燥的苦瓜粉水分含量都较高,在12%左右,符合安全水分含量要求(<14%)。主要降糖物质皂苷的含量较热风干燥低,其中280 W处理50 min时皂苷含量最高,为(1.82±0.59)%,这可能是因为微波干燥使苦瓜组织温度过高,导致皂苷分解[22]。微波干燥的苦瓜粉多糖和多肽含量较高,当280 W处理50 min时,多糖、多肽含量分别为(8.40±0.30)%和(0.84±0.22)%;当560 W处理25 min时,多糖、多肽含量分别为(7.80±0.05)%和(1.55±0.11)%。
微波干燥的苦瓜粉颜色较差,280 W时呈现黄色,得分2.50±0.12;420 W时呈黄褐色,得分1.50±0.09,560 W时为褐色,得分1.00±0.02。这可能是因为苦瓜中的糖类物质发生了导致褐变的美拉德反应及焦糖化现象所致[23],同时微波干燥使苦瓜受热不均,导致苦瓜的局部温度过高而引起不同程度的烧焦、发泡现象。
从以上分析可知,微波功率为280 W、干燥50 min时所得产品的品质相对较好。
2.3冷冻干燥对苦瓜中水分及降糖成分含量的影响
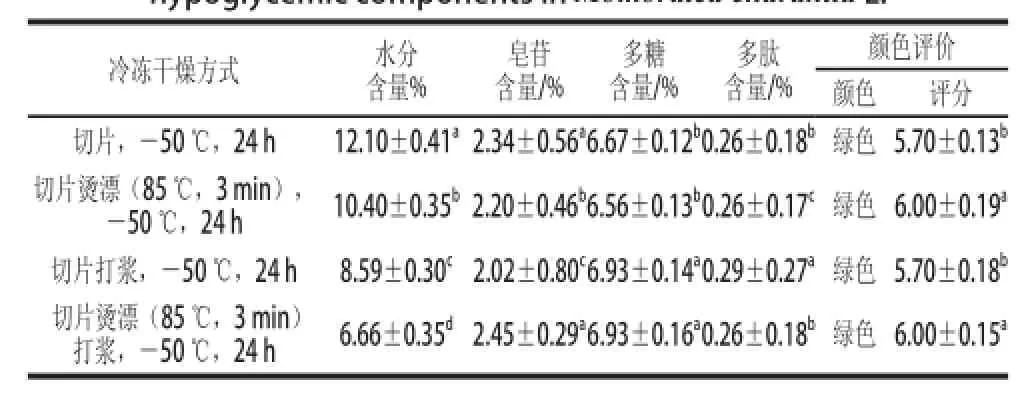
表3 冷冻干燥对苦瓜中水分及降糖成分含量的影响Table 3 Effect of freeze drying on the contents of moisture and hypoglycemic components in Momordica charantia L.
由表3可知,通过不同方式前处理的苦瓜,在相同的冷冻干燥条件下其水分含量范围为6.66%~12.10%,相差较大,但均低于14%的安全水分含量。4 种不同前处理的苦瓜经冷冻干燥后各降糖成分含量的变化不大,烫漂(85 ℃,3 min)打浆然后冷冻干燥的苦瓜其皂苷和多糖的含量最高,分别为(2.45±0.29)%和(6.93±0.16)%;多肽的含量均较低,其中打浆后冷冻干燥的苦瓜其多肽含量最高,仅为(0.29±0.27)%。
通过对苦瓜粉颜色的评价可知,冷冻干燥的苦瓜粉颜色翠绿,与新鲜的苦瓜最为接近,且经烫漂处理的较未烫漂的好,这可能是因为烫漂后苦瓜中的多酚氧化酶被钝化所致。
从苦瓜各降糖成分的含量、颜色、水分含量综合考虑,烫漂(85 ℃,3 min)打浆后再冷冻干燥为最好方式。
2.4热风联合真空干燥对苦瓜中水分及降糖成分含量的影响
真空干燥是以热传导为主的干燥方式,虽然干燥温度低,但干燥时干燥室内对流传热几乎不存在,并且新鲜的苦瓜的水分含量较高(94.62±0.45)%,干燥箱内水分不易排出,使干燥速率大大降低,干燥时间消耗较长[25-26],因此本实验结合热风与真空2 种干燥方式对苦瓜进行干燥。
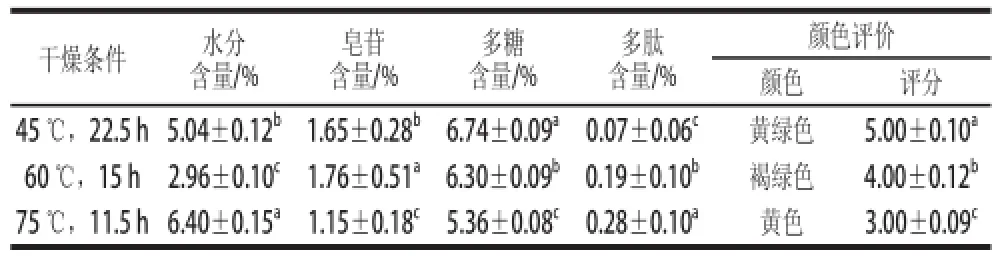
表4 热风联合真空干燥对苦瓜中水分及降糖成分含量的影响Table 4 Effect of hot air plus vacuum drying on the contents of moisture and hypoglycemic components in Momordica charantia L.
由表4可知,采用热风联合真空组合的干燥方式与单独使用热风干燥相比,消耗的时间较长,且水分含量在2.96%~6.40%,略高,但远远低于14%的安全水分含量。60 ℃干燥15 h苦瓜粉中皂苷的含量最高,为(1.76±0.51)%,而45 ℃干燥22.5 h时苦瓜多糖的含量最高,为(6.74±0.09)%。多肽的含量均较低,在75 ℃干燥11.5 h后,多肽含量最高,为(0.28±0.10)%。
通过对苦瓜颜色评价发现,45 ℃和60 ℃时干燥的苦瓜粉颜色分别为黄绿色和褐绿色,较好。
从苦瓜各降糖成分的含量、颜色以及生产成本考虑,热风联合真空组合方式干燥苦瓜,选择60 ℃干燥15 h最适宜。
2.54 种干燥方法的综合比较
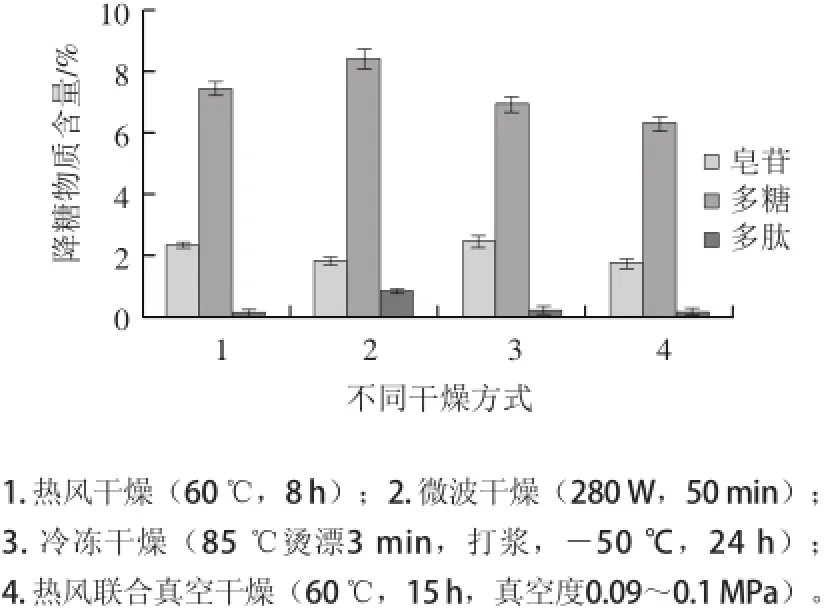
图1 不同的干燥方法对苦瓜中降糖物质含量的影响Fig.1 Effects of different drying methods on the contents of hypoglycemic substances in balsam pear
通过对以上4 种干燥方式的分析比较,各选取其中最好的干燥方式进行比较。苦瓜皂苷的降糖效果要优于多糖和多肽[8],因此以苦瓜皂苷的含量作为评价最佳干燥方式的最主要指标,其次为多糖。
由图1可知,冷冻干燥所得苦瓜粉其皂苷含量最高为(2.45±0.29)%,多糖含量为(6.93±0.16)%,保留的主要降糖成分最多,颜色也最好。但是,冷冻干燥耗能大、时间最长,成本较高,且干燥好的苦瓜粉久置后颜色也会逐渐偏黄。因此不是苦瓜干燥的首选方式。
微波干燥苦瓜虽然时间最短,多糖和多肽的含量最高,分别为(8.40±0.30)%和(0.84±0.22)%,但苦瓜皂苷含量为(1.82±0.59)%,与冷冻干燥相比显著降低(P<0.05);水分含量较高,不耐贮存;并且所得苦瓜粉的颜色较差,易出现烧焦、发泡等现象。虽然微波干燥所用的时间短,但是微波干燥的载物量对其干燥速度的影响较大,随着载物量的增加,干燥时间会相应延长[27],成本也会相应增加。因此,苦瓜干燥不适宜选择微波干燥方式。
热风联合真空干燥苦瓜的时间较长,苦瓜皂苷含量为(1.76±0.51)%,与冷冻和热风干燥的苦瓜皂苷含量相比显著降低(P<0.05),同时其多糖、多肽含量分别为(6.30±0.09)%和(0.19±0.10)%,含量较低;并且所得苦瓜产品的颜色呈褐绿色略偏黄,较差。从产品的各降糖成分的含量、经济成本以及颜色考虑,热风联合真空组合干燥方式也不宜用于苦瓜的干燥。
当热风干燥的温度为60 ℃处理苦瓜8 h,其苦瓜皂苷的含量为(2.31±0.11)%,与冷冻干燥的相比无显著性差异(P>0.05),且多糖的含量为(7.43±0.04)%,显著高于冷冻干燥的(6.93±0.16)%。虽然所得产品的多肽含量是本研究的4 种干燥方式中最低的,为(0.11±0.06)%,但是由于苦瓜多肽的降糖效果要低于皂苷和多糖,因此,对降糖效果的影响不大。并且热风干燥的苦瓜颜色也较好,呈褐绿色。因此,把热风干燥作为苦瓜较为理想的干燥方式。
2.6热风干燥苦瓜粉提取物对α-葡萄糖苷酶的抑制作用
α-葡萄糖苷酶能催化水解α-1,4-糖苷键,是小肠内蔗糖、麦芽糖等寡糖的水解酶,抑制α-葡萄糖苷酶的活性可减缓葡萄糖的生成及吸收,调整血糖水平,降低餐后血糖峰值,降低高血糖对胰腺的刺激,提高胰岛素敏感性,从而保护胰腺功能[28]。通过提取不同剂量苦瓜粉中的降糖成分进行实验,结果如图2所示。
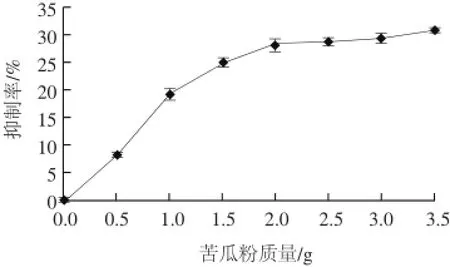
图2 不同剂量的苦瓜粉对α-葡萄糖苷酶活性的影响Fig.2 Effects of different doses of balsam pear powder on alphaglycosidase activity
由图2可知,随着苦瓜粉剂量的增加,对α-葡萄糖苷酶的抑制作用也逐渐增加。当苦瓜粉剂量在0~2.0 g之间时,存在明显的剂量依赖关系,随着剂量的增加,抑制效果也显著增加;苦瓜粉剂量在2.0~3.5 g之间时,抑制率无明显增加。
2.7热风干燥苦瓜粉提取物对α-淀粉酶的抑制作用
α-淀粉酶是一种糖苷水解酶,抑制α-淀粉酶能够有效抑制肠道内唾液及胰淀粉酶的活性,从而降低血糖和血脂的含量[29]。通过提取不同剂量的苦瓜粉中的降糖成分进行实验,结果如图3所示。
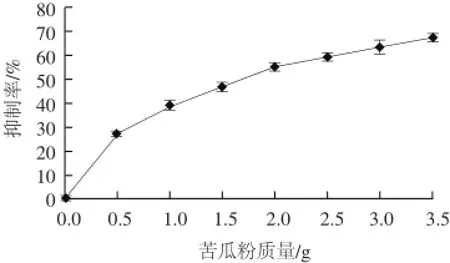
图3 不同剂量的苦瓜粉对α-淀粉酶活性的影响Fig.3 Effects of different doses of balsam pear powder on alphaamylase activity
由图3可知,苦瓜粉与α-淀粉酶的抑制率之间存在明显的剂量依赖关系。随着苦瓜粉剂量的增加,抑制率也增加,但抑制率的增加呈逐渐变缓的趋势,当苦瓜剂量为3.5 g时,α-淀粉酶的抑制率可达67.05%。由此可以得出苦瓜粉提取物对α-淀粉酶活性有很明显的抑制作用。
3 结 论
考察不同干燥方式对苦瓜降糖成分含量的影响,结果发现:热风干燥的最佳条件为干燥温度60 ℃,干燥时间8 h;微波干燥的最佳条件为干燥功率280 W,干燥时间50 min;冷冻干燥的最佳条件为新鲜的苦瓜切片,在85 ℃温度下烫漂3 min后打浆,再在-80 ℃预冷12 h,然后进行真空冷冻干燥,干燥时冷阱的温度在-50 ℃左右,真空度在保持在0.025 MPa,干燥24 h;热风联合真空组合干燥的最佳条件为先60 ℃热风干燥4 h,然后再真空干燥11 h,真空度保持在0.09~0.1 MPa之间。通过对以上4 种干燥方式的比较和综合分析,认为热风干燥(60 ℃,8 h)是苦瓜的一种较为理想的干燥方式,所得苦瓜粉的颜色较好,水分含量最低为(1.22±0.01)%,苦瓜皂苷含量为(2.31±0.11)%,多糖含量为(7.43±0.04)%,多肽含量为(0.11±0.06)%。同时通过测定苦瓜粉对α-葡萄糖苷酶和α-淀粉酶的抑制作用可知,干燥后的苦瓜粉未失去降糖作用。
参考文献:
[1] 于滨, 马晓燕, 李丹丹, 等. 苦瓜降血糖成分及机制研究进展[J]. 中国果菜, 2013(3): 47-51.
[2] CHOUDHARY S K, CHHABRA G, SHARMA D, et al. Comprehensive evaluation of anti-hyperglycemic activity of fractionated Momordica charantia seed extract in alloxan-induced diabetic rats[J]. Evidence-Based Complementary and Alternative Medicine, 2012. http://dx.doi.org/10.1155/2012/293650.
[3] LOK L C, SIRN M D Y Y, AHMAD M D Z, et al. Effects of polypeptide-k supplemented soft bun on blood glucose level in healthy adults[J]. International Journal of Nutrition and Metabolism, 2011,3(1): 7-10.
[4] 宋金平. 苦瓜多糖对糖尿病小鼠的降糖作用和胰岛素水平的影响[J].中国实用医药, 2012, 7(3): 250-251.
[5] 陈松瑞, 陈炜, 张德新. 苦瓜皂甙与黄连素混合物对Ⅱ型糖尿病小鼠的降血糖作用[J]. 数理医药学杂志, 2013, 26(2): 207-209.
[6] 盛清凯, 姚惠源. 苦瓜多肽-P的分离及其降糖活性[J]. 无锡轻工大学学报, 2005, 24(1): 49-51.
[7] 董英, 张慧慧. 苦瓜多糖降血糖活性成分的研究[J]. 营养学报, 2008,30(1): 15-17.
[8] 石雪萍, 姚惠源. 苦瓜皂甙降糖机理研究[J]. 食品科学, 2008, 29(2):81-83.
[9] 江英, 胡小松, 生吉萍. 不同干燥方法对苦瓜粉品质的影响[J]. 食品研究与开发, 2002, 23(2): 53-54.
[10] 苏技. 苦瓜加工方法[J]. 农家致富, 2013(3): 44-45.
[11] 卢林英. 快速干燥苜蓿草增值的重要措施[J]. 中国牧业通讯,2003(21): 55-56.
[12] 中华人民共和国卫生部. GB 5009.3-2010 食品中水分的测定[S].北京: 中国标准出版社, 2010.
[13] 阿不都拉·艾尼瓦尔, 吐力吾汗·阿米汗, 毛丽哈·艾合买提. 不同地区苦瓜中皂苷含量的测定[J]. 食品安全质量检测学报, 2013, 4(2):496-500.
[14] 谢建华, 申明月, 刘昕, 等. 苦瓜中多糖含量测定方法的研究[J]. 中国食品添加剂, 2009(6): 209-213.
[15] 何新益, 刘仲华. 苦瓜多糖的改良苯酚-硫酸法测定和提取工艺[J].食品与机械, 2007, 23(4): 72-75.
[16] 鲁伟, 任国谱, 宋俊梅. 蛋白水解液中多肽含量的测定方法[J]. 食品科学, 2005, 26(7): 169-171.
[17] YU Z, YIN Y, ZHAO W, et al. Anti-diabetic activity peptides from albumin against alpha-glucosidase and alpha-amylase[J]. Food Chemistry, 2012, 135(3): 2078-2085.
[18] 朱文佳, 寇自农, 张曦, 等. α-葡萄糖苷酶抑制剂体外筛选方法的研究[J]. 食品研究与开发, 2012, 33(8): 171-175.
[19] THILAGAM E, PARIMALADEVI B, KUMARAPPAN C, et al. α-Glucosidase and α-amylase inhibitory activity of Senna surattensis[J]. Journal of Acupuncture and Meridian Studies, 2013,6(1): 24-30.
[20] 程秀丽. α-淀粉酶抑制剂的活性测定[J]. 中国新医药, 2004, 3(4): 71-72.
[21] 赵修南, 贾启燕, 单俊杰. α-淀粉酶抑制剂筛选方法的优化[J]. 国际药学研究杂志, 2008, 35(5): 321-324.
[22] 李健, 黄艳, 刘宁. 苦瓜总皂苷稳定性研究[J]. 食品科学, 2008,29(10): 109-111.
[23] 汤慧民. 苦瓜产品加工新技术及辅助降血糖效应研究[D]. 南昌: 南昌大学, 2005: 9-10.
[24] 王勇庆. 苦瓜降血糖作用研究[J]. 湖南中医杂志, 1998(6): 54-55.
[25] DROUZAS A E, SCHUBERT H. Microwave application in vacuum drying of fruits[J]. Journal of Food Engineering, 1996, 28(2): 203-209.
[26] 崔正伟, 许时婴, 孙大文. 微波真空干燥技术的进展[J]. 粮油加工与食品机械, 2002(3): 28-30.
[27] 唐小俊, 池建伟, 张名位, 等. 苦瓜微波干燥工艺优化[J]. 农业机械学报, 2008, 39(1): 68-73.
[28] 李宪璀, 范晓, 韩丽君, 等. 海藻提取物中α-葡萄糖苷酶抑制剂的初步筛选[J]. 中国海洋药物, 2002, 21(2): 8-11.
[29] 黄绍华, 胡晓波, 王震宙. 山药多糖对α-淀粉酶活力的抑制作用[J].食品工业科技, 2006, 27(9): 94-95.
Effects of Drying Methods on the Contents of Hypoglycemic Components in Momordica charantia L.
QIN Yingrui1, HUANG Xianzhi2, ZENG Yitao1, YANG Juan1, DING Xiaowen1,*
(1. Chongqing Key Laboratory of Agricultural Products Processing and Storage, College of Food Science, Southwest University,Chongqing 400716, China; 2. State Key Laboratory of Silkworm Genome Biology, Chongqing 400716, China)
The effects of different drying methods on the contents of hypoglycemic components in balsam pear (Momordica charantia L.) were explored to find the most appropriate one to retain the hypoglycemic components. Balsam pear polypeptides were measured by the biuret method, polysaccharides by the phenol-sulfuric acid method, and saponins by spectrophotometry. Meanwhile, the activities of alpha-glycosidase and alpha-amylase were assayed. The results showed that freeze-dried balsam pear indicated the best color and lower losses of the main hypoglycemic components. By contrast, the color of microwave-dried balsam pear was the worst, in addition to greater losses of the hypoglycemic components. Vacuum drying was more time consuming, and caused higher losses of the hypoglycemic components and color deterioration in balsam pear as compared with hot-air drying. The 8-h dried product by hot air drying had better quality and contained(2.31 ± 0.11)% of saponins showing no significant difference compared with the freeze-dried one. Besides, the contents of polysaccharides and polypeptides were (7.43 ± 0.04)% and (0.11 ± 0.06)%, respectively, which were significantly higher and lower than those of the freeze-dried sample, respectively. At the same time, in vitro experiments indicated that hot-air dried balsam pear powder had an obvious inhibitory effect on alpha-glycosidase and alpha-amylase. Therefore, hot air drying is more appropriate for balsam pear.
balsam pear; drying; saponin; polysaccharide; polypeptide
TS201.1
A
1002-6630(2015)15-0056-06
10.7506/spkx1002-6630-201515012
2014-10-09
国家现代农业(桑蚕)产业技术体系建设专项(CARS-22-ZJ0503)
秦樱瑞(1989—),女,硕士研究生,研究方向为食品安全与质量控制。E-mail:594745844@qq.com
丁晓雯(1963—),女,教授,博士,研究方向为食品安全与质量控制。E-mail:xiaowend@sina.com
