超声波对大豆分离蛋白结构及其形成谷氨酰胺转氨酶改性凝胶性质的影响
2015-11-02涂宗财包中宇黄小琴常海霞
涂宗财,包中宇,王 辉,黄小琴,石 燕,常海霞
(1.南昌大学 食品科学与技术国家重点实验室,江西 南昌 330047;2.江西师范大学生命科学学院,江西 南昌 330 022)
超声波对大豆分离蛋白结构及其形成谷氨酰胺转氨酶改性凝胶性质的影响
涂宗财1,2,包中宇1,王 辉1,黄小琴2,石 燕1,常海霞1
(1.南昌大学 食品科学与技术国家重点实验室,江西 南昌 330047;2.江西师范大学生命科学学院,江西 南昌 330 022)
为探讨超声波对大豆分离蛋白(soybean protein isolate,SPI)结构及大豆分离蛋白形成谷氨酰胺转氨酶(transglutaminase,TG)改性凝胶的影响,研究了超声波处理前后大豆分离蛋白平均粒径、 溶解性、表面疏水性、二级结构、微观结构及凝胶特性的变化规律。结果表明:超声波处理使大豆分离蛋白平均粒径减小,溶解性增加,表面疏水性增强,α-螺旋含量降低,无规卷曲含量升高,β-折叠和β-转角无显著变化;超声波处理可以促进大豆分离蛋白形成结构均匀、致密的TG改性凝胶,最佳处理时间为60 min,此时凝胶强度为146.57 g,提高幅度达62.12%,持水性为94.27%,提高幅度为3.66%。相关性分析表明,大豆分离蛋白的溶解性以及其形成TG改性凝胶的凝胶强度、持水性与平均粒径有显著的负相关性。
超声波;大豆分离蛋白;结构;谷氨酰胺转氨酶;凝胶性质
大豆分离蛋白是以低温脱脂大豆粕为原料生产的一种全价蛋白产品,具有成本低、蛋白含量高等特点,已被广泛应用于食品加工中[1-2]。由于商用大豆分离蛋白受碱溶酸沉、喷雾干燥等操作的影响,溶解性较差,功能性质不强[3],极大地限制了其在食品领域中的 应用。因此,大豆分离蛋白的改性已成为当前研究的热点。
目前,改善大豆分离蛋白功能性质的方法主要包括物理改性、化学改性和酶法改性[4]。超声波作为一种新兴的技术,已被应用于食品生物大分子的改性研究中。Hu Hao等[5]通过超声波辅助钙盐诱导大豆分离蛋白凝胶。Zhang Qiuting等[6]进行了超声波对花生分离蛋白的改性,研究发现超声波可以降低花生分离蛋白的粒度、改变蛋白质的结构,提高了花生蛋白的溶解性、乳化性等。超声波技术由于具有快速高效、安全可靠的优点,在蛋白质改性与新产品开发方面潜力巨大[7]。
凝胶特性是大豆分离蛋白重要的功能性质之一, 直接影响着食品的品质[8]。谷氨酰胺转氨酶(transglutaminase,TG)可催化蛋白质分子间发生共价交联形成凝胶[9]。但由于大豆分离蛋白溶解性较差,易分层,不利于TG促交联改性。本实验拟采用超声波对大豆分离蛋白进行预处理,分析处理前后大豆分离蛋白结构的变化,并对处理后大豆分离蛋白形成TG改性凝胶的规律进行研究,试图改善TG对大豆分离蛋白的改性效果,拓宽超声波技术以及大豆分离蛋白的应用范围。
1 材料与方法
1.1材料与 试剂
大豆分离蛋白(蛋白质含量≥90%) 谷神生物科技有限公司;TG(酶活力≥90 U/g) 北京鸿润宝顺科技有限公司。
考马斯亮蓝G250 美国BBI公司;无水乙醇天津市大茂化学试剂厂;8-苯胺-1-萘磺酸(8-anilino-1-naphthalenesulfonic acid,ANS) 美国Sigma公司;戊二醛、叔丁醇 阿拉丁试剂有限公司。
1.2仪器与设备
JY98-IIIDN超声波细胞粉碎机 宁波新芝生物科技股权股份有限公司;Brookfield CT3质构分析仪 美国Brookfield公司;UV-3200紫外-可见分光光度计 上海美普达仪器有限公司;Nicomp380ZLS粒度仪 美国Nicomp公司;F-7000荧光光谱仪 日本日立公司;FBIQuanta200F环境扫描电子显微镜 美国FEI公司;MOS-450/AF-CD圆二色谱仪 法国Bio-Logic公司。
1.3方法
1.3.1样品的制备
配制5 份质量浓度为50 mg/mL的大豆分离蛋白溶液400 mL于500 mL烧杯中,调pH值至7.0,室温搅拌过夜,进行超声波处理。处理条件:频率20 kHz,功率400 W,探头插入液面下1 cm,冰水浴控制温度为(15±2) ℃,工作时间为1 s,间歇时间3 s,处理时间分别为0、30、60、90、120 min。超声处理后的样品经冷冻干燥后4 ℃保存备用。
1.3.2平均粒径的测定
平均粒径的测定参照Liu Chengmei等[10]的方法,将1.3.1节制备的样品配制成10 mg/mL的水溶液,磁力搅拌2 h,置于4 ℃冰箱中过夜以确保完全溶解。用Nicomp380 ZLS激光纳米粒度仪对样品的平均粒径进行测定,重复3 次。
1.3.3溶解性的测定
将1.3.1节制备的样品配制成质量浓度为10 mg/mL溶液,室温下搅拌2 h后8 000 r/min离心20 min,采用考马斯亮蓝法测定上清液中可溶性蛋 白质含量[11]。
1.3.4表面疏水性的测定
参照Chan等[12]的方法测定。将1.3.1节制备的样品配制成为10 mg/mL溶液,然后用0.01 mol/L磷酸盐缓冲液(phosphate buffered saline,PBS)(pH 7.0)将样品液稀释1、2、4 倍。取4.0 mL稀释后的蛋白溶液与16 μL 80 mmol/L ANS磷酸盐缓冲液(0.1 mol/L,pH 7.0)混匀,室温下放置2 min后测定荧光强度。激发波长371 nm,发射波长467 nm,扫描速率1 200 nm/min,狭缝宽度5.0 nm。以未加荧光探针的相应质量浓度的蛋白质溶液所测得的荧光强度作为空白。以蛋白质质量浓度(mg/mL)对荧光强度作图,采用线性回归分析进行曲线拟合,直线的斜率即为蛋白质的表面疏水性。
1.3.5圆二色谱(circular dichroism,CD)分析
采用MOS-450/AF-CD圆二色谱仪测定大豆分离蛋白溶液的近紫外圆二光谱变化。将1.3.1节制备的样品配制成质量浓度为0.25 mg/mL蛋白溶液,注入1 mm厚的样品池,在25 ℃连续充氮的条件下进行近紫外扫描。扫描范围:190~250 nm;扫描速率:50 nm/min;光谱间隔:1.0 nm。CD数据以平均椭圆率表示,采用CD Pro软件进行二级结构分析。
1.3.6凝胶强度的测定[13]
将1.3.1节制备的样品配制成质量浓度为11 mg/100 mL溶液,加入TG,加酶量均为底物的6%(以干质量计),混匀,水浴50 ℃反应3 h,95 ℃灭酶10 min,立即冰浴冷却,将所得溶液置于4 ℃冰箱24 h后取出放置30 min,最后采用质构仪测定其凝胶强度。
测定参数:探头TA10,测试速率0.8 mm/s,返回速率0.8 mm/s,目标深度10 mm。凝胶强度为第1次挤压变形时,物体所产生应力的最大值。
1.3.7凝胶样品持水性(water holding capacity,WHC)的测定
测定方法依据Gu Xin等[14]的方法,略有改动,采用1.3.6节制备的大豆分离蛋白TG改性凝胶在9 000 r/min条件下离心20 min。持水性计算见下式。
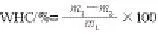
式中:m1为凝胶样品中所含水分的总质量/g;m2为离心后凝胶析出水分的质量/g。
1.3.8微观结构观察[15]
取待测凝胶样品,用双面刀片切成约2 mm×5 mm的薄片,用体积分数为2.5%,pH 7.2的戊二醛,于4 ℃条件下浸泡2.0 h进行固定,再用0.1 mol/L,pH 7.2磷酸盐缓冲液洗涤3 次,每次10 min。然后用体积分数分别为50%、70%、80%、90%的乙醇进行脱水,每次10 min;再用无水乙醇脱水3 次,每次10 min。之后用100%乙醇-叔丁醇(1∶1,V/V);纯叔丁醇进行置换各1 次,每次15 min。用真空冷冻干燥机对样品进行干燥。采用FEIQuanta200F型环境扫描电子显微镜观察冻干样品的微观结构。
1.4统计分析
2 结果与分析
2.1超声波处理对大豆分离蛋白平均粒径的影响

图1 超声波对大豆分离蛋白平均粒径的影响Fig.1 Effect of ultrasonic treatment on particle size of SPI solution
由图1可知,相对于未处理的大豆分离蛋白,超声波处理能显著降低大豆分离蛋白平均粒径,随着处理时间的延长,物料平均粒径先急剧下降后略有增加,60 min时达到最低,为233.60 nm。Arzeni等[16]在研究超声波处理卵清蛋白时也发现相似的现象。可能是由于超声波的空穴效应使溶液形成湍流,湍流产生的机械剪切力将蛋白颗粒打散[17]。但随着超声时间继续增加,平均粒径反而从233.6 nm上升到244.4 nm,这可能是因为超长时间的高强度处理诱发了蛋白颗粒因静电或疏水作用等非共价作用而形成微小的物理聚集体,致使平均粒径增大[17]。
2.2超声波处理对大豆分离蛋白溶解性的影响

图2 超声波对大豆分离蛋白溶解性的影响Fig.2 Effect of ultrasonic treatment on solubility of SPI
由图2可知,超声波处理能显著提高大豆分离蛋白的溶解性,并随着处理时间的延长,蛋白溶解性先增大后略有下降,60 min时,溶解性达到最大,为5.12 mg/mL。溶解性的增加一方面是由于在超声波处理过程中,部分蛋白质构象改变,强化了蛋白质-水的相互作用,原本不溶性蛋白变成可溶性蛋白,使可溶性蛋白含量增加[18],另一方面超声波的空化效应和机械效应等作用使大颗粒的蛋白聚集体解聚成较小颗粒的蛋白分子,蛋白质颗粒体积的减小,增强了在水中可压缩性,从而使蛋白质更易分散在水中[19-20]。
2.3超声波处理对大豆分离蛋白表面疏水性的影响
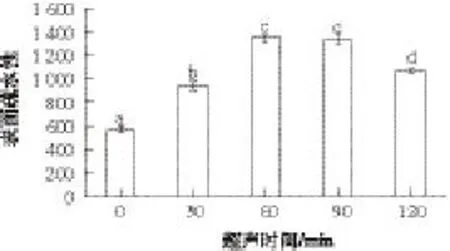
图3 超声波对大豆分离蛋白表面疏水性的影响Fig.3 Effect of ultrasonic treatment on surface hydrophobicity of SPI
疏水作用不仅在研究蛋白质的构象和分子间相互作用中具有重要作用[12],而且在凝胶网络的形成中也起到一定的作用[21]。由图3可知,超声波处理后,大豆分离蛋白的表面疏水性增强,且随超声时间的增加,表面疏水指数呈先升高后降低的趋势,在60 min时达到最大值,为1 342.20,可能的原因是超声处理破坏了蛋白原有的有序结构,使部分原先包埋在分子内部的疏水基团暴露,从而使表面疏水性增加[22]。当处理时间继续增加时,由于蛋白颗粒之间静电等非共价作用发生聚集,部分疏水基团又重新被包埋。
2.4超声波处理对大豆分离蛋白二级结构的影响
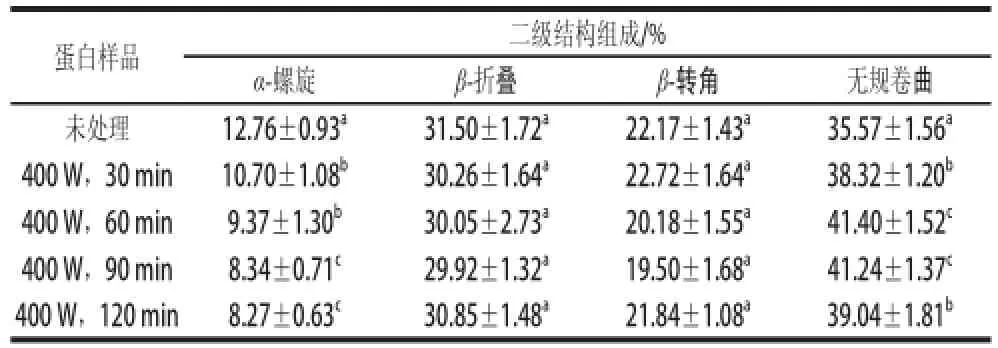
表1 超声波处理后大豆分离蛋白二级结构的变化Table 1 Change in the secondary structure of SPI by ultrasonic treatment
蛋白质分子内多肽链可形成α-螺旋、β-折叠、β-转角等特定的立体结构,这些结构的变化可反映蛋白二级结构的变化。由表1可知,经超声波处理后,大豆分离蛋白的α-螺旋含量显著降低,无规卷曲含量显著升高,β-折叠和β-转角含量未发生显著性变化。说明大豆分离蛋白分子刚性结构减弱,柔性结构增加,分子由有序变得无序。可能的原因是蛋白的二级结构主要由肽链氨基酸上羰基和酰胺基团之间形成的氢键维持,超声波处理能够破坏氢键作用,使蛋白分子二级结构破坏。Chandrapala[23]、Gülse ren[24]等的研究也发现超声波处理能引起蛋白的α-螺旋、β-折叠或无规卷曲等含量的变化。因此,超声波处理能够破坏大豆分离蛋白的二级结构。
2.5超声波处理对大豆分离蛋白形成TG改性凝胶的影响

图4 超声波对大豆分离蛋白形成TG改性凝胶强度及持水性的影响Fig.4 Effect of ultrasonic treatment on water-holding capacity (WHC)and gel strength of TG-induced SPI gels
经超声波处理后,大豆分离蛋白溶液在TG的作用下形成凝胶,处理不同时间的大豆分离蛋白形成TG改性凝胶的 凝胶强度及持水性不同。由图4可知,在TG用量相同的情况下,经超声波处理后,形成的大豆分离蛋白TG改性凝胶强度均有提高,且随超声时间的增加,样品的凝胶强度呈现先上升后下降的趋势,在60 min时达到最大值146.57 g,相对于未处理的样品提高了62.12%。说明超声处理后的大豆分离蛋白更有利于TG进行改性形成凝胶。这可能是因为超声波处理使蛋白颗粒变小,表面积增大,部分二级结构被破坏,分子展开,TG作用位点增加,更利于TG对大豆分离蛋白进行酶促交联改性,从而凝胶强度增加[13,25]。同时2.3节的结果表明,经超声处理后蛋白表面疏水基团增 加,也有利于凝胶的形成。
持水性结果表明,超声处理能提高大豆分离蛋白TG改性凝胶的持水性,但增加的效果不明显,最大提高幅度仅为3.66%。
2.6微观结构分析
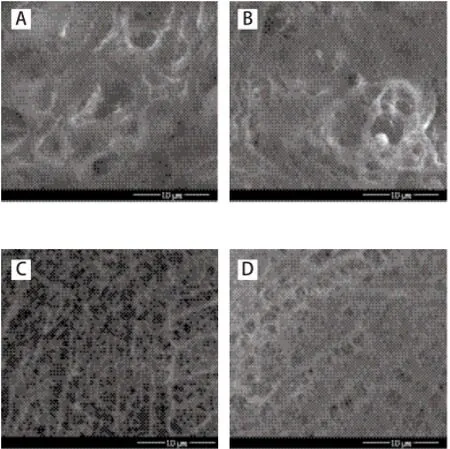

图5 超声波对大豆分离蛋白及其TG改性凝胶微观结构的影响Fig.5 Effect of ultrasonic treatment on surface microstructure of SPI and TG-induced SPI gels
大豆分离蛋白凝胶性质与其微观结构密切相关。由图5可知,未经超声处理的大豆分离蛋白形成的TG改性凝胶网络结构较为疏松,有较大且排列不规则的孔洞,经超声处理后形成的TG改性凝胶网络结构均匀、致密,孔洞较小。但随着处理时间的延长孔洞有所增大。在宏观上体现为凝胶强度和持水性的提高或降低。这与前面的研究是一致的。
2.7相关性分析

表2 平均粒径与溶解性、凝胶强度、持水性的相关性分析Table 2 Correlations analysis of particle size with solubility, gel strength and WHC
由表2可知,大豆分离蛋白平均粒径与溶解性、凝胶强度、持水性的相关系数分别为-0.922、-0.930、-0.913,表明平均粒径与溶解性、凝胶强度、持水性具有显著的负相关性。这项研究结果与前期报道一致[25]。由于超声波处理可以有效降低大豆分离蛋白的平均粒径,诱导蛋白质结构展开,使其溶解性增加,促进了大豆分离蛋白形成TG改性凝胶。
3 结 论
短时间的超声波处理能够显著降低大豆分离蛋白的平均粒径,使大豆分离蛋白溶解性增加,但延长超声时间又会引起蛋白聚集,这是一个复杂的动态过程。荧光光谱及圆二分析表明超声波处理能够引起部分蛋白质结构展开,二级结构发生改变。
超声波处理可以促进大豆分离蛋白形成TG改性凝胶,这是由于超声波处理使蛋白颗粒变小,溶解性增加,结构展开,构象改变,增加了酶与底物结合机率,促进了蛋白质分子间的交联,从而形成均匀致密的的凝胶网络,使凝胶强度和持水性增加。
[1] CHEN Lin, CHEN Jianshe, REN Jiaoyang, et al. Modifications of soy protein isolates using combined extrusion pre-treatment and controlled enzymatic hydrolysis for improved emulsifying properties[J]. Food Hydrocolloids, 2011, 25(5): 887-897.
[2] WANG Xiansheng, TANG Chuanhe, LI Biansheng, et al. Effects of high-pressure treatment on some physicochemical and functional properties of soy protein isolates[J]. Food Hydrocolloids, 2008, 22(4):560-567.
[3] 唐传核, 姜燕, 杨晓泉, 等. 超声处理对商用大豆分离蛋白凝胶性能的影响[J]. 中国粮油学报, 2005, 20(5): 72-77.
[4] 李海萍, 易菊珍. 大豆分离蛋白改性的研究进展[J]. 高分子通报,2009(2): 58-63.
[5] HU Hao, LI-CHAN E C Y, WAN Li, et al. The effect of high intensity ultrasonic pre-treatment on the properties of soybean protein isolate gel induced by calcium sulfate[J]. Food Hydrocolloids, 2013, 32(2):303-311.
[6] ZHANG Qiuting, TU Zongcai, XIAO Hui, et al. Influence of ultrasonic treatment on the structure and emulsifying properties of peanut protein isolate[J]. Food and Bioproducts Processing, 2014, 92(1): 30-37.
[7] SORIA A C, VILLAMIEL M. Effect of ultrasound on the technological properties and bioactivity of food: a review[J]. Trends in Food Science and Technology, 2010, 21(7): 323-331.
[8] 朱晓烨, 迟玉杰, 许岩, 等. 大豆分离蛋 白凝胶稳定性的研究进展[J].食品科学, 2010, 31(19): 422-425.
[9] 刘潇, 吴进菊, 高金燕, 等. 食物蛋白质的酶法改性研究进展[J]. 食品科学, 2010, 31(19): 409-413.
[10] LIU Chengmei, ZHONG Junzhen, LIU Wei, et al. Relationship between functional properties and aggregation changes of whey protein induced by high pressure microfluidization[J]. Journal of Food Science, 2011, 76(4): E341-E347.
[11] SUN Y, HAYAKAWA S, IZUMORI K. Modification of ovalbumin with a rare ketohexose through the Maillard reaction: effect on protein structure and gel properties[J]. Journal of Agricultural and Food Chemistry, 2004, 52(5): 1293-1299.
[12] CHAN J T, OMANA D A, BETTI M. Application of high pressure processing to improve the functional properties of pale, soft, and exudative (PSE)-like turkey meat[J]. Innovative Food Science & Emerging Technologies, 2011, 12(3): 216-225.
[13] 叶云花, 沙小梅, 涂宗财, 等. 动态高压微射流和谷氨酰胺转氨酶交联技术对大豆分离蛋白凝胶性能的影响[J]. 食品科学, 2012,33(23): 40-42.
[14] GU Xin, CAMPBELL L J, EUSTON S R. Influence of sugars on the characteristics of glucono-δ-lactone-induced soy protein isolate gels[J]. Food Hydrocolloids, 2009, 23(2): 314-326.
[15] 于莉萍. 改性对大豆分离蛋白组分凝胶稳定性影响的研究[D]. 哈尔滨: 东北农业大学, 2012: 22.
[16] ARZENI C, MARTINEZ K, ZEMA P, et al. Comparative study of high intensity ultrasound effects on food proteins functionality[J]. Journal of Food Engineering, 2012, 108(3): 463-472.
[17] HU Hao, FAN Xin, ZHOU Zhi, et al. Acid-induced gelation behavior of soybean protein isolate with high intensity ultrasonic pretreatments[J]. Ultrasonics Sonochemistry, 2013, 20(1): 187-195.
[18] TANG Chuanhe, WANG Xiaoyan, YANG Xiaoquan, et al. Formation of soluble aggregates from insoluble commercial soy protein isolate by means of ultrasonic treatment and their gelling properties[J]. Journal of Food Engineering, 2009, 92(4): 432-437.
[19] 任为聪, 程建军, 张智宇, 等. 不同改性方法对蛋白质溶解性的影响研究进展[J]. 中国粮油学报, 2011, 26(8): 123-128.
[20] ZHANG Haihua, CLAVER I P, ZHU Kexue, et al. The effect of ultrasound on the functional properties of wheat gluten[J]. Molecules,2011, 16(5): 4231-4240.
[21] KOHYAMA K, SANO Y, DOI E. Rheological characteristics and gelation mechanism of tofu (soybean curd)[J]. Journal of Agricultural and Food Chemistry, 1995, 43(7): 1808-1812.
[22] 刘斌, 马海乐, 李树君, 等. 超声波处理对脱脂麦胚分离蛋白结构的变化研究[J]. 光谱学与光谱分析, 2011, 31(8): 2220-2225.
[23] CHANDRAPALA J, ZISU B, PALMER M, et al. Effects of ultrasound on the thermal and structural characteristics of proteins in reconstituted whey protein concentrate[J]. Ultrasonics Sonochemistry, 2011, 18(5):951-957.
[24] G☒LSEREN I, G☒ZEY D, BRUCE B D, et al. Structural and functional changes in ultrasonicated bovine serum albumin solutions[J]. Ultrasonics Sonochemistry, 2007, 14(2): 173-183.
[25] MADADLOU A, EMAM-DJOMEH Z, MOUSAVI M E, et al. Acidinduced gelation behavior of sonicated casein solutions[J]. Ultrasonics Sonochemistry, 2010, 17(1): 153-158.
Effect of Ultrasonic Treatment on Structure and Gel Properties Induced by Transglutaminase of Soybean Protein Isolate
TU Zongcai1,2, BAO Zhongyu1, WANG Hui1, HUANG Xiaoqin2, SHI Yan1, CHANG Haixia1
(1. State Key Laboratory of Food Science and Technology, Nanchang University, Nanchang 330047, China;2. College of Life Science, Jiangxi Normal University, Nanchang 330022, China)
To study the effect of ultra sonic trea tment on structure and gel properties induced by transglutaminase (TG)of soybean protein isolate (SPI), the change in particle size, solubility, surface hydrophobicity, secondary structure,microstructure and gel properties of ultrasonicated SPI was measured in comparison to the untreated one. Results indicated that ultrasonic pretreatment could reduce particle size and increase solubility and surface hydrophobicity as well as random coil content of SPI. Ultrasonic pretreatment could decrease α-helix content without causing any significant changes in the contents of β-sheet and β-turn. SPI gels induced by TG could be promoted by ultrasonic treatment, and the gel had denser and more uniform microstructure when compared with the untreated gel. When treated for 60 min, the gel strength and waterholding capacity were 146.57 g and 94.27%, respectively, showing an increase by 62.12% and 3.66%, respectively. Correlation analysis showed that the particle size of SPI dispersion was negatively correlated with solubility, gel strength and WHC.
ultrasonic; soybean protein isolate (SPI); structure; transglutaminase (TG); gel property
TS214.2
A
1002-6630(2015)15-0015-05
10.7506/spkx1002-6630-201515004
2014-06-30
国家重点基础研究发展计划(973计划)项目(2012CB126314);江西省重大科技创新项目(20124ACB00600)
涂宗财(1965—),男,教授,博士,主要从事极端条件下食品蛋白质营养与安全研究。E-mail:tuzc-mail@aliyun.com
