大豆ASR蛋白富含组氨酸结构域在结合金属离子中的作用
2015-11-02郑易之范文静刘国宝
郑易之, 范文静, 刘 科, 刘 昀, 刘国宝
(深圳大学生命科学学院,深圳市微生物基因工程重点实验室,深圳 518060)
大豆ASR蛋白富含组氨酸结构域在结合金属离子中的作用
郑易之, 范文静, 刘科, 刘昀, 刘国宝*
(深圳大学生命科学学院,深圳市微生物基因工程重点实验室,深圳 518060)
利用固相亲和层析实验结果表明,GmASR蛋白及其含组氨酸结构域A1~A5短肽可与金属离子Cu2+和Cd2+结合;采用Cu-抗坏血酸体系检测了GmASR蛋白及A1~A5清除羟基自由基的能力,证明GmASR蛋白及A1~A5短肽中组氨酸数目与清除羟基自由基能力呈正相关;GmASR蛋白及A1~A5可保护DNA分子免受Cu2+造成的氧化损伤.CD实验和SDS-PAGE实验结果发现,GmASR蛋白及A1~A5短肽与Cu2+结合后将引起可逆性聚集及沉淀.可见GmASR蛋白通过组氨酸结合过多的金属离子,维持细胞内离子平衡,是保护植物免受重金属毒害的重要机制之一.
GmASR蛋白; 富含组氨酸结构域; 结合金属离子; 清除羟基自由基; 保护DNA
ASR(abscisic acid,stress and ripening)是植物体中与渗透调节有关的一类蛋白家族.植物受到非生物逆境胁迫(如低温、干旱和高盐胁迫等)的诱导,ASR蛋白将大量表达,以减轻逆境胁迫引起的植物伤害及死亡.Iusem等[1]最早从番茄(Solanumlycopersicum)中克隆了ASR1基因.随后,其他植物中的ASR基因也陆续被克隆,如火炬松、葡萄、百合的ASR基因[2-4].大量实验结果证明了ASR蛋白在提高转基因植物对高盐、高渗、干旱胁迫耐受性中的贡献.如水稻OsAsr1基因和百合LLA23基因(ASR)的过表达可提高转基因植物对冷、高盐、高渗和干旱胁迫的耐受性[5-6].体外实验中,番茄ASR1、香蕉和百合ASR蛋白可赋予乳酸脱氢酶对高温的耐受性[7-9].本实验室Gao等[10]指出,Cu2+胁迫可诱导大豆幼苗叶和根内GmASR基因表达上调;Li等[11]通过体外实验证明,GmASR蛋白可结合Fe3+、Ni2+、Cu2+和Zn2+多种离子,具有清除羟基自由基能力.
ASR蛋白属小分子碱性蛋白,一般含70~230个氨基酸,且富含赖氨酸、谷氨酸、丙氨酸及组氨酸等亲水氨基酸.ASR蛋白序列具有高保守性,通常含3~5个高保守结构域,并且均富含组氨酸[12].组氨酸是一种可与金属离子结合的关键氨基酸[11].然而,ASR蛋白保守结构域中的组氨酸是否参与金属离子的结合还不清楚.
本文在分析大豆GmASR蛋白序列的基础上,构建了富含组氨酸的A1~A5保守结构域短肽;研究了GmASR蛋白及A1~A5保守结构域短肽与Cu2+和Cd2+的结合,及其清除羟基自由基的能力;研究了GmASR蛋白及5个结构域对DNA的保护作用及其与Cu2+结合后发生的可逆性聚集及沉淀,讨论了GmASR蛋白保护植物抵御重金属胁迫的分子机理.
1 材料与方法
1.1基因
GmASR基因的重组菌BL/pET28a-GmASR由本实验室保存.
1.2方法
1.2.1GmASR蛋白的表达、分离及纯化利用本实验室保存的含GmASR基因的重组菌BL/pET28a-GmASR,加入IPTG诱导该重组菌表达GmASR蛋白,并利用亲和层析法分离、纯化获得GmASR目的蛋白.
1.2.2GmASR蛋白缺失短肽克隆的构建对GmASR蛋白序列进行分析,根据序列中保守结构域设计并合成目的短肽A1~A5(上海生工生物工程有限公司).
1.2.3固相金属鳌合亲和层析法利用固相亲金属螯合亲和层析柱HiTrap Chelating HP(Amersham Pharmacia Biotech,Tokyo)分别螯合Cu2+和Cd2+,获得metal-IMAC.再加入GmASR蛋白或短肽A1~A5,分别利用EQ buffer(50 mmol/LTris-HCl,1 mol/L NaCl,pH 7.4)和250 mmol/L EDTA洗脱,收集目的蛋白,进行SDS-PAGE电泳.
1.2.4DNA保护实验将500 ng的pET-28a DNA加入到20 μL的反应体系液中,反应液含有1/10 PBS(pH 7.4),4.6 μmol/L CuCl2,300 μmol/L抗坏血酸钠,1 μmol/L desferrioxamine和不同浓度牛血清白蛋白(BSA)、GmASR蛋白及A1~A5,37 ℃,温育2 h,进行核酸电泳.
1.2.5羟基自由基清除实验利用Cu-抗坏血酸体系检测GmASR蛋白及短肽对Cu2+催化产生的羟基自由基的减弱[13].配制200 μL的样品溶液:1/10 PBS(pH 7.4),4.6 μmol/L CuCl2,300 μmol/L抗坏血酸钠,1 μmol/L desferrioxamine,10 mmol/L香豆素-3-羧酸(荧光检测剂)和不同浓度的BSA、GmASR蛋白及A1~A5.加入抗坏血酸钠启动该反应,使该体系产生羟基自由基并产生荧光,用全波长酶标仪(Thermo日本)监测30 min(395 nm激发光,452 nm发射光).利用Origin8.0软件进行GmASR及A1~A5的IC50值计算,IC50表示蛋白样品的荧光强度达到最大荧光强度的50%时所对应的蛋白样品浓度,可用于衡量蛋白样品清除羟基自由基能力.IC50值越小,则该蛋白样品清除羟基自由基的能力越强,以未加入蛋白样品时的荧光值为最大荧光值.
1.2.6圆二色光谱的测定配制500 μL的样品溶液:1 mmol/L HEPES (pH 7.4),50 mmol/L Na2SO4,4 μmol/L的GmASR蛋白或20 μmol/L短肽A1~A5,不同浓度(0、10、50和100 μmol/L)的CuSO4.25 ℃孵育10 min,用圆二色谱仪(J-815,Jasco公司) 测定.检测温度25 ℃,圆二色谱的扫描范围250~190 nm,扫描频率1 nm.
1.2.7SDS-PAGE法检测GmASR及其系列短肽A1~A5聚集配制500 μL的样品溶液:1 mmol/L HEPES (pH 7.4),50 mmol/L Na2SO4,4 μmol/L的GmASR蛋白或20 μmol/L短肽A1~A5,50 μmol/L CuSO4,不同浓度(0、10、50和100 μmol/L)的EDTA.离心30 min,12 000 r/min,分别取上清液(S)和沉淀(P)进行SDS-PAGE电泳.
2 结果与分析
2.1GmASR及短肽A1~A5的序列分析及其短肽设计
GmASR蛋白属第7组LEA蛋白(LEA7).对GmASR蛋白序列分析可知其含5个保守结构域[9],各保守结构域含数目不等的组氨酸.依据5个保守结构域设计GmASR系列短肽ASR1~ASR5,其长度和所含组氨酸数目见图1和表1.
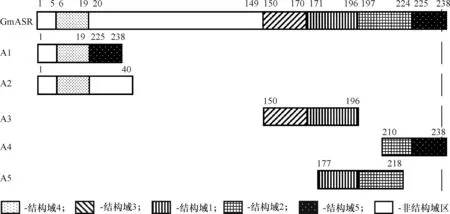
图1GmASR蛋白及其系列短肽A1~A5结构示意图
Figure 1Schematic illustration ofGmASR protein and the polypeptides A1~A5
2.2GmASR蛋白及短肽A1~A5可与Cu2+和Cd2+结合
利用固相金属螯合亲和层析柱-HiTrap Chelating HP分别螯合Cu2+或Cd2+,再加入GmASR蛋白及A1~A5短肽,以BSA蛋白为阳性对照.先用EQ缓冲液洗脱未结合的蛋白,再用EDTA将结合Cu2+或Cd2+的蛋白从HiTrap层析柱中洗脱.收集洗脱液进行SDS-PAGE电泳.图2表明,GmASR蛋白及其短肽A1~A5均可结合Cu2+和Cd2+离子.
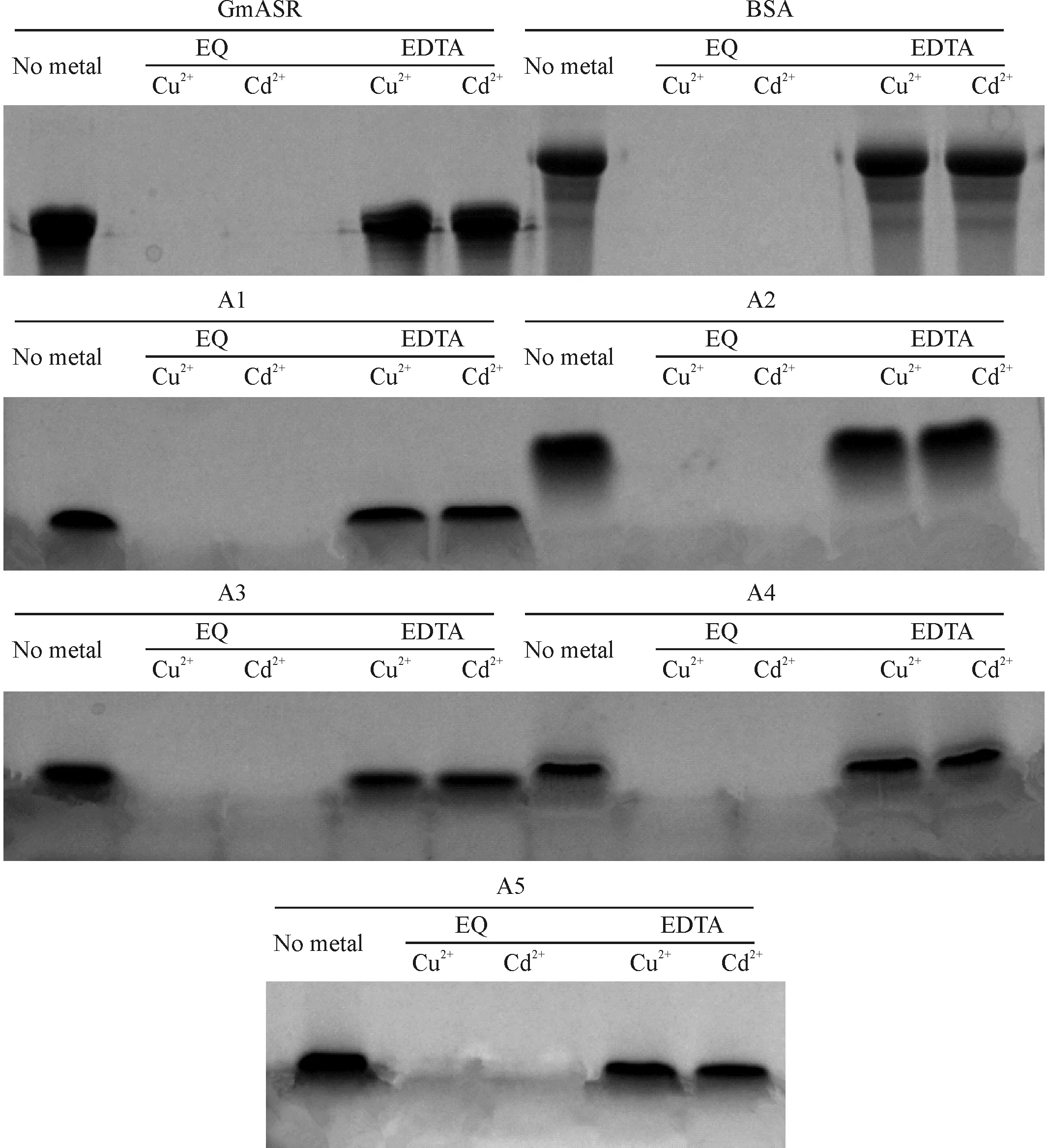
EQ(1 mol/L NaCl、50 mmol/LTris-HCl缓冲液,pH 7.4)洗去未结合离子的蛋白(短肽),BSA为阳性对照

蛋白(肽)名称蛋白(肽)氨基酸序列蛋白(肽)中氨基酸总数/个蛋白(肽)中组氨酸数/个IC50/(μmol·L-1)GmASR(略)238220.65A1MAEEKHHKHRLFHHHKDEDQEEAHGKKHHHLFG33101.71A2MAEEKHHKHRLFHHHKDEDNKPVETDT-GYDNTSYSKPSDD4062.48A3DYKKEEKHHKHLEHLGELGAASAAAYALHEKHKAEKDPEHAHRHKIE4792.04A4FAFHEHHEKKEAKEQDEEAHGKKHHHLFG2973.30A5LHEKHKAEKDPEHAHRHKIEEEVAAAAAVGSGGFAFHEHHEK4281.86
2.3GmASR蛋白及A1~A5短肽可保护DNA免受氧化损伤
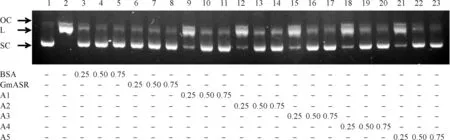
泳道1:质粒DNA(SC:超螺旋状);泳道2:经羟基自由基氧化伤害的质粒DNA(OC:开环状,L:呈线状);泳道3~5:BSA对质粒DNA的保护作用;GmASR(泳道6~8)及短肽A1~A5(分别为泳道9~11,泳道12~14,泳道15~17,泳道18~20,泳道21~23)对质粒DNA的保护作用. BSA、GmASR及短肽A1~A5质量浓度分别为0.25、0.50、0.75 g/L
图3GmASR蛋白及其系列短肽A1~A5保护DNA免受氧化伤害
Figure 3GmASR protein and polypeptides A1~A5 could protect DNA from oxidative damage
2.4GmASR蛋白及短肽A1~A5均可清除羟基自由基
采用Cu-抗坏血酸体系定量检测GmASR蛋白及A1~A5短肽清除羟基自由基能力,以IC50表示(图4).结果表明,BSA的IC50值为1.34 μmol/L.GmASR清除羟基自由基能力优于BSA,IC50值为0.65 μmol/L.将GmASR蛋白和短肽A1~A5的氨基酸序列、蛋白(短肽)的氨基酸总数、其序列中组氨酸数目、及其清除羟基自由基能力(IC50)列于表1.
2.5Cu2+对GmASR蛋白及A1~A5短肽二级结构表征的影响
GmASR蛋白属固有无序蛋白(intrinsicallydisordered protein,IDP).在正常生理状态下的GmASR主要以无序状态存在.本文以CD光谱法检测在不同浓度Cu2+存在时GmASR蛋白及短肽A1~A5的二级结构表征(图5).结果显示,GmASR蛋白在198 nm左右出现一负峰,表明GmASR主要呈无序状态.在GmASR溶液中加入10 μmol/L Cu2+后,该蛋白在198 nm处的负峰变小;随着Cu2+浓度加大至100 μmol/L时,该处的负峰几乎完全消失(图5A).在短肽A1~A5溶液中加入Cu2+后,CD谱变化趋势与GmASR蛋白相似(图5B~5F).结果意味着Cu2+的加入可使GmASR及A1~A5短肽在溶液中的无序结构减少.
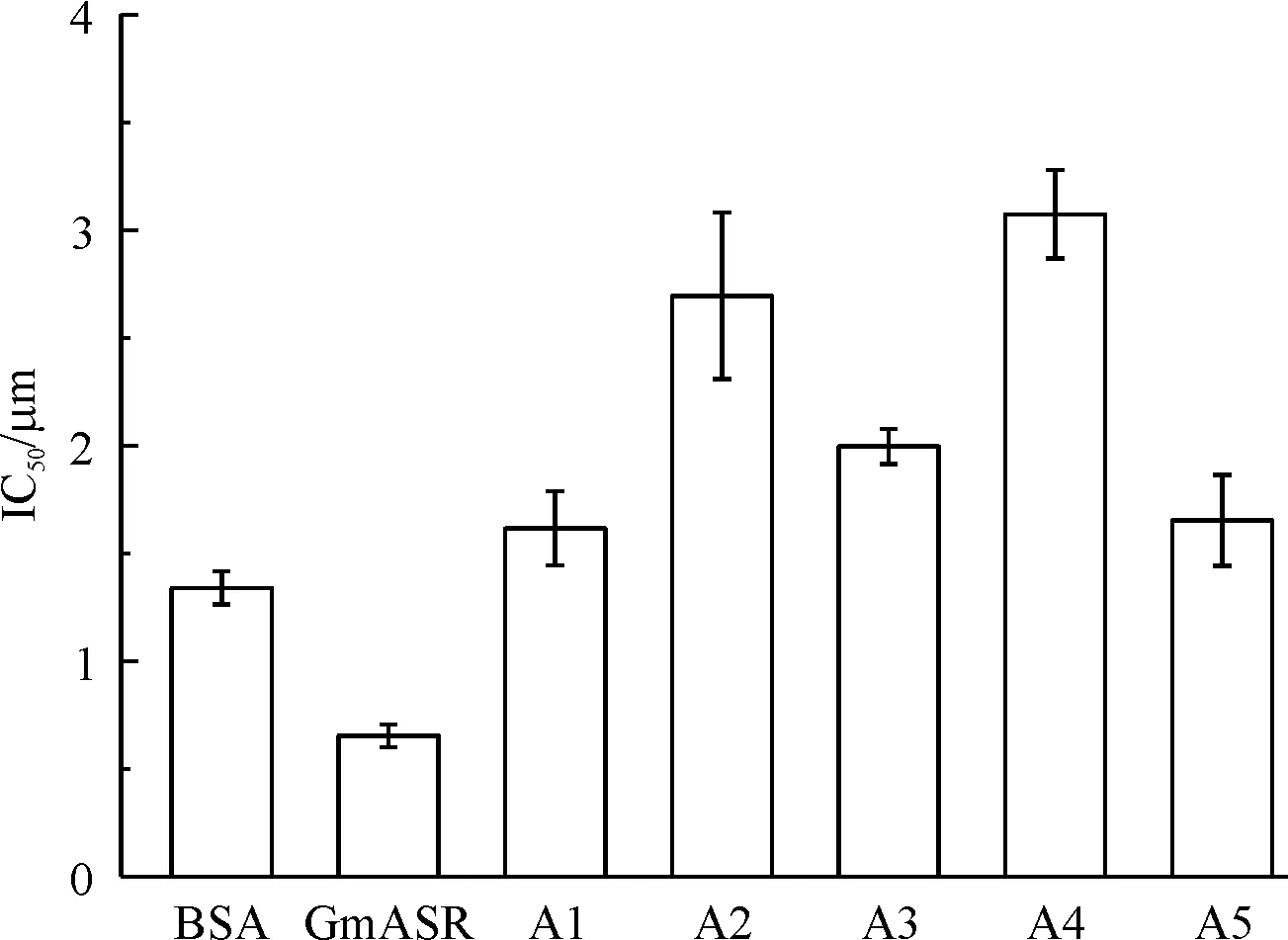
BSA、GmASR蛋白及其系列短肽A1~A5清除羟基自由基的IC50值,数据表示3次独立实验的平均值标准差.
图4GmASR及其系列短肽A1~A5清除羟基自由基能力
Figure 4The hydroxyl radicals reducing activities ofGmASR protein and the polypeptides A1~A5
2.6GmASR及短肽A1~A5与Cu2+结合后的可逆性聚集沉淀
进一步检测了GmASR及短肽A1~A5与Cu2+结合后是否发生聚集、沉淀的结果(图6)表明,在缓冲液中的GmASR蛋白及A1~A5短肽存在于上清液(S)中,沉淀中(P)未见蛋白,表明GmASR和A1~A5短肽为可溶性蛋白.在GmASR及短肽A1~A5溶液中加入50 μmol/L Cu2+后,在上清液(S)和沉淀(P)中均可检测到GmASR及短肽A1~A5,表明Cu2+的加入可使部分GmASR及A1~A5短肽发生聚集、沉淀.在含Cu2+的GmASR及短肽A1~A5溶液中继续加入不同浓度的EDTA,随着EDTA浓度的提高,上清液(S)中相应的蛋白条带加深,而沉淀(P)中相应的蛋白条带变浅,意味着EDTA可螯合与GmASR蛋白及A1~A5结合的Cu2+,导致沉淀中的部分GmASR蛋白及A1~A5可重新恢复为可溶性蛋白.可见,Cu2+引起的GmASR及A1~A5的聚集沉淀是可逆的(图6).

图5 不同Cu2+浓度下GmASR蛋白及其系列短肽A1~A5的CD图

图6 Cu2+引起GmASR及短肽A1~A5的可逆性聚集沉淀
3 讨论
植物在生长过程中常受到非生物胁迫(如干旱、高盐、重金属胁迫),引起细胞内水分丧失、离子失衡及离子毒害、过氧化损伤、生物大分子和细胞结构受到破坏等[14].有资料显示,蛋白质中的组氨酸是结合金属离子的关键氨基酸之一.部分第二组的LEA(LEA2)蛋白序列中也富含组氨酸.如Svensson等[14]发现富含组氨酸的拟南芥LEA2蛋白RAB18、LTI29、LTI30和COR47可结合Cu2+和Ni2+;并且拟南芥中的LEA2蛋白ERD10、COR47和ERD14在磷酸化后可结合Ca2+[15];蓖麻中的LEA2蛋白ITP可与几种金属离子结合,其结合能力依次为Fe3+>Cu2+>Zn2+>Mn2+>Fe2+[16].大豆GmASR中组氨酸含量达9.8%.本实验室的Gao等[10]证明异源表达的GmASR蛋白可通过其序列中的组氨酸结合Cu2+,提高转基因植物和酵母对Cu2+胁迫的耐受性.本文的结果进一步证明,GmASR蛋白的5个富含组氨酸的结构域短肽均可结合Cu2+,并清除羟基自由基.
以IC50值反映短肽清除羟基自由基能力,即IC50值越小表明其清除羟基自由基能力越强,在GmASR蛋白的5个短肽中,A2和A5肽段的长度接近(40~42氨基酸),前者含6个组氨酸,IC50为2.48 μmol/L;后者含8个组氨酸,IC50为1.86 μmol/L,可见A5含组氨酸较多,其清除羟基自由基能力也较强.此外,A2和A4短肽含组氨酸数目相近(6~7组氨酸),前者为40氨基酸,IC50为2.48 μmol/L;而后者为27氨基酸,IC50为3.30 μmol/L.可见,蛋白质(多肽)序列中组氨酸数目及肽的长度与其清除羟基自由基的能力相关,这与前人报告的结果一致[13].
GmASR系列短肽A1~A5短肽不仅可结合Cu2+,还可以结合Cd2+.笔者认为GmASR蛋白的5个保守结构域都可以结合重金属离子、具有清除羟基自由基的能力,这是GmASR蛋白提高植物细胞耐重金属胁迫、保护DNA分子、保护细胞膜结构免受过氧化损伤的机理之一.
已知,ASR蛋白在生理条件下呈无序状态. 在ASR溶液中加入Fe3+后,ASR蛋白仍保持原有的无序状态[11].但在ASR溶液中加入Zn2+后,引起ASR蛋白的可逆性聚集及沉淀.最近发现,在Cu2+胁迫发生后ASR蛋白表达快速上调.在本文中,观察到GmASR蛋白结合Cu2+后发生的可逆性聚集及沉淀.可见,Cu2+胁迫后植物体内快速表达的GmASR蛋白可缓冲细胞内的离子失衡及离子毒害,提高细胞对胁迫的适应性,为植物细胞采用其他保护性机制赢得了时间.这也是ASR蛋白提高植物细胞对逆境耐受性的另一种方式.
[1]Iusem N D, Bartholomew D M, Hitz W D, et al. Tomato (Lycopersicon-esculentum) transcript induced by water deficit and ripening[J]. Plant Physiology, 1993,102(4):1353-1354.
[2]Padmanabhan V, Dias D, Newton R J. Expression analysis of a gene family in loblolly pine (PinustaedaL.) induced by water deficit stress[J]. Plant Molecular Biology, 1997,35(6):801-807.
[3]Cakir B, Agasse A, Gaillard C, et al. A grape ASR protein involved in sugar and abscisic acid signaling[J]. Plant Cell, 2003,15(9):2165-2180.
[4]Wang H J, Hsu C M, Jauh G Y, et al. A lily pollen ASR protein localizes to both cytoplasm and nuclei requiring a nuclear localization signal[J]. Physiologia Plantarum, 2005,123(3):314-320.
[5]Kim S, Lee S, Hong S K, et al. Ectopic expression of a cold-responsiveOsAsr1 cDNA gives enhanced cold tolerance in transgenic rice plants[J]. Molecules and Cells, 2009,27(4):449-458.
[6]Yang C Y, Chen Y C, Jauh G Y, et al. A lily ASR protein involves abscisic acid signaling and confers drought and salt resistance inArabidopsis[J]. Plant Physiology, 2005,139(2):836-846.
[7]Dai J, Liu B, Feng D, et al. MpAsr encodes an intrinsically unstructured protein and enhances osmotic tolerance in transgenicArabidopsis[J]. Plant Cell Reports, 2011,30(7):1219-1230.
[8]Hsu Y, Yu S, Yang C, et al. Lily ASR protein-conferred cold and freezing resistance inArabidopsis[J]. Plant Physiology and Biochemistry, 2011,49(9):937-945.
[9]Konrad Z, Bar-Zvi D. Synergism between the chaperone-like activity of the stress regulated ASR1 protein and the osmolyte glycine-betaine[J]. Planta, 2008,227(6):1213-1219.
[10]高阳,刘国宝,刘科,等.大豆ASR表达提高酵母和烟草细胞对Cu2+耐受力[J]. 深圳大学理工学报,2015,32(2):137-144.
Gao Y, Liu G B, Liu K, et al. Expression of ASR gene confers copper tolerance to yeast mutant and transgenic tobacco BY-2 cells[J].Journal of Shenzhen University Science and Engineering,2015,32(2):137-144.
[11]Li R, Liu G, Wang H, et al. Effects of Fe3+and Zn2+on the structural and thermodynamic properties of a soybean ASR protein[J]. Biocience Biotechnology and Biochemistry, 2013,77(3):475-481.
[12]Battaglia M, Olvera-Carrillo Y, Garciarrubio A, et al. The enigmatic LEA proteins and other hydrophilins[J]. Plant Physiology, 2008,148(1):6-24.
[13]Hara M, Kondo M, Kato T. A KS-type dehydrin and its related domains reduce Cu-promoted radical generation and the histidine residues contribute to the radical-reducing activities[J]. Journal of Experimental Botany, 2013,64(6):1615-1624.
[14]Svensson J, Palva E T, Welin B. Purification of recombinantArabidopsisthaliana dehydrins by metal ion affinity chromatography[J]. Protein Expression and Purification, 2000,20(2):169-178.
[15]Alsheikh M K, Svensson J T, Randall S K. Phosphorylation regulated ion-binding is a property shared by the acidic subclass dehydrins[J]. Plant Cell and Environment, 2005,28(9):1114-1122.
[16]Kruger C, Berkowitz O, Stephan U W, et al. A metal-binding member of the late embryogenesis abundant protein family transports iron in the phloem ofRicinuscommunisL.[J]. Journal of Biological Chemistry, 2002, 277(28):25062-25069.
【中文责编:成文英文责编:李海航】
The Role of Soybean ASR Protein Histidine-Rich Domain on Binding Metal Ions
Zheng Yizhi, Fan Wenjing, Liu Ke, Liu Yun, Liu Guobao*
(School of Life Science, Shenzhen University; Shenzhen Key Laboratory of Microbial Genetic Engineering, Shenzhen 518060)
In this paper, the Cu2+and Cd2+binding properties of GmASR protein and its truncated polypeptides A1~A5 containing histidine were detected using immobilized metal ion affinity chromatography (IMAC). Then, the hydroxyl radicals reducing activities of GmASR protein and the polypeptides A1~A5 were determined by Cu-ascorbate system and it was found that the hydroxyl radicals reducing activities of GmASR and the polypeptides A1~A5 have a positive correlation with the number of histidine residues in their sequences. In addition, GmASR protein and polypeptides A1~A5 could protect DNA from oxidative damage caused by Cu2+.The results of CD and SDS-PAGE experiments indicated that Cu2+binding to GmASR protein would cause reversible aggregation and precipitation of the protein and polypeptidesinvitro. We speculate that GmASR can bind excess metal ions in the cytoplasm by means of the histidine-rich motifs and maintain intracellular ion balance and protect plants from heavy metal toxicity.
GmASR protein; histidine-rich domain; binding metal ions; hydroxyl radicals reducing activities; DNA protection
2015-06-19《华南师范大学学报(自然科学版)》网址:http://journal.scnu.edu.cn/n
深圳市科技创新委员会资助项目(JCYJ20120614085333654;JCYJ20130329120339418,ZYC201105130082A)
刘国保,讲师,Email:liugb@szu.edu.cn.
Q51
A
1000-5463(2015)05-0091-08
