一种根癌农杆菌介导转化平菇菌丝体的新方法
2015-10-31鲍广稳祝嫦巍
鲍广稳,祝嫦巍
(安徽科技学院生命科学学院,安徽凤阳233100)
一种根癌农杆菌介导转化平菇菌丝体的新方法
鲍广稳,祝嫦巍*
(安徽科技学院生命科学学院,安徽凤阳233100)
设计了一种简单高效的根癌农杆菌介导转化平菇菌丝体的方法。利用嵌套平板的方法,在内层平板培养平菇菌丝,待菌丝生长至平板边缘,将经诱导的根癌农杆菌与共培养培养基(CCM)混合,倒入内层平板与外层平板的间隙中,与正在生长中的菌丝共培养,实现转化,利用潮霉素抗性筛选获得转化子,平均转化效率33%左右。此方法操作简单,周期短,极易扩大实验规模,为平菇的分子育种以及其他丝状真菌的遗传转化提供参考。
根癌农杆菌介导转化;菌丝体;平菇
根癌农杆菌介导转化(Agrobacterium-mediated transformation,ATMT)是近年来逐渐兴起的一种高效率转化方法。与其它的转化方法相比,具有转化率高、遗传稳定、操作简单等优点,并且其大部分转化子为单拷贝的T-DNA随机插入[1]。利用根癌农杆菌介导转化真菌的转化首先在酿酒酵母中获得成功[2-3],随后ATMT转化技术又扩展到一些丝状真菌。1998年,De Groot等人用ATMT法转化黑曲霉(Aspergillus niger)、里氏木霉(Trichoderma reesei)、双孢蘑菇(Agaricus bisporus)等的几种丝状真菌,利用分生孢子和原生质体与农杆菌共培养成功获得转化子。2000年Chen等人在前人的基础上对农杆菌介导转化的方法作了修改。通过子实体菌褶组织与农杆菌共培养,在同源启动子的作用下实现了双孢蘑菇的高效转化[5]。2006年Burns等人利用不同的农杆菌菌株、不同的启动子表达大肠杆菌潮霉素抗性基因,对不同生长阶段的子实体生长进行转化,找到了转化双孢蘑菇较理想的条件,转化效率高达80%~90%[6]。
平菇(Pleurotus ostreatus),俗称糙皮侧耳,是一种广泛栽培的食用菌,味美而且营养丰富。同时平菇也是一种可以降解木质素的白腐真菌,可以合成分泌多种木质纤维素降解酶[7-9],在自然界的物质循环中发挥着重要作用。另外,白腐真菌对于各种不同结构的天然及合成化学物质如苯、苯胺、氰化物、多环芳烃、偶氮染料等都具有的强大降解能力[10-11]。因而平菇在食药用,以及在木质纤维素降解、生物修复等方面都具有很大的开发利用前景。利用各种基因重组技术和遗传操作手段对目的菌株进行改造,以获得所需的性状或细胞特性,是目前生物开发的重要手段。因此有必要建立简单有效的遗传转化方法。目前,以子实体菌褶为受体的农杆菌介导转化效率较高,但子实体存在取材受时间限制较大的问题,栽培周期长,管理费时。作者利用平菇菌丝体为受体,开发了根癌农杆菌介导转化的简单高效方法,为平菇及其他食用菌的分子遗传育种以及其他丝状真菌的遗传转化提供参考。
1 材料与方法
1.1材料
平菇(Pleurotus ostreatus)ACCC 52857;根癌农杆菌EHA105;质粒pBI121-hyg:由南开大学朱旭东教授惠赠。
1.2溶液与培养基
各种溶液与培养基参见文献[12]。
1.2.1贮存液M-N溶液:30 g MgSO4·7H2O,15 g NaCl,溶于1 L水中;微量元素溶液:ZnSO4·7H2O,CuSO4·5H2O,MnSO4·H2O,H3BO3,Na2MoO4·2H2O各 100 mg溶于1 L水中;K4缓冲液:218 g K2HPO4溶于1 L水中,用磷酸调节pH至4.9;1%CaCl2溶液:1 g CaCl2溶于100 mL水中;50%甘油:50 mL甘油与50 mL水互溶;20%葡萄糖溶液:20 g葡萄糖溶于水中,定容至100 mL;100 mg/mL卡那霉素(Kanamycin):1 g卡那霉素溶于10 mL水中,过滤除菌;100 mmol/L乙酰丁香酮(Acetosyringone(AS)):0.019 7 g乙酰丁香酮溶于1 mL 70%乙醇中,过滤除菌,现用现配。
1.2.2培养基LB培养基:10 g蛋白胨,5 g酵母抽提物,10 g NaCl,pH 7.5,定容至1 L;PDA:200 g去皮土豆,20 g葡萄糖,3 g KH2PO4,1.5 g MgSO4· 7H2O,15 g琼脂,定容至1 L;诱导培养基(IM):0.8 mmol/L K4缓冲液,20 mL M-N溶液,1 m L 1% CaCl2溶液,5 mL微量元素溶液,2.5 mL 20% NH4NO3溶液,5mL甘油,40 mL 1mol/LMES(2-N-玛琳代乙烷磺酸)缓冲液,10 mL 20%葡萄糖溶液,2 mL卡那霉素溶液,2 mL乙酰丁香酮溶液,定容至1 L;共培养培养基(CCM):5 mL 20%葡萄糖溶液,10 g琼脂,其他成分与IM培养基相同;选择培养基(SM):PDA培养基,含有250 mg/L潮霉素(Hygromycin B)。
1.3方法
1.3.1平菇菌丝体的培养在120mm培养皿中放入一个60 mm培养皿底,灭菌。将固体PDA培养基小心倒入内层培养皿中,注意将内层培养皿倒满,但不要溢出。将4℃保存的平菇菌丝体在PDA平板中活化,取0.5 cm×0.5 cm大小的菌种块置于内层平板中央,25℃培养至菌丝生长到内层培养皿边缘。
1.3.2根癌农杆菌的培养从-70℃保存的根癌农杆菌储液取少量的菌液,于LB固体培养基(含有Rif 25 mg/L,Kan 100 mg/L)上划线培养,28℃培养;待平菇菌丝体长满内层平板后,取活化的根癌农杆菌转接到5 mL LB培养基中(Rif 25mg/L,Kan 100 mg/L)中,28℃、200 r/min振荡培养过夜;以1%的接种体积分数转接于100mL LB培养基(Kan 100 mg/L)中培养至A600为0.6~0.8;3 000 r/min离心10 min收集菌体,将细胞重悬于100mL IM培养基中,室温条件下100 r/min诱导培养3 h。
1.3.3平菇菌丝体与根癌农杆菌共培养根癌农杆菌诱导培养3 h后,3 000 r/min离心10min,收集菌体,将细胞重悬于冷凉至50℃左右的100 mL CCM培养基中,混匀。将混有根癌农杆菌的CCM培养基迅速倒入内层平板与外层平板间隙,高度与内层平板基本一致。25℃下培养3 d,避光。
1.3.4筛选转化子共培养3 d后,平菇菌丝已生长至外层平板的边缘,取在CCM培养基中生长的菌丝,切成1 cm2左右的小块,置于选择培养基中,25℃培养7~14 d。取在初筛平板中的新生菌丝,转移至新鲜的选择培养基中进行复筛。
1.3.5转化子的PCR验证使用天根植物基因组提取试剂盒提取基因组DNA。使用引物hph-u:acagcgtctccgacctgat和hph-d:gcccaagctgcatcatcga进行PCR扩增。
2 结果与分析
2.1潮霉素对平菇(ACCC 52857)菌丝生长的抑制
将平菇菌丝接种于含有不同浓度潮霉素的PDA平板中,25℃培养7 d,测量菌落直径,生长情况见表1。
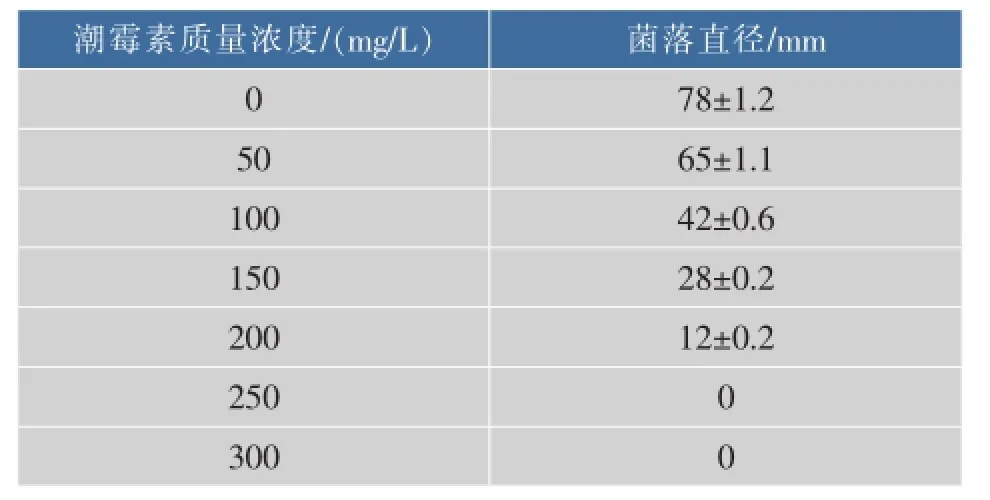
表1 平菇(ACCC 52857)对潮霉素的抗性Table 1 Assay on hygrom ycin B resistance of Pleurotus ostreatus(ACCC 52857)
在PDA平板中,250 mg/L的潮霉素可以完全抑制平菇菌丝的生长,因此选择含有250mg/L的潮霉素B的PDA培养基为选择培养基。
2.2根癌农杆菌介导转化平菇菌丝体
按上述试验方法进行农杆菌阶段平菇菌丝体的转化,我们已经成功的获得转化子,见图1。多次试验的平均转化效率为33%左右。
2.3转化子的PCR验证和遗传稳定性
转化子经复筛纯化后,提取基因组DNA,使用引物hph-u和hph-d进行PCR扩增,扩增条带与预期相符,约800 bp,说明潮霉素抗性基因已整合在转化子的基因组DNA中,见图2。
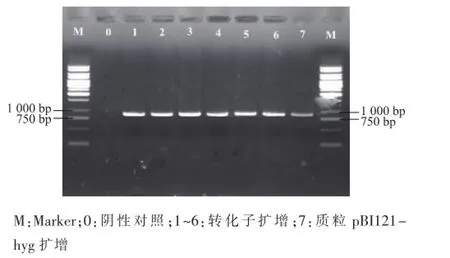
图2 转化子的PCR鉴定Fig.2 PCR identification of P.ostreatus transformants
随机挑选10个转化子,在不含有潮霉素的PDA平板中进行传代培养,验证转化子的遗传稳定性。分别传代8次,然后转接与含有潮霉素的PDA选择培养基中,所有转化子均生长正常,证明其遗传稳定。
3 结语
我们巧妙地利用了套嵌平板的方法,使根癌农杆菌与生长中的菌丝体共培养,实现转化。操作过程中注意,内层平板中的PDA培养基与外层的CCM培养基均要倒至与内层平板高度基本一致,有利于平菇菌丝体的蔓延生长。
与利用子实体菌褶为受体相比,以菌丝体为受体的农杆菌介导转化效率较低。但子实体取材受时间限制较大。栽培周期长,管理费时。且子实体菌褶部分常常会出现表面消毒不彻底,杂菌污染的现象。而菌丝体生长周期短,不易污染,培养条件简单,在实验室条件下很容易放大试验规模,虽然转化效率低于以子实体为受体的转化效率,也同样可以获得较多数量的转化子。
蔡志欣等人[13]探讨了农杆菌介导的双孢蘑菇菌丝转化技术。该方法利用液体静止培养20 d的菌丝体为受体进行转化,转化效率为8%~10%。虽然目前以菌丝体为受体的农杆菌介导转化的研究还较少,但从我们的实验结果看,以菌丝体为受体是一种值得关注的方法。生长中的菌丝体的细胞壁和细胞膜成分代谢比较活跃,因而可能也比较容易实现侵染[14],这可能也是我们的转化效率略高于其他报道的原因之一。
[1]Michielse C B,Hooykaas P J,van den Hondel C A,et al.Agrobacterium-mediated transformation as a tool for functional genomics in fungi[J].Current Genetic,2005,48(1):1-17.
[2]Bundock P,den Dulk-Ras A,Beijersbergen A,et al.Trans-kindom T-DNA transfer from Agrobacterium tumefaciens to Saccharomyces cerevisiae[J].EM BO Journal,1995,14(13):3206-3214.
[3]Bundock P,Hooykaas P J.Integration of Agrobacterium tumefaciens T-DNA in the Saccharomyces cerevisiae genome by illegitimate recombination[J].Proceedings of the National Academ y of Sciences USA,1996,93(26):15272-15275.
[4]de Groot M J,Bundock P,Hooykaas P J,et al.Agrobacterium tumefaciens-mediated transformation of filamentous fungi[J]. Nature Biotechnology,1998,16(9):839-842.
[5]Chen X,Stone M,Schlagnhaufer C,etal.A fruiting body tissuemethod for efficient Agrobacterium-mediated transformation of Agaricus bisporus[J].App lied and Environmental M icrobiology,2000,66(10):4510-4513.
[6]Burns C,Leach K M,Elliott T J,etal.Evaluation of Agrobacterium-mediated transformation of Agaricus bisporus using a range ofpromoters linked to hygromycin resistance[J].Molecular Biotechnolog y,2006,32(2):129-138.
[7]Tinoco R,Acevedo A,Galindo E,et al.Increasing Pleurotus ostreatus laccase production by culturemedium optim ization and copper/lignin synergistic induction[J].Journal of IndustrialM icrobiology and Biotechnology,2011,38(4):531-540.
[8]da Luz JM,Nunes M D,Paes SA,eta1.Lignocellulolytic enzyme production of Pleurotus ostreatus grow th in agroindustrial wastes[J].Brazilian Journal of M icrobiology,2012,43(4):1508-1515.
[9]Salame T M,Knop D,Levinson D,et a1.Redundancy amongmanganese peroxidases in Pleurotus ostreatus[J].Applied and EnvironmentalM icrobiology,2013,79(7):2405-2415.
[10]Gassara F,Brar S K,Verma M,et a1.Bisphenol A degradation in water by ligninolytic enzymes[J].Chemosphere,2013,92(10):1356-1360.
[11]Casas N,B lánquez P,V icent T,eta1.Laccase production by Trametes versicolor under lim ited-grow th conditionsusing dyesas inducers[J].Environmental Science and Technology,2013,34(1-4):113-119.
[12]Romaine CP,Schlagnhaufer C.Mushroom(Agaricus bisporus)[J].Methods in M olecular Biology,2006,344(2):453-463.
[13]蔡志欣,陈美元,廖剑华,等.农杆菌介导的双孢蘑菇菌丝转化技术探讨[J].食用菌学报,2013,20(1):9-12. CAIZhixin,CHEN M eiyuan,LIAO Jianhua,et a1.Agrobacterium-mediated transformation of Agaricus bisporus using mycelia grown in submerged culture[J].Acta Edulis Fungi,2013,20(1):9-12.(in Chinese)
[14]Tzfira T,Citovsky V.The Agrobacterium-plant cell interaction.Taking biology lessons from a bug[J].Plant Physiology,2003,133(3):943-947.
A New Method for Agrobacterium-Mediated Transformation of the Mycelia of Pleurotus ostreatus
BAO Guangwen,ZHU Changwei
(College of Life Science,Anhui Science and Technology University,Fengyang 233100,China)
In this paper,we developed an easy and efficientmethod for Agrobacterium-mediated transformation of themycelia of Pleurotus ostreatus.Using nested plates,themycelia of Pleurotus ostreatus were grown on the inner plate.When themyceliagrew to the edge of the plate,the induced Agrobacterium tumeifaciens werem ixed with co-cultivationmedium(CCM)and then were added to the space between the inner and outer plate,the abovem ixtures further were co-cultivated w ith the growing mycelia.The average conversion rate of the transformations obtained by the usage of resistance screening to the hygromycin B is about 33%.The advantages of thismethod are simple operation,short term,and easy to expand the scaleof experiments.The resultsmay provide reference for the molecular breeding of Pleurotus ostreatus and the genetic transformation of the other filamentous fungi.
Agrobacterium-mediated transformation,mycelia,Pleurotus ostreatus
Q 819
A
1673—1689(2015)11—1168—04
2014-04-17
国家自然科学基金项目(31100070);安徽省高校省级自然科学研究项目重点项目(KJ2012A062)。
祝嫦巍(1976—),女,吉林四平人,工学博士,副教授,硕士研究生导师,主要从事微生物及相关生物技术方面的研究。
E-mail:zhucw@ahstu.edu.cn
