金枪鱼骨抗氧化酶解物的工艺优化
2015-10-31胡静段振华罗伟万斌
胡静,段振华,2,*,罗伟,万斌
(1.海南大学食品学院,海南海口570228;2.海南大学热带生物资源教育部重点实验室,海南海口570228)
金枪鱼骨抗氧化酶解物的工艺优化
胡静1,段振华1,2,*,罗伟1,万斌1
(1.海南大学食品学院,海南海口570228;2.海南大学热带生物资源教育部重点实验室,海南海口570228)
为获得高抗氧化活性的金枪鱼骨粉酶解液。用中性蛋白酶、碱性蛋白酶、木瓜蛋白酶、胃蛋白酶4种蛋白酶对鱼骨粉进行酶解,以酶解液的DPPH自由基清除活性为主要指标,水解度为辅助指标进行分析,筛选出试验最适水解酶为中性蛋白酶。采用响应面设计方法对鱼骨粉酶解工艺进行优化。结果表明,骨粉最佳酶解工艺参数为:酶解温度56.22℃,酶解时间1.88 h,pH 6.15,液料比20.19∶1(mL∶g)。该条件下的鱼骨粉酶解液蛋白质浓度为9.30 mg/mL,水解度为12.34%,DPPH清除率为94.97%,羟基(·OH)自由基清除率为97.89%。骨粉酶解液显示出较强的抗氧化活性,且优于同浓度条件下的VC液抗氧化活性。
金枪鱼骨;抗氧化活性;自由基;酶解
近二十年来,我国金枪鱼产业逐步发展壮大,已成为远洋渔业经济发展中不可或缺的部分[1]。金枪鱼主要被用于罐头加工。在加工过程中,产生大量下脚料,其中,金枪鱼的骨骼(鱼头、鱼排)大约占鱼体总重量的40%[2],目前国内水产品综合利用水平较低,有的企业将其加工成低值饲料鱼粉和肥料,还有一些企业将其作为废物处理。这直接影响了金枪鱼的加工利用率。而鱼骨中含有多种生物活性物质,而且是安全的胶原蛋白来源,能预防人体疾病,有抗菌、抗氧化(即清除人体自由基)作用[3]。自由基是外源化学物质被人体摄入后通过代谢在机体内产生的中间产物,当自由基产生过多或清除过慢,都易导致机体氧化损伤,甚至引发一些疾病,如糖尿病、癌症等,因此如何清除人体内的自由基成为医学界和营养学界关注的焦点。而通过酶解方式可将鱼骨活性物质分离出来,从而提高金枪鱼加工的附加值,节约宝贵的蛋白资源[4],获得良好的经济效益与社会效益。
本试验主要探讨金枪鱼骨粉酶解工艺参数,以金枪鱼骨粉为原材料,用4种蛋白酶(中性蛋白酶、碱性蛋白酶、木瓜蛋白酶、胃蛋白酶)对金枪鱼骨粉进行酶解,以DPPH自由基清除活性为主要指标,以水解度为辅助指标,筛选出试验最适蛋白酶;并以DPPH清除率为响应值,采用RSM法对最适蛋白酶的酶解工艺进行优化,制备了具有抗氧化活性的鱼骨粉酶解液。本文旨在为使用金枪鱼骨制备抗氧化物质的工艺提供参考。
1材料与方法
1.1材料与试剂
金枪鱼罐头加工的废弃鱼骨,粘连的鱼肉刮擦除去,储藏-20℃冰箱中备用。
胃蛋白酶(食品级酶活力2.0×105U/g):河南百盛化工产品有限公司;木瓜蛋白酶(食品级酶活力1.8× 106U/g):河南豫中生物科技有限公司;中性蛋白酶(食品级酶活力2.5×105U/g)、碱性蛋白酶(食品级酶活力2.0×105U/g):江苏锐阳生物科技有限公司;DPPH(生化试剂纯度>96%):上海源叶生物科技有限公司;抗坏血酸(分析纯纯度>99.7%):天津市永大化学试剂有限公司;95%乙醇、硫酸亚铁、水杨酸、H2O2等均为分析纯。
1.2仪器与设备
T6新世纪紫外可见分光光度计:北京普析通用仪器有限责任公司;SPN3001F型电子台秤:梅特勒—托利多称重设备系统有限公司;TGL-16M高速冷冻离心机:上海卢湘仪有限责任公司;德国IKA A11 basic分析研磨机:德国仪科公司;标准检验筛:浙江上虞市华丰金仪器有限公司;SYQ-DSX-280B型手提式不锈钢压力蒸汽灭菌机:上海申安医疗器械厂制造;HHS265s电热恒温水浴锅:金坛市大地自动化仪器厂。
1.3方法
1.3.1金枪鱼骨预处理
参照李娇娇[5]等人的研究进行预试验,略有改动,确定了鱼骨粉制备试验流程:金枪鱼骨→解冻→剔除非骨骼成分→热水预煮1 h(去除残渣、部分脂肪)→0.1 MPa、121℃蒸煮30 min→50℃烘干→粉碎→过80目筛得鱼骨粉备用
1.3.2金枪鱼骨粉酶解工艺
鱼骨粉→加乙醚静置10 min(去除油脂)→倒除乙醚→按液料比加水→调pH→加酶→保温酶解→100℃灭酶10 min→5 000 r/min离心10 min→上清液为鱼骨酶解液
1.3.3酶种类的选择
分别选取中性蛋白酶、碱性蛋白酶、木瓜蛋白酶、胃蛋白酶4种蛋白酶进行试验。取1鱼骨粉,加10 mL乙醚放置10 min,再去除乙醚,按30∶1(mL∶g)液料比混合蒸馏水、骨粉,在各蛋白酶最适作用条件下进行水解(见表1),根据酶解液DPPH自由基清除率及水解度大小,筛选出最适用酶。

表1 各种酶的作用条件Table 1Hydrolysis conditions of four kinds of proteases
1.3.4影响鱼骨粉酶解液DPPH清除率值的单因素试验
参考酶的选择试验结果,选择中性蛋白酶继续试验,以酶解液DPPH清除率及水解度为指标,进行单因素试验。试验设计为:酶解温度(45、50、55、60、65℃)、酶解时间(1、2、3、4、5 h)、pH(5.0、6.0、7.0、8.0、9.0)、液料比[10∶1、20∶1、30∶1、40∶1、50∶1(mL∶g)]。
1.3.5响应面设计试验
在单因素试验基础上,根据Box-Behnken中心设计原理,以DPPH清除率为响应值,设计4因素3水平的响应面设计试验,进一步优化酶解工艺参数。
1.3.6鱼骨粉酶解液DPPH清除率的测定
参照江敏[6]的方法进行测定。
1.3.7鱼骨粉酶解液羟基自由基清除率的测定
参照王章存[7]的方法进行测定。
1.3.8水解度的测定[8]
1.3.8.1甘氨酸标准曲线的绘制
称量茚三酮0.5 g、果糖0.3 g、Na2HPO4·5H2O 10 g、KH2PO46 g,溶解后定容至100 mL,配制成茚三酮显色剂。取9支具塞试管,分别加入不同浓度甘氨酸标准液2 mL:0、4、8、12、16、20、24、28、40 μg/mL,然后分别加入1 mL茚三酮显色剂,混匀后沸水浴15 min,流动水迅速冷却,再加入5 mL 40%乙醇溶液,混匀后放置15 min,以空白调零于570 nm处测定吸光值。
1.3.8.2茚三酮法
取鱼骨酶解液1 mL定容至100 mL,取0.4 mL稀释液于试管中并加入1.6 mL蒸馏水、1 mL显色剂,同时做空白试验,后续操作同标准曲线,利用标准曲线计算被裂解的肽键浓度。

式中:h为每克蛋白质裂解的肽键浓度;htot为每克原料蛋白质的肽键浓度。
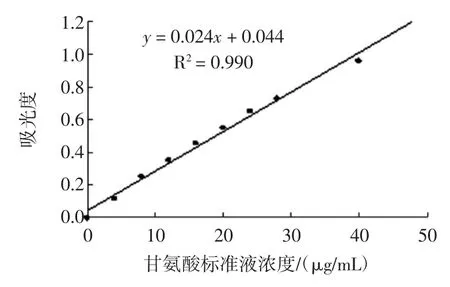
图1 甘氨酸标准液Fig.1Standard curve of glycine
2结果与分析
2.1酶种类对鱼骨酶解液DPPH清除率值的影响
酶种类对鱼骨酶解液DPPH清除率值的影响见图2。
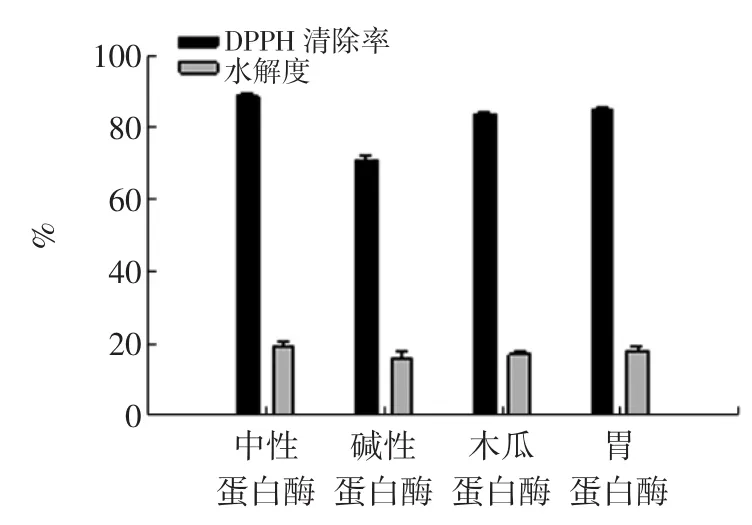
图2 酶种类对鱼骨粉酶解液DPPH自由基清除活性、水解度的影响Fig.2Effect of the enzymatic hydrolysates obtained by different proteases on DPPH radical scavenging rate and hydrolysis degree
如图2可知,不同蛋白酶水解所得的酶解液对DPPH自由基均有一定的清除能力,但因蛋白酶种类的差异而有不同的效果。这可能与不同蛋白酶的作用位点及鱼骨粉酶解液里氨基酸序列有关。由于蛋白酶的特异性,其作用的肽键位点不同,得到的多肽种类也不相同,因此不同的蛋白酶酶解产物抗氧化性不同。其中中性蛋白酶的水解效果最好,DPPH自由基清除率及水解度都最高,分别为88.74%、19.23%。因此,选择中性蛋白酶为试验用酶,进行后续试验。
2.2酶解温度对鱼骨酶解液DPPH清除率值的影响
酶解温度对鱼骨酶解液DPPH清除率值的影响见图3。
在液料比30∶1(mL∶g),pH 7.0,加酶量2%,酶解时间3 h的条件下,分别选择45、50、55、60、65℃的酶解温度进行酶解试验,结果如图3所示。
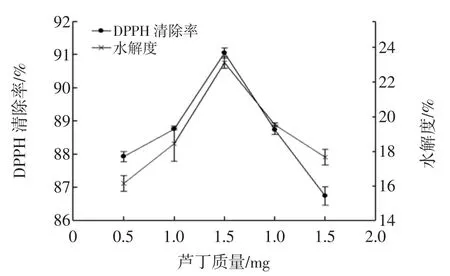
图3 温度对鱼骨粉酶解液DPPH自由基清除活性、水解度的影响Fig.3Effect of the hydrolysis temperature on DPPH radical scavenging rate and hydrolysis degree
如图3所示,随着温度的升高,鱼骨粉酶解液DPPH清除率及水解度的大小都呈先升高后降低的趋势,分别在55℃条件下达到最大值。这可能是因为在低温条件下,酶活较低,反应不活跃;随着温度的升高,分子运动加快,酶促反应速率增加,水解程度增加,更多肽键断裂暴露出氨基酸残基,这为DPPH自由基提供了单电子[9],因此其清除率及水解度升高;当温度超过某一临界点,酶蛋白结构被破坏,酶活降低,影响酶促反应进行,同时杂质溶出也增多,因此DPPH清除率及水解度较低。故选55℃为最佳酶解温度。
2.3酶解时间对鱼骨酶解液DPPH清除率值的影响
酶解时间对鱼骨酶解液DPPH清除率值的影响见图4。

图4 时间对鱼骨粉酶解液DPPH自由基清除活性、水解度的影响Fig.4Effect of time on DPPH radical scavenging rate and hydrolysis degree
在液料比30∶1(mL∶g),pH 7.0,加酶量2.0%,酶解温度55℃的条件下,进行不同酶解时间梯度的试验,探讨酶解时间对DPPH清除率、水解度大小的影响。
如图4所示,中性蛋白酶制备的酶解液,其水解度随着酶解时间的增加而增大,当酶解时间超过3 h时,曲线上升变缓。这可能是因为反应初始阶段,酶切位点多,酶促反应较快,而随着反应的进行,酶活性位点达到饱和,水解的速率减缓。但是,酶解液DPPH清除率却呈现先升后降的趋势,在2 h时达到最大值90.76%。这可能是因为随着反应的进行,抗氧化物质溶出增加;反应后期,随着时间的延长,水解出的多肽分子结构受到影响,水解过度,多肽逐渐降解为无抗氧化作用的氨基酸或者较短的肽,而多肽又为清除自由基的主要成分[10],因而抗氧化活性也降低。综合考虑,最适酶解时间为2 h,这一结果表明适度酶解,能维护酶解产物的结构和序列,保证其功能性,有利于提高产物的抗氧化活性。
2.4pH对鱼骨酶解液DPPH清除率值的影响
pH对鱼骨酶解液DPPH清除率值的影响见图5。

图5 pH对鱼骨粉酶解液DPPH自由基清除活性、水解度的影响Fig.5Effect of pH value on DPPH radical scavenging rate and hydrolysis degree
在液料比为30∶1(mL∶g),加酶量为2.0%,酶解温度为55℃,时间为2 h的条件下,分别将pH调为5.0、6.0、7.0、8.0、9.0,测定酶解液DPPH清除率及水解度的变化。
如图5所示,鱼骨粉酶解液的DPPH自由基清除活性及水解度的大小随着pH的增加呈先增大后减小的趋势,分别在pH为6.0、7.0时达到最大值,其值为89.91%、24.76%。水解液的pH不仅影响酶的空间构象,也影响底物的解离状态。pH过高或过低都会使酶失活,因此在最适pH条件下酶解,水解效果较好。而中性蛋白酶最适酶解pH为7.0,酶活最高,此时底物肽键更容易被裂解,因此水解度高。酸法提取的多肽,其超螺旋结构保存比较完好且具有一定的生理活性[11],因此pH为6.0时,DPPH清除率比较大。综合考虑,优选酶解pH为6.0。
2.5液料比对鱼骨酶解液DPPH清除率值的影响
液料比对鱼骨酶解液DPPH清除率值的影响见图6。
在酶解温度55℃,加酶量2.0%,pH 6.0,时间2 h的条件下,观察不同液料比对DPPH清除率、水解度影响,结果如图6所示。

图6 液料比对鱼骨粉酶解液DPPH自由基清除活性、水解度的影响Fig.6Effect of liquid-material ratio on DPPH radical scavenging rate and hydrolysis degree
如图6所示,随着液料比的增加,水解度呈先增加后减少的趋势,在40∶1(mL∶g)达到最大值22.65%。这可能是因为较低的液料比,其水解液黏度大,抑制了酶促反应各成分的扩散及酶的催化反应,水解度低;随着液料比增加,酶和底物充分接触,酶促反应加快,水解度升高,抗氧化物质增多;但超过一定的液料比时,溶剂相对增加,酶与底物结合较慢,水解程度降低。而水解液DPPH自由基清除活性在液料比20∶1(mL∶g)时达到最大值90.77%,可能是因为随着液料比的增加,溶剂增加,抗氧化性物质浓度相对减小,且杂质溶解增多,抗氧化性物质纯度降低,因此DPPH清除率降低。综合考虑,选20∶1(mL∶g)为最佳液料比。
2.6响应面优化酶解工艺
2.6.1数学模型的建立及显著性检验
根据Box-Behnken设计原理,进行拟合,其因素水平见表2,响应面试验设计及结果见表3。

表2 Box-Behnken试验设计因素水平Table 2Variables and levels of Box-Behnken central composite design

表3 中心组和试验设计方案及结果Table 3Arrangement and results of Box-Behnken design

续表3中心组和试验设计方案及结果Continue table 3Arrangement and results of Box-Behnken design
以DPPH清除率为响应值,建立响应面回归模型,方程如下:(Y=94.06+1.13A-1.27B+1.19C+0.71D-0.14AB+1.34AC+0.5AD+0.25BC+0.98BD-1.26CD-1.96A2-2.61B2-2.64C2-3.87D2。)
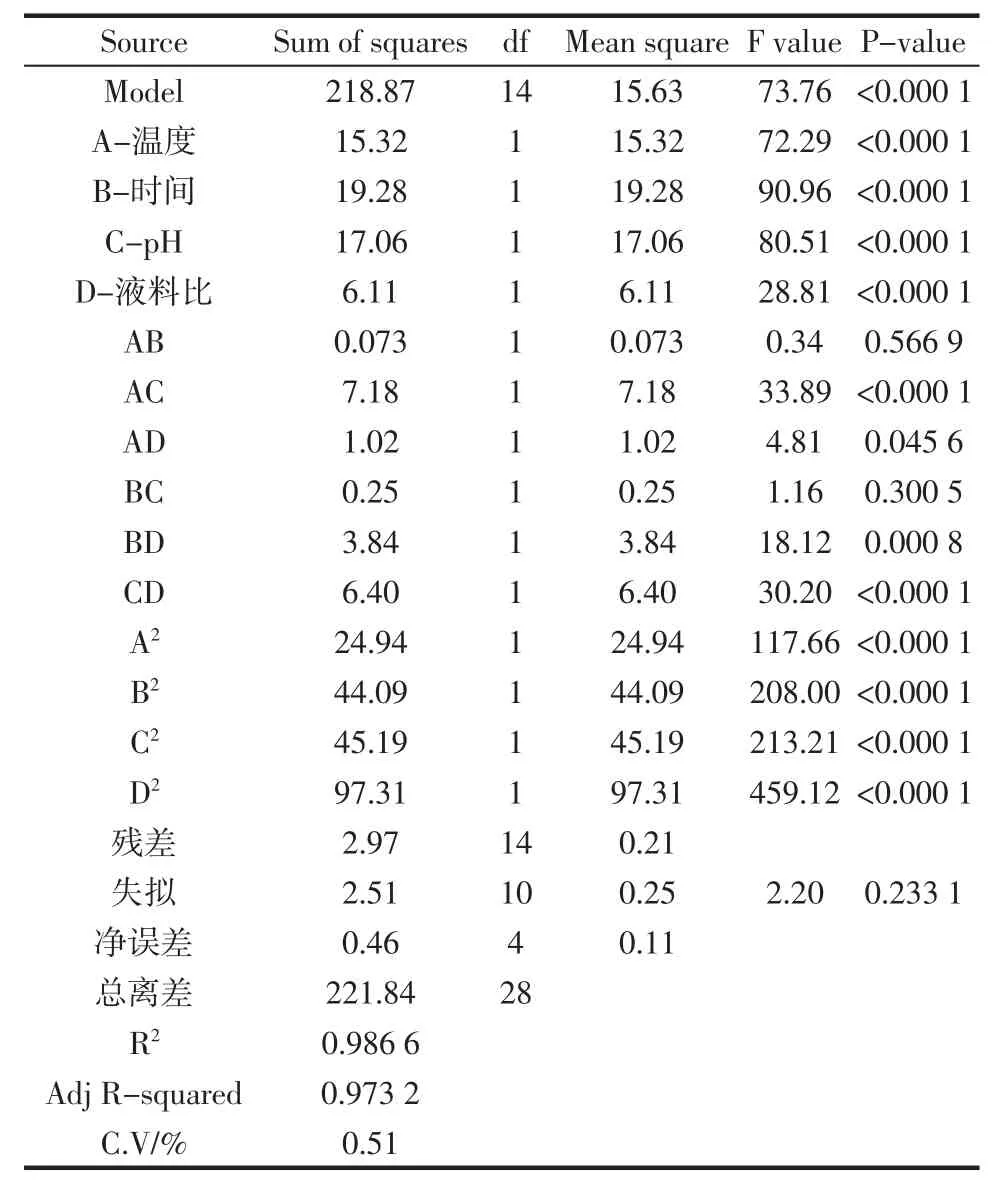
表4 回归统计分析结果Table 4Result of the regression response surface model
由表4可知,本试验所得回归方程模型达到极显著水平(P<0.01),且失拟项P为0.233 1>0.05,不显著,说明此模型拟合程度高,二者差异程度小,因此可用该回归方程代替试验真实点对试验结果进行分析;该模型的校正决定系数为0.9732,变异系数为0.51%,表明总变异中仅有2.68%的变异不能由该模型解释;R2为0.986 6,说明超过95%的置信区间,酶解液DPPH清除率的变化归因于4个独立的变量,进一步说明该模型可信度高。从因素A、B、C、D及交互项对DPPH清除率的影响来看,除二次项AB、BC不显著外,其余因素影响均显著。通过比较方程一次项系数的绝对值,可以判断因素影响的主次性,本试验中因素影响的主次顺序为:时间>pH>温度>液料比。
2.6.2验证试验
为检验响应面分析方法的可靠性,采用上述优化参数进行验证试验。3次验证试验结果的DPPH清除率平均值为94.97%,与理论提取率94.63%相比,相对误差为0.36%,表明此酶解工艺参数准确可靠。在该工艺条件下所得的酶解液,其蛋白质浓度为9.30 mg/mL,水解度为12.34%。
2.7金枪鱼骨粉酶解液与VC的抗氧化活性比较
金枪鱼骨粉酶解液与VC的抗氧化活性比较见图7。
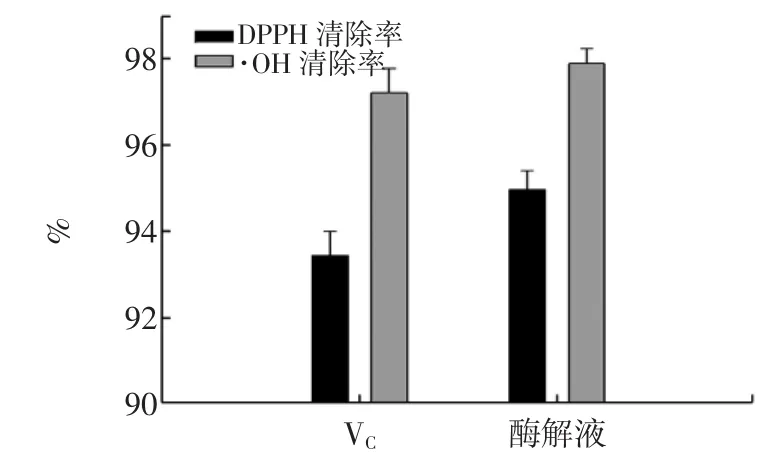
图7 鱼骨粉酶解液与VC抗氧化性比较Fig.7The comparison of antioxidant activity of ascorbic acid and enzymatic hydrolasates of tuna bone at the same concentrations
为考查鱼骨粉最佳酶解条件下的酶解液抗氧化能力,比较了蛋白质浓度为9.30 mg/mL的酶解液与相同浓度下VC的抗氧化性,结果见图7,可见骨粉酶解液的抗氧化性优于VC。
3结论
1)通过对酶解金枪鱼骨工艺的研究发现,DPPH自由基清除率与水解度之间没有显著的一致性规律,酶解法制备抗氧化活性肽的关键在于选择合适的蛋白酶及酶解条件。
2)中性蛋白酶酶解金枪鱼骨所得的酶解液对DPPH自由基的清除能力优于碱性蛋白酶、胃蛋白酶、木瓜蛋白酶酶解所得的酶解液。
3)鱼骨粉最佳酶解工艺参数为:酶解温度56.22℃,时间1.88 h,pH 6.15,液料比20.19∶1(mL∶g)。此工艺条件下所得酶解液蛋白质浓度为9.30 mg/mL,水解度为12.34%,DPPH清除率为94.97%,羟基(·OH)自由基清除率为97.89%。
4)与VC的抗氧化性比较,金枪鱼骨酶解液显示出较强的抗氧化活性,有作为天然抗氧化剂的潜力。
[1]王素华,胡静,段振华,等.金枪鱼罐头调味汁配方的研制[J].水产科技情报,2014,41(1):39-42
[2]段振华,王素华.金枪鱼的加工利用技术研究进展,[J]肉类研究,2013,27(8):35-38
[3]Kuo-Chiang Hsu.Purification of antioxidative peptides prepared from enzymatic hydrolysates of tuna dark muscle by-product[J].Food Chemistry,2010,122(1):42-48
[4]ZHEN-HUA DUAN,JU-LAN WANG,MEI-HUA YI,et.al.Recovery of proteins from silver carp by-products with enzymatic hydrolysis and reduction of bitterness in hydrolysate[J].Journal of Food Process,2010,33(5):962-978
[5]李娇娇.鹅骨抗氧化肽的酶解工艺优化及其分离纯化研究[D].四川:四川农业大学,2013
[6]江敏,胡小军,张永芹,等.鱿鱼酶解液美拉德反应优化及产物消除自由基的研究[J].中国调味品,2012,37(8):26-30
[7]王章存,徐贤,魏翠平.大豆蛋白的酶解及其抗氧化活性研究[J].中国粮油学报,2009,24(5):22-24
[8]赵新准.大豆蛋白水解物水解度水解度测定的研究[J].东北农业大学学报,1995,26(2):178-181
[9]Hwee-Leng Siow,Chee-Yuen Gan.Extraction of antioxidative and antihypertensive bioactive petides from parkia speciosa seeds[J]. Energy Conversion and Management,2013,141(4):3435-3442
[10]Xue LI,Yongkang LUO,Huixing SHEN,et.al.Antioxidant activities and functional properties of grass carp(Ctenopharyngodon idellus)protein hydrolysates[J].Journal of the Science of Food and Agriculture,2012,92(2):292-298
[11]于丽娜,高俊安,杨庆利,等.不同处理条件对花生抗氧化肽抗氧化活性的影响[J].食品科学,2012,33(11):104-110
Optimization of Enzymatic Hydrolysates Technology with Antioxidant Ability of Tuna Bone
HU Jing1,DUAN Zhen-hua1,2,*,LUO Wei1,WAN Bin1
(1.College of Food Science,Hainan University,Haikou 570228,Hainan,China;2.Key Laboratory of Tropical Biological Resources,Ministry of Education,Hainan University,Haikou 570228,Hainan,China)
In order to obtain enzymatic hydrolysates with high antioxidative ability from tuna bone.Taking scavenging activity on DPPH free radicals and the hydroxyl free radicals as evaluating indexex.Antioxidative substances were respectively extracted with Neutrase,Alcalase,Papain and Pepsin,among which Neutrase was showed to be optimal.Single facter and Response surface methodology(RSM)were used to optimize hydrolysis conditions.The test showed that,the optimal hydrolysis conditions were as follows:hydrolysis temperature of 56.22℃,hydrolysis time of 1.88 h,pH of 6.15,liquid-material ratio of 20.19∶1(mL∶g).Under this condition,the protein concentration of enzymatic hydrolysates,the hydrolysis degree,the scavenging rate on DPPH free radicals and hydroxyl free radicals were be 9.30 mg/mL,12.34%,94.97%,97.89%,respectively.The antioxidative activity of enzymatic hydrolysates was higher than that of ascorbic acid at the same concentration.
tuna bone;antioxidant activity;free radicals;hydrolysis conditions
10.3969/j.issn.1005-6521.2015.15.016
2014-09-12
海大科研合作项目(HD-KYH-2012071)
胡静(1990—),女(汉),硕士,研究方向:水产品加工技术。
段振华(1965—),男,教授,硕导,博士,水产品食品科技。
