基于数字全息术的镍在“H2SO4+SCN-”溶液中的电流振荡研究
2015-10-30吴琼,李亮,王超,2
吴 琼,李 亮,王 超,2
(1.江苏师范大学 化学化工学院,江苏 徐州 221116;2.徐州工程学院,江苏 徐州 22018)
通常情况下镍及其合金不易发生腐蚀,但在含有侵蚀性离子(如Cl-)的条件下,镍及其合金易发生点蚀.镍在阳极溶解过程中能够发生电化学振荡,研究镍的电化学振荡能够提高人们对镍表面膜的溶解与形成机理的认识,从而为镍的防腐提供理论依据.目前,关于镍在硫酸溶液中的振荡现象已有一些研究[1-5].Hoar和Barbosa[1]首次报道了镍︱硫酸体系在预钝化区的电流振荡现象,他们把这一现象归因于电极表面膜周期性的生成和溶解.Indira等[2]从电极表面半导体膜的结构变化出发,认为镍︱硫酸体系的振荡现象是由于电极表面氧化膜内符合化学计量的氧化物层的反复形成和崩溃造成的.Champagine等[6]利用XPS、SEM等技术研究了镍在含碘离子或氯离子的硫酸溶液中的周期性电流振荡.崔海涛等[7]研究了镍在含有氯离子的硝酸溶液中的电化学振荡,认为该体系出现电流振荡的主要原因是由于Cl-的存在使钝化膜产生缺陷,从而导致电极活化与钝化相互转化.郑菊芳等[8]则利用传统电化学方法并结合原位拉曼光谱研究了镍在含有不同浓度SCN-硫酸溶液中的电化学振荡.
尽管关于镍在阳极溶解过程中电流振荡的研究较多,但是对振荡机理的认识仍然需要进一步的研究.由于电流振荡是一个动态过程,采用现场观测技术能够得到最直接的实验依据.本文利用循环伏安、恒电位等电化学方法并结合数字全息现场观测技术,研究了Ni︱“0.5mol/L H2SO4+5mmol/L SCN-”体系阳极溶解过程中的电流振荡现象,并对振荡机理进行讨论.
1 实验方法
1.1 电化学实验
电化学实验采用传统的三电极系统,其中工作电极为高纯镍(Alfa-Aesar,99.98%),辅助电极为铂片电极,参比电极为饱和甘汞电极(SCE).每次实验前,将工作电极依次用600#水砂纸和1200#金相砂纸打磨至镜面光亮,放入超声波清洗器中用二次蒸馏水清洗后备用.将鲁金毛细管置于工作电极和参比电极之间以避免离子扩散及降低IR降.电化学实验中使用CH Instruments公司生产的CHI 660B电化学工作站,每次测试之前,电极在溶液中浸泡400s以达到稳定状态.如无特殊说明,文中电极电位均是相对于饱和甘汞电极.实验中所用溶液均由分析纯试剂和二次蒸馏水配置而成.实验在室温下进行.
1.2 全息实验
全息实验装置和实验原理如文献[9]所述.电化学反应发生时,电极表面附近浓度的变化引起溶液折射率的变化,折射率的变化导致物光的相位差并被数字摄像机实时记录下来.采集得到的动态数据通过专业视频捕获软件储存到计算机中,然后经过Matlab等软件处理,最终得到文中的二维相位图.
2 结果与讨论
2.1 线性扫描曲线
图1为Ni在0.5mol/L H2SO4和“0.5mol/L H2SO4+5mmol/L SCN-”溶液中的线性扫描曲线,扫描范围从-0.4~0.8V,扫描速率为10mV/s.

图1 Ni在溶液中的线性扫描曲线
在硫酸空白溶液中(图1曲线A),在所有电位区间均没有观察到电流振荡现象.在活化区(Ⅰ),电流逐渐增大直到0.30V处,出现了第一个氧化峰,这与镍氧化为Ni(Ⅱ)有关[10-11];随后进入预钝化区(Ⅱ),电流随着电位的升高而减小,在0.35V左右出现一个不太明显的氧化肩峰,可能与Ni(Ⅱ)被氧化为Ni(Ⅲ)有关[10-11],随着电位的升高,电流继续减小,在0.50V左右电极完全钝化,进入钝化区(Ⅲ).当溶液中SCN-浓度为5mmol/L时(图1曲线B),0.30V处的氧化电流峰明显增高,且钝化电位正移,预钝化区出现了电流振荡.当电位超过0.40V,电流快速下降,紧接着出现一个较小的氧化峰,然后进入钝化区.
图2为相应于图1不同时间点的相位分布图,其中图2a,图2a’分别为极化前空白和含有SCN-的硫酸溶液的相分布图,图2b~图2f,图2b’~图2f’分别为同一时间即同一电位下空白和含有SCN-的硫酸溶液的相分布图.
相位分布图中间黑线为界面,左右两侧分别为电极和电解液部分.绿色表明相位差不变,界面浓度未发生明显变化;红色和黄色表明相位差增大,界面浓度增大;蓝色表明相位差减小,界面浓度减小.在硫酸空白溶液中,在活化溶解的初始阶段图2b~图2c,随着电位的正移,界面出现黄色并逐渐加深,说明界面浓度上升,Ni溶解生成Ni(Ⅱ),电极︱溶液界面逐渐形成了一个扩散层.随着电位的继续正移,扩散层的外围逐渐出现蓝色区域;紧接着,红色区域收缩,蓝色区域扩张(图2d~图2e),折射率的急剧降低表明离子浓度降低,这可能是由于SO2-4的消耗导致了溶液中离子浓度的降低.因此,很有可能是SO2-4从本体溶液中迁移到电极附近,并在电极附近生成盐膜(NiSO4·xH2O),从而导致扩散层浓度的剧烈变化[12].随着电流密度的增大,蓝色区域逐渐加厚,表明消耗了更多的SO2-4,形成了更厚的盐膜.当电流密度最大时,电极附近盐膜最厚(图2e).在钝化区(图2f~图2h),扩散层内侧红色区域再次增加,外侧蓝色区域逐渐消失,表明盐膜逐渐溶解消失,电极表面形成比较致密的氧化膜.
在含有SCN-的硫酸溶液中,在活化区,初始阶段的相位分布图(图2b’~图2c’)类似于空白溶液中的,Ni(Ⅱ)溶出进入溶液.而随后的图2d’~图2e’,蓝色区域明显多于图2d~图2e,这可能是因为溶出的Ni(Ⅱ)不仅与溶液中SO2-4结合形成盐膜,而且与SCN-络合从而导致相位降低的更多.在氧化肩峰处,蓝色区域减少(图2f’).在钝化区(图2g’~图2h’),类似于在硫酸空白溶液中,扩散层内侧红色区域增加,外侧蓝色区域逐渐消失,电极钝化.
2.2 恒电位电流—时间曲线
图3为Ni︱0.5mol/L H2SO4和Ni︱“0.5mol/L H2SO4+5mmol/L”SCN-体系在0.38V电位下的j-t曲线.
在硫酸空白溶液中,Ni电极进入钝化状态(图3A曲线),而在含有SCN-的硫酸溶液中出现了周期性的电流振荡(图3B曲线).
图4为相应于图3B不同时间点的相位分布图,图4a’为极化前含有SCN-的硫酸溶液的相分布图.
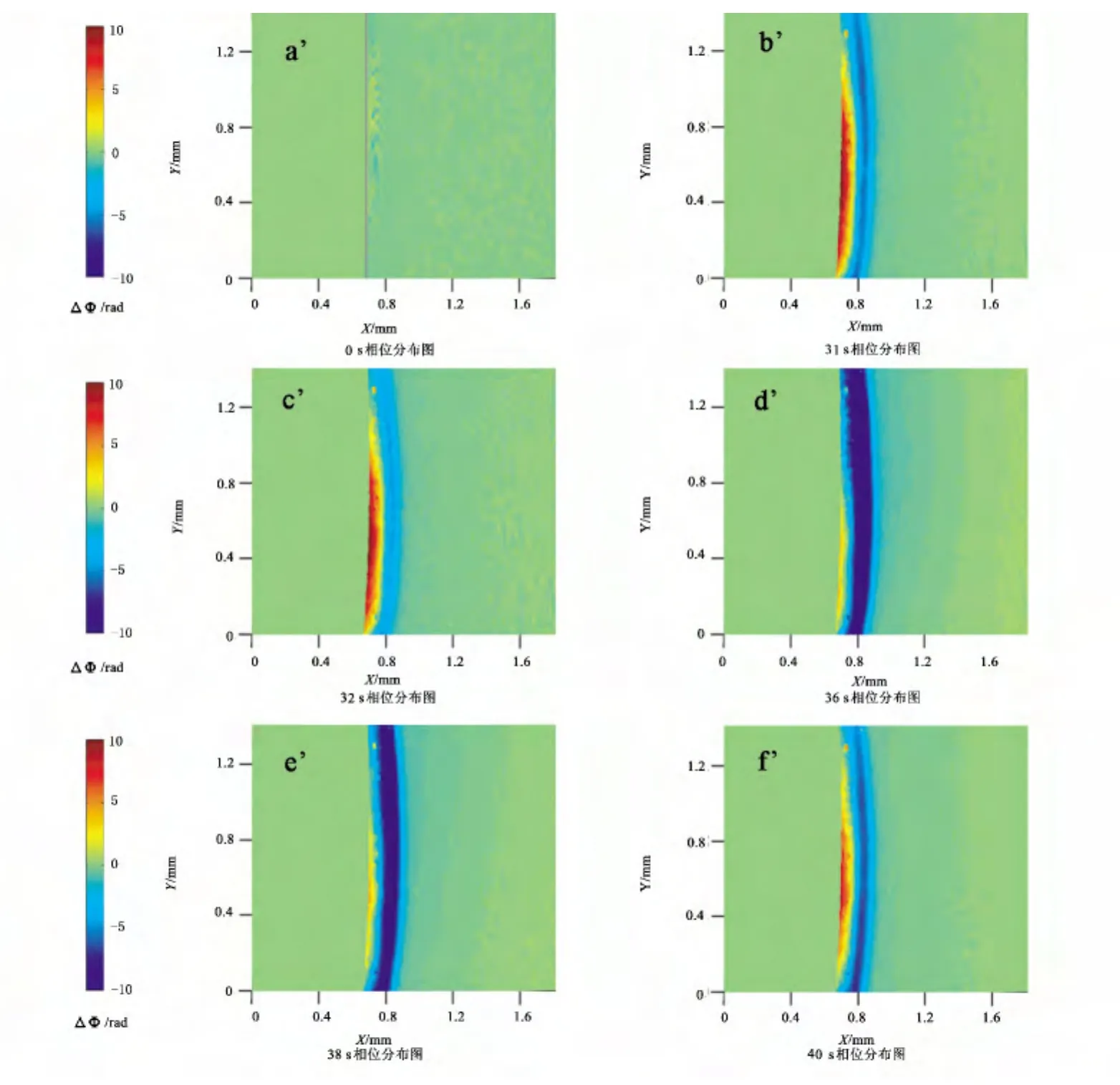
图4 含有SCN-的硫酸溶液不同时间点极化相位分布图
我们选取了一个振荡周期进行观测.当电极由钝化状态向活化状态转变时(图4b’~图4c’),电流升高,内层红色区域增多,电极附近的Ni(Ⅱ)浓度升高,为保持电中性,等当量的H+通过迁移离开电极表面,导致局部区域pH值升高,有利于镍氢氧化物膜的生成;与此同时,本体溶液中的SO2-4向电极表面迁移,达到一定程度后形成盐膜并逐步增厚(图4d’~图4e’);盐膜的存在促进了表面膜的形成,电极表面的活化溶解受到抑制,电流快速下降,电极进入钝化状态.根据文献[8,10],镍在硫酸溶液中的阳极溶解过程可能按以下步骤进行:
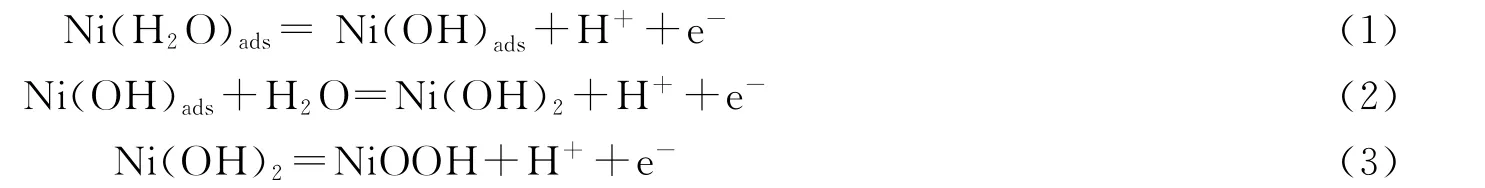
当溶液中有SCN-存在时,由于具有较强的表面吸附活性,SCN-可与OH-在镍表面产生竞争吸附,并与Ni(Ⅱ)、Ni(Ⅲ)发生络合反应,使表面氢氧化物膜或羟基氧化膜逐渐溶解.同时,电极钝化后,盐膜逐渐溶解,H+反向扩散到电极表面附近,氢氧化物膜也会溶解,红色区域增加(图4f’),电极再次进入活化状态,电流增大.如此循环,产生了电流振荡.
3 结论
本文采用循环伏安、恒电位极化等方法,并结合数字全息术研究了镍在含有硫氰酸根的硫酸溶液中的阳极溶解行为.在一定电位范围内,硫氰酸根的加入使镍在阳极溶解过程中产生电流振荡,其主要原因是:随着反应的进行,电极表面Ni2+溶出,等当量的H+通过迁移离开电极表面,局部区域pH值升高,有利于镍氢氧化物膜的生成,外层盐膜的增厚保护了电极表面氢氧化物膜,进一步促进表面膜的形成,并可能伴随有Ni(Ⅲ)的生成,电极进入钝化状态;由于SCN-与Ni(Ⅱ)或Ni(Ⅲ)形成配合物,使得钝化膜溶解,从而导致电极表面钝化膜生成、溶解的相互转化,形成电流振荡.
[1]Barbosa M R,Real S G,Vilche J R,et al.Comparative potentiodynamic study of nickel in still and stirred sulfuric acid in the 0.4-5.7pH range[J].Joumal of The Electrochemical Society,1988,135(5):1077-1085.
[2]Indira K S,Rangarajan S K,Doss K S G .Further studies on periodic phenomena in passivating systems[J].Joumal of Electroanal ytical Chemistry and Ineerfacial Electrochemistiy,1969,21(1):57-68.
[3]Doss K S G,Deshmukh D.Electrochemical potential oscillations:The nickel-sulphuric acid system[J].Journal of Electroanalytical Chemistry and Interfacial Electrochemistry,1976,70(2):141-156.
[4]Osterwaid J,Feller H G.Periodic phenomena at a nickel electrode in sulfuric acid[J].Journal of The Electrochemical Society,1960,107(5):473-474.
[5]Haim D,Lev O,Pismen L M,et al.Modelling spatiotemporal patterns in anodic nickel dissolution[J].Chemical Engineering Science,1992,47(15):3907-3913.
[6]Champagnie A M,Tsotsis T T.Webster I A.Experimental investigations of electrochemical reaction dynamics[J/OL].AIChE Annual Meeting,San Francisco,November,1989.[2015-4-20].http://www.aiche.org/conferences past?field global-con.
[7]崔海涛,陈慎豪,赵世勇.氯离子诱导的镍在硝酸溶液中的电流振荡[J].山东大学学报:理学版,2002,37(2):149-152.
[8]郑菊芳,李则林.镍在含硫氰酸根的硫酸溶液中电溶解的电流振荡[J].浙江师范大学学报:自然科学版,2008(4),31:432-436.
[9]Yuan B,Wang C,Li L,et al.Investigation of the effects of the magnetic field on the anodic dissolution of copper in NaCl solutions with holography[J].Corrosion.Science.,2012,58:69-78.
[10]Real S G,Vilche J R,Arvia A J.The characteristic of the potentiodynamic potential/ccurrent profiles obtained with the Ni/0.5NH2SO4interface,A contribution to the mechanism of the electrode process[J].Corrosion Science,1980,20:563-586.
[11]Burstein G T,Wright G A.The anodic dissolution of nickel-1:Perchlorate and fluoride electrolytes[J].Clectrochimica Acta,1975,20(1):95-99.
[12]Yuan B,Zhang J,Gao G,et al.Dynamic observation of the diffusion layer in anodic processes of the Fe/H2SO4system with digital holography[J].Electrochemistry Communications,2013,27:116-119.
