5 种食用菌多糖理化性质及免疫活性的比较研究
2015-10-29罗建平潘利华查学强
刘 苏,姜 玥,罗建平*,潘利华,查学强
(合肥工业大学生物与食品工程学院,安徽 合肥 230009)
5 种食用菌多糖理化性质及免疫活性的比较研究
刘苏,姜玥,罗建平*,潘利华,查学强
(合肥工业大学生物与食品工程学院,安徽 合肥 230009)
目的:研究平菇、茶树菇、香菇、木耳、金针菇5 种食用菌多糖的理化性质和免疫活性,为食用菌的开发利用提供理论支持。方法:采用水提醇沉法提取多糖;采用分光光度法、高效凝胶渗透色谱法(high performance gel permeation chromatography,HPGPC)、气相色谱-质谱联用法(gas chromatography-mass spectrometry,GC-MS)、红外光谱法(infrared spectrometry,IR)分析多糖的理化性质;采用酶联免疫吸附法(enzyme-linked immunosorbent assay,ELISA)测定多糖的免疫活性。结果:相同条件下,5 种食用菌多糖提取率依次为平菇多糖(Pleurotus ostreatus polysaccharides,POP)3.39%、茶树菇多糖(Agrocybe chaxingu polysaccharides,ACP)2.71%、金针菇多糖(Flammulina velutipes polysaccharides,FVP)2.69%、香菇多糖(Lentinus edodes polysaccharides,LEP)2.32%和木耳多糖(Auriculari aauricular polysaccharides,AAP)2.31%,它们均由分子质量不同、糖苷键为β-构型的多糖组分组成,均含有甘露糖(mannose,Man)、葡萄糖(glucose,Glc)和半乳糖(galactose,Gal)残基,且ACP还含有鼠李糖(rhamnose,Rha)和阿拉伯糖(arabinose,Ara),AAP还含有少量的木糖(xylose,Xyl);甲基化分析显示不同多糖具有不同的糖苷键连接方式,POP和LEP以→1,3-β-Glc和→1,6-β-Glc为主要连接方式,ACP以→1,6-β-Glc和→1,6-β-Gal为主要连接方式,而AAP和FVP是以→1,4-β-Glc为主要连接方式;体外免疫活性实验结果表明,5 种多糖在25~400 μg/mL质量浓度范围内无细胞毒性,可不同程度地提高巨噬细胞的吞噬能力和促进巨噬细胞分泌NO、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白细胞介素-1β(interleukin-1β,IL-1β)的能力,其中以→1,3-β-Glc和→1,6-β-Glc为主要连接方式的LEP活性最强,以→1,3-β-Glc和→1,6-β-Glc为主要连接方式的POP次之,以→1,6-β-Glc和→1,6-β-Gal为主要连接方式的ACP效果一般,以→1,4-β-Glc为主要连接方式的AAP和FVP效果最差。结论:5 种食用菌多糖具有不同的理化性质和对巨噬细胞的免疫调节活性,且活性大小与多糖是否含有→1,3-β-Glc和→1,6-β-Glc连接方式相关。
食用菌;多糖;理化性质;巨噬细胞;免疫调节
食用菌是指子实体硕大、可供食用的大型真菌[1],通称为蘑菇,多属担子菌亚门。中国的食用菌资源十分丰富,是最早栽培和利用食用菌的国家之一[2]。大量研究已经证实,多糖是食用菌的主要活性成分[3],具有抗氧化[4-5]、调节免疫力[6-7]、抗肿瘤[8-9]、降血糖[10-11]、抗炎[12]等多种功效。常见的食用菌种类很多,已有的报道主要是单种食用菌多糖提取工艺和生物活性的研究,由于提取条件和活性评价体系不同,不同食用菌多糖的理化性质和生物活性是否相同无法直接比较,因此限制了不同食用菌的合理开发。本实验以平菇、茶树菇、香菇、木耳、金针菇5 种最常见的食用菌为代表,在相同条件下提取多糖,并对它们的理化性质和和免疫活性进行对比研究,以期为它们的开发利用提供依据。
1 材料与方法
1.1材料与试剂
平菇、茶树菇、香菇、木耳、金针菇新鲜子实体购于合肥市家乐福超市。
SPF级雌性昆明小鼠,体质量(20±2) g,购自安徽医科大学实验动物中心,合格证号:SCXK(皖)2011-002。
葡聚糖标准品、不同单糖标准品、台盼蓝、碘甲烷美国Sigma公司;RPMI-1640培养基 美国HyClone公司;Hank's液、青霉素、链霉素 北京Solarbio科技有限公司;肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)试剂盒、白细胞介素-1β(interleukin-1β,IL-1β)试剂盒 美国R&D公司;其他试剂均为国产分析纯。
1.2仪器与设备
LGJ-18S型原位冷冻干燥机 北京松源华兴科技发展有限公司;CT15RT型高速冷冻离心机 上海天美科学仪器有限公司;V-1100型可见光分光光度计 上海美谱达仪器有限公司;MCO-17AIC型CO2细胞培养箱日本Sanyo公司;Model680型酶标仪 美国Bio-Rad公司;1260Infinity型高效液相色谱仪、7890A型气相色谱仪 美国安捷伦科技有限公司;Paragon-1000型红外光谱仪 美国PE公司;GCMS-QP2010型气相色谱-质谱联用仪 日本岛津公司。
1.3方法
1.3.1多糖的制备
5 种食用菌经粉碎干燥、乙醇浸提后,将干燥的残渣以料液比1∶40(m/V)加蒸馏水80 ℃条件下重复提取2 次,每次2 h。提取的滤液合并,60 ℃条件下浓缩后离心,取上清液经终体积分数80%的乙醇过夜沉淀、脱蛋白、透析(截留分子质量为3 500 D)、冷冻干燥后分别得平菇多糖(Pleurotus ostreatus polysaccharides,POP)、茶树菇多糖(Agrocybe chaxingu polysaccharides,ACP)、香菇多糖(Lentinus edodes polysaccharides,LEP)、木耳多糖(Auriculari aauricular polysaccharides,AAP)和金针菇多糖(Flammulina velutipes polysaccharides,FVP)。
1.3.2多糖的理化特性分析
5 种食用菌多糖的多糖含量、蛋白质含量以及特性黏度分别采用苯酚-硫酸法[13]、考马斯亮蓝法[14]和一点法[15]测定。多糖的分子质量采用高效凝胶渗透色谱法(high performance gel permeation chromatography,HPGPC)测定,色谱柱和色谱条件参照文献[16]的方法。多糖的红外光谱分析以及单糖组成和甲基化分析参照文献[16]的方法进行。
1.3.3多糖的免疫活性测定
按文献[17]的方法制备小鼠腹腔巨噬细胞,并调整细胞浓度为5×106个/mL。分别取96 孔培养板,每孔加入90 μL或180 μL纯化的腹腔巨噬细胞悬液和10 μL或20 μL不同质量浓度的样品溶液,空白对照组和阳性对照组分别以RPMI-1640培养基和脂多糖(lipopolysaccharide,LPS)(30 μg/mL)代替样品溶液,每组均设4 个复孔。共同培养24 h后,按文献[18]的方法测定巨噬细胞对中性红的吞噬作用,按酶联免疫吸附法(enzyme-linked immunosorbent assay,ELISA)试剂盒操作规程测定TNF-α、IL-1β含量,按硝酸还原酶法试剂盒说明书方法测定NO的生成量。
1.3.4不同多糖的免疫活性比较
采用均一化计算模长法,对5 种食用菌多糖的免疫调节活性进行比较。设置4 个向量Xi(i=1、2、3、4;X1~X4分别代表TNF-α、IL-1β、NO和吞噬能力4 项原始指标与相应对照组的比值),根据模长公式计算||X||2。数据采用SPSS 17.0进行分析。
||X||2=[X1/(X1+X2+X3+X4)]2+[X2/(X1+X2+X3+ X4)]2+[X3/(X1+X2+X3+X4)]2+[X4/(X1+X2+X3+X4)]2
2 结果与分析
2.15 种食用菌多糖的理化性质
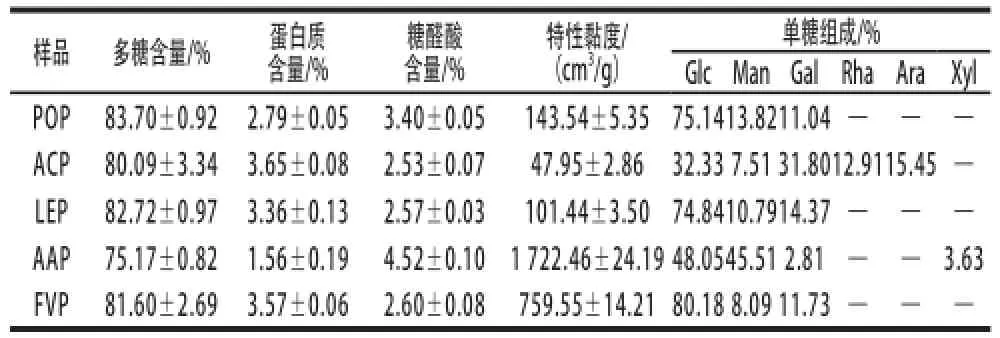
表1 5 种食用菌多糖的理化特性Table1 Physicochemical properties of the polysaccharides extracted from five edible mushrooms
经相同条件水提醇沉后,平菇、茶树菇、金针菇、香菇、木耳的多糖提取率分别是3.39%、2.71%、2.69%、2.32%和2.31%,说明不同食用菌的水溶性多糖含量不同。由表1可知,5 种食用菌多糖的碳水化合物含量均在75%以上,都有一定含量的蛋白质和糖醛酸,它们的特性黏度大小依次是木耳多糖(AAP)>金针菇多糖(FVP)>平菇多糖(POP)>香菇多糖(LEP)>茶树菇多糖(ACP)。HPGPC结果表明,5 种食用菌多糖均由分子质量不同的组分所组成,分子质量的分布范围具有相似性(图1)。红外光谱分析显示,5 种食用菌多糖均在3 400、2 930、1 650、1 250 cm-1附近具有典型的多糖特征吸收峰,在1 080 cm-1附近出现的吸收峰表明5 种多糖均含有吡喃型糖残基,在880 cm-1附近的吸收峰表明5 种多糖的糖苷键连接方式均为β-构型(图2)。单糖组成分析(表1)表明,不同食用菌多糖具有不同的单糖组成,它们除含有不同比例的Man、Glc和Gal外,ACP还含有Rha和Ara,AAP还含有少量的Xyl。甲基化分析(表2)显示,5 种食用菌多糖单糖残基间的糖苷键连接方式表现出很大的差异,POP和LEP以β-(1→3)-D-Glc和β-(1→6)-D-Glc为主要连接方式,ACP以β-(1→6)-D-Glc和β-(1→6)-D-Gal为主要连接方式,而AAP和FVP是以β-(1→4)-D-Glc为主要连接方式。
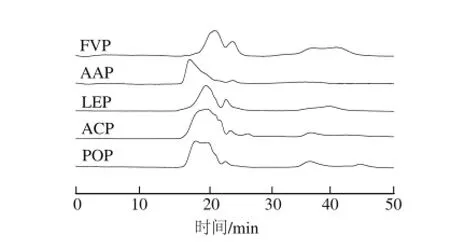
图1 5 种食用菌多糖的HPGPC图Fig.1 HPGPC profiles of the polysaccharides extracted from five edible mushrooms
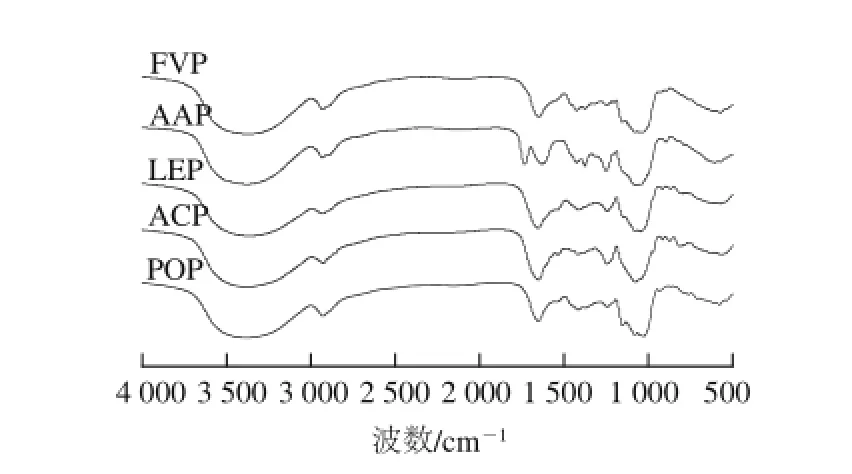
图2 5 种食用菌多糖的红外光谱图Fig.2 FT-IR profiles of the polysaccharides extracted from five edible mushrooms
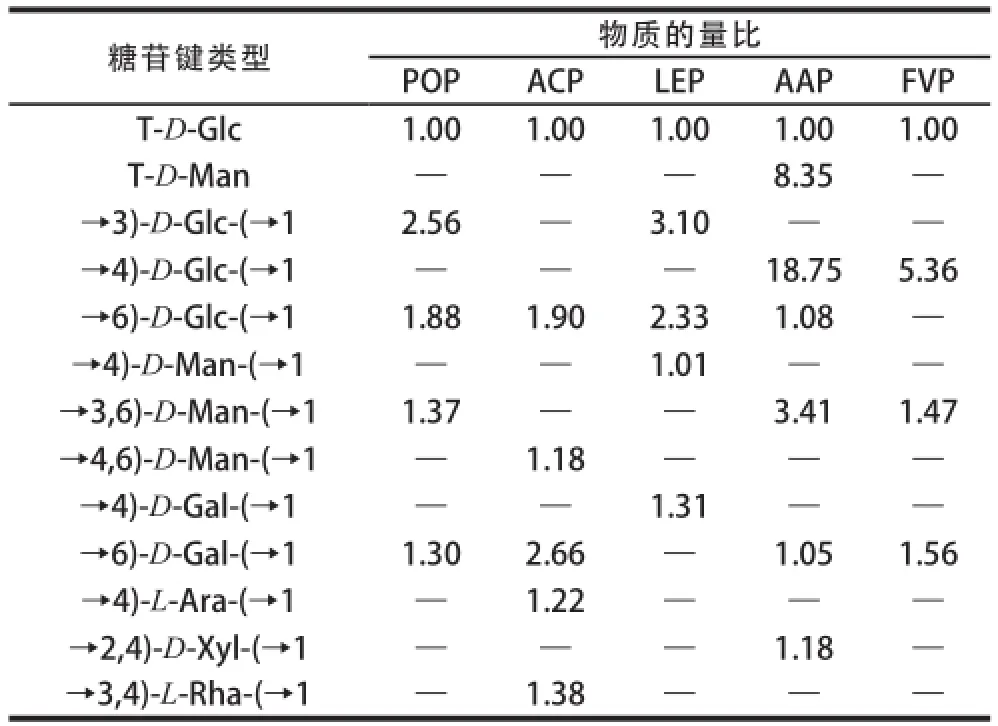
表2 5 种食用菌多糖的甲基化分析数据Table2 Methylation analysis of the polysaccharides extracted from five edible mushrooms
2.25 种食用菌多糖的免疫活性比较
巨噬细胞作为机体天然免疫防线的重要组成部分,当其被激活后,细胞体积增大,酸性水解酶活性提高,杀伤细菌和吞噬消化异物能力增强[19]。由图3可知,在25~400 μg/mL质量浓度范围内,5 种食用菌多糖对巨噬细胞吞噬中性红能力的作用呈低质量浓度促进、高质量浓度抑制的“钟罩型”剂量依赖关系,但它们促进巨噬细胞吞噬能力的最有效质量浓度不同,LEP的有效质量浓度是50 μg/mL,POP、AAP和FVP的有效质量浓度是100 μg/mL,ACP的有效质量浓度是200 μg/mL。与空白对照组相比,POP、ACP、LEP、AAP和FVP 5 种多糖在各自最有效质量浓度时,巨噬细胞的吞噬能力分别提高了1.06、0.88、1.03、0.78、0.52 倍。
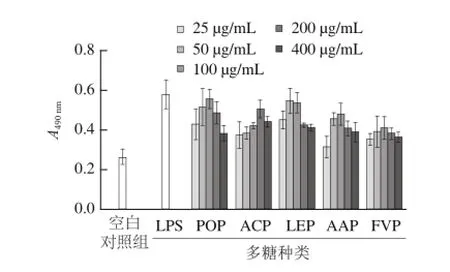
图3 5 种食用菌多糖对小鼠腹腔巨噬细胞吞噬能力的影响Fig.3 Effects of the polysaccharides extracted from five edible mushrooms on the phagocytosis of peritoneal macrophages
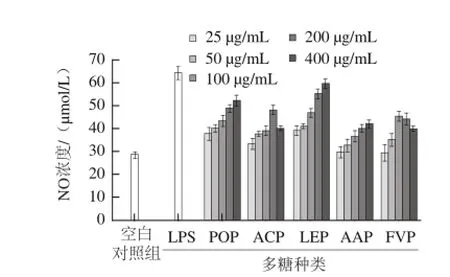
图4 5 种食用菌多糖刺激小鼠腹腔巨噬细胞产生NO量Fig.4 Effects of the polysaccharides extracted from five edible mushrooms on the release of NO by peritoneal macrophages
NO的合成与释放增加是巨噬细胞被激活参与免疫反应的一个重要指标[20-21]。如图4所示,在25~400 μg/mL质量浓度范围内,5 种食用菌多糖对巨噬细胞释放NO的作用表现不同,POP、LEP和AAP对巨噬细胞合成NO的促进作用随质量浓度的增加而增强,而ACP和FVP对巨噬细胞合成NO的作用呈低质量浓度促进、高质量浓度抑制的剂量依赖关系,ACP和FVP的最佳作用质量浓度分别是200 μg/mL和100 μg/mL。与空白对照组相比,POP、ACP、LEP、AAP和FVP 5 种多糖在各自最有效质量浓度时,巨噬细胞合成NO的能力分别提高了0.84、0.70、1.10、0.49、0.61 倍。
由图5可知,作为一种由巨噬细胞产生的促炎性和免疫调节细胞因子[22],TNF-α的表达与分泌可不同程度地被5 种食用菌多糖所激活。在25~400 μg/mL质量浓度范围内,POP、LEP和FVP刺激巨噬细胞分泌TNF-α的最佳作用质量浓度分别是200、200、100 μg/mL,而ACP和 AAP对巨噬细胞分泌TNF-α的促进作用随着质量浓度的增加而增强。与空白对照组相比,POP、ACP、LEP、AAP和FVP 5 种多糖在各自最有效质量浓度时,巨噬细胞分泌TNF-α的能力分别提高了0.81、0.74、0.83、0.62、0.46 倍。
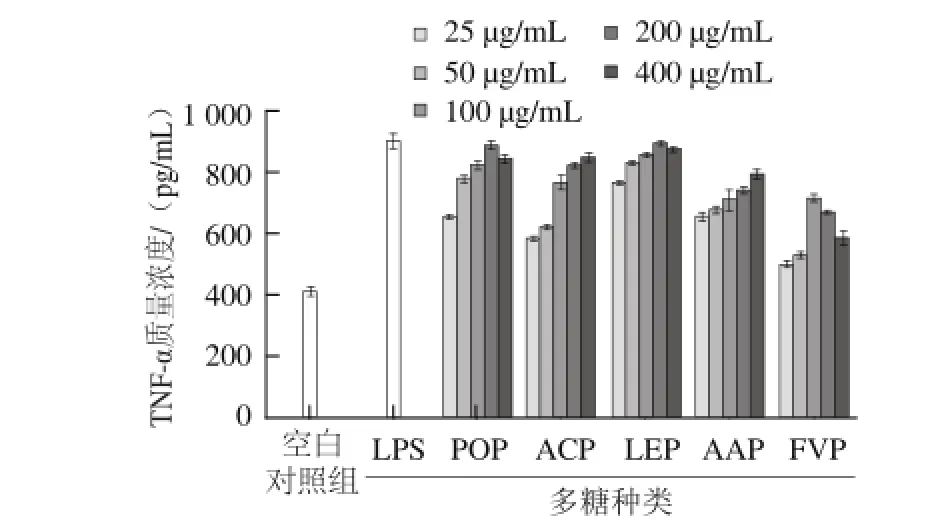
图5 5 种食用菌多糖刺激小鼠腹腔巨噬细胞分泌TNFF--α的影响Fig.5 Effects of the polysaccharides extracted from five edible mushrooms on the secretion of TNF-α by peritoneal macrophages
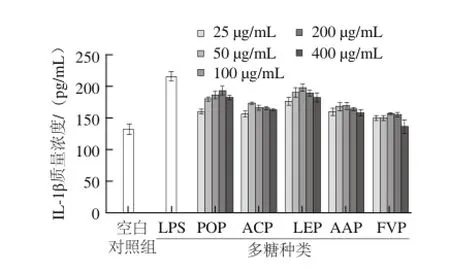
图6 5 种食用菌多糖刺激小鼠腹腔巨噬细胞分泌IL--11β的影响Fig.6 Effects of the polysaccharides extracted from five edible mushrooms on the secretion of IL-1β by peritoneal macrophages
IL-1β也是由巨噬细胞产生、并参与免疫应答反应的一种重要细胞因子[23]。由图6可知,在25~400 μg/mL质量浓度范围内,5 种食用菌多糖对巨噬细胞分泌IL-1β能力的影响均呈低质量浓度促进、高质量浓度抑制的剂量依赖关系,其中ACP的有效质量浓度是50 μg/mL,LEP、AAP和FVP的有效质量浓度是100 μg/mL,POP的有效质量浓度是200 μg/mL。POP、ACP、LEP、AAP和FVP 5 种多糖在各自有效作用质量浓度下,巨噬细胞分泌IL-1β的能力分别比空白对照组提高了0.47、0.32、0.51、0.29、0.20 倍。
基于上述巨噬细胞吞噬中性红、合成NO以及分泌TNF-α和IL-1β能力的变化,进一步采用均一化计算模长的数学方法,对5 种食用菌多糖的免疫调节活性进行比较,结果见表3。在25~400 μg/mL质量浓度范围内,LEP在400 μg/mL时的模长||X||2最大为0.849,将其他4 种多糖各质量浓度的模长进行方差分析显示,POP除25 μg/mL外,其余质量浓度与LEP(400 μg/mL)无显著差异;ACP除200 μg/mL外,其余质量浓度与LEP(400 μg/mL)均有极显著差异(P<0.01),AAP和FVP所有质量浓度与LEP(400 μg/mL)均有极显著差异(P<0.01),以上结果表明5 种多糖的免疫调节活性大小依次是LEP>POP>ACP>AAP>FVP。
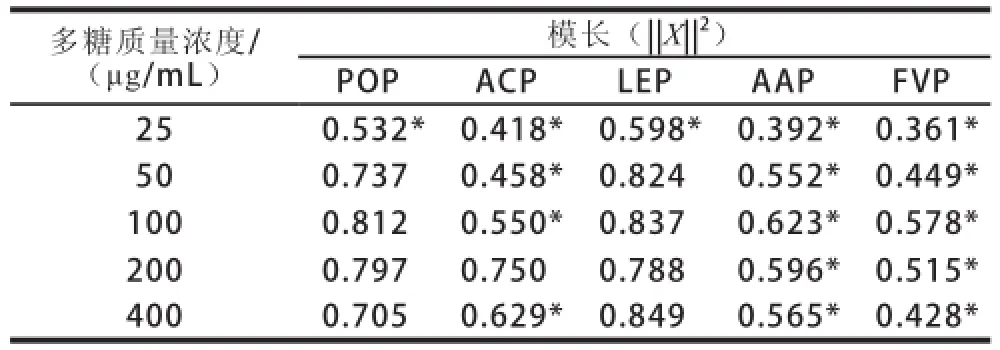
表3 5 种食用菌多糖的免疫活性比较Table3 Immunomodulating activity of the polysaccharides extracted from five edible mushrooms
参考5 种多糖的甲基化分析结果(表2),可以发现免疫活性最好的LEP和POP以β-(1→3)-D-Glc和β-(1→6)-D-Glc为主要连接方式,免疫活性一般的ACP以β-(1→6)-D-Glc和β-(1→6)-D-Gal为主要连接方式,而免疫活性较差的AAP和FVP是以β-(1→4)-D-Glc为主要连接方式。5 种食用菌多糖具有不同的免疫调节活性与多糖的单糖间的糖苷键连接方式相关,其中多糖是否含有→1,3-β-Glc和→1,6-β-Glc连接方式对其免疫活性具有重要影响。
3 结 论
本实验对5 种食用菌多糖的理化特性和免疫调节活性进行了比较研究,结果表明5 种食用菌多糖分子质量、单糖组成和糖苷键连接方式各不相同,但均为β-构型的多糖,5 种食用菌多糖对小鼠腹腔巨噬细胞的免疫功能均具有一定的调节作用,其中香菇多糖LEP和平菇多糖POP的作用最强,茶树菇多糖ACP的效果较好,木耳多糖AAP和金针菇多糖FVP的作用一般。理化特性和免疫活性的关联分析表明,5 种食用菌多糖是否表现出较强的免疫活性与多糖是否含有→1,3-β-Glc和→1,6-β-Glc连接方式相关。
[1] SULLIVAN R, SMITH J E, ROWAN N J. Medicinal mushrooms and cancer therapy: translating a traditional practice into Western medicine[J]. Perspectives in Biology and Medicine, 2006, 49(2): 159-170.
[2] 余志坚, 陈传红, 赵晋宇. DNS法检测食用菌多糖含量条件优化研究[J]. 江苏农业科学, 2012, 40(1): 259-260.
[3] 李月梅. 食用菌的功能成分与保健功效[J]. 食品科学, 2005, 26(8):517-521.
[4] 程超, 李伟, 汪兴平. 平菇水溶性多糖结构表征与体外抗氧化作用[J].食品科学, 2005, 26(8): 55-57.
[5] YEN G C, WU J Y. Antioxidant and radical scavenging properties of extracts from Ganoderma tsugae[J]. Food Chemistry, 1999, 65(3):375-379.
[6] KOH J H, YU K W, SUH H J, et al. Activation of macrophages and the intestinal immune system by an orally administered decoction from cultured mycelia of Cordyceps sinensis[J]. Bioscience, Biotechnology,and Biochemistry, 2002, 66(2): 407-411.
[7] 方一泓, 余萍, 李薇, 等. 茶树菇子实体多糖的分离纯化和免疫活性研究[J]. 食用菌学报, 2007, 13(4): 63-73.
[8] WASSER S. Medicinal mushrooms as a source of antitumor and immunomodulating polysaccharides[J]. Applied Microbiology and Biotechnology, 2002, 60(3): 258-274.
[9] YU Zhang, MING Gu, KAIPING W, et al. Structure, chain conformation and antitumor activity of a novel polysaccharide from Lentinus edodes[J]. Fitoterapia, 2010, 81(8): 1163-1170.
[10] 王峰, 陶明煊, 程光宇, 等. 4 种食用菌提取物自由基清除作用及降血糖作用的研究[J]. 食品科学, 2009, 30(21): 343-347.
[11] 杜梅, 张松. 食用菌多糖降血糖机理研究[J]. 微生物学杂志, 2007,27(2): 83-87.
[12] WU D, DUAN W, LIU Y, et al. Anti-inflammatory effect of the polysaccharides of golden needle mushroom in burned rats[J]. International Journal of Biological Macromolecules, 2010, 46(1): 100-103.
[13] DUBOIS M, GILLES K A, HAMILTON J K, et al. Colorimetric method for determination of sugars and related substances[J]. Analytical Chemistry, 1956, 28(3): 350-356.
[14] BRADFORD M M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of proteindye binding[J]. Analytical Biochemistry, 1976, 72(1): 248-254.
[15] SHROFF R N. Single-point determination of intrinsic viscosity[J]. Journal of Applied Polymer Science, 1965, 9(4): 1547-1551.
[16] ZHA Xueqiang, LUO Jianping, LUO Shuizhong, et al. Structure identification of a new immunostimulating polysaccharide from the stems of Dendrobium huoshanense[J]. Carbohydrate Polymers, 2007,69(1): 86-93.
[17] LIM T S, NA K, CHOI E M, et al. Immunomodulating activities of polysaccharides isolated from Panax ginseng[J]. Journal of Medicinal Food, 2004, 7(1): 1-6.
[18] 戴玲, 王华, 陈彦. 白头翁糖蛋白对小鼠腹腔巨噬细胞免疫的增强作用[J]. 中国生化药物杂志, 2000, 21(5): 230-232.
[19] AYALA A, PERRIN M M, CHAUDRY I H. Defective macrophage antigen presentation following haemorrhage is associated with the loss of MHC classⅡ(Ia) antigens[J]. Immunology, 1990, 70(1): 33-39.
[20] BOSC☒ L, ZEINI M, TRAV☒S P G, et al. Nitric oxide and cell viability in inflammatory cells: a role for NO in macrophage function and fate[J]. Toxicology, 2005, 208(2): 249-258.
[21] HIBBS J B, TAINTOR R R, VAVRIN Z, et al. Nitric oxide: a cytotoxic activated macrophage effector molecule[J]. Biochemical and Biophysical Research Communications, 1988, 157(1): 87-94.
[22] GEARING A J H, BECKETT P, CHRISTODOULOU M, et al. Processing of tumour necrosis factor-α precursor by metalloproteinases[J]. Nature,1994, 370: 555-557.
[23] 石榴. RNAi沉默NF-κB p65对小鼠巨噬细胞表达细胞因子的影响[D]. 广州: 南方医科大学, 2009: 30-31.
Physicochemical Properties and Immunomodulating Activities of Polysaccharides from Five Species of Edible Mushrooms
LIU Su, JIANG Yue, LUO Jianping*, PAN Lihua, ZHA Xueqiang
(School of Biotechnology and Food Engineering, Hefei University of Technology, Hefei 230009, China)
Objective: To investigate the physicochemical properties and immunomodulating activities of different edible mushroom polysaccharides. Methods: Water extraction-ethanol precipitation method was employed to isolate mushroom polysaccharides. Spectrophotometry, high performance gel permeation chromatography (HPGPC), gas chromatographymass spectrometry (GC-MS), infrared spectrometry (IR) and enzyme-linked immunosor bent assay (ELISA) were using to analyze the physicochemical properties and immunomodulatory activities of mushroom polysaccharides. Results:Under the same conditions, the descending order of extraction rate of five mushroom polysaccharides was Pleurotus ostreatus polysaccharides (POP), Agrocybe chaxingu polysaccharides (ACP), Flammulina velutipes polysaccharides(FVP), Lentinus edodes polysaccharides (LEP) and Auriculari aauricular polysaccharides (AAP). These polysaccharides from five different mushrooms had different molecular mass distributions. All the polysaccharides consisted of mannose(Man), glucose (Glc) and galactose (Gal) with β-configuration although ACP also contained rhamnose (Rha) and arabinose(Ara) and AAP contained a small quantity of xylose (Xyl). Methylation analysis indicated that different polysaccharides had different glucosidic linkage types. The main glucosidic linkage types of POP and LEP consisted of →1,3-β-Glc and →1,6-β-Glc whereas those of ACP consisted of →1,6-β-Glc and →1,6-β-Gal and those of AAP and FVP consisted of→1,4-β-Glc. In vitro experiment results showed that the five mushroom polysaccharides had no cytotoxicity at theconcentration ranging from 25 to 400 μg/mL, could improve the phagocytic capacity of mouse peritoneal macrophages and promote the secretion of NO, TNF-α and IL-1β from macrophages. Among all tested polysaccharides, LEP containing →1,3-β-Glc and →1,6-β-Glc showed the strongest immunomodulating activity followed in a descending order by POP containing →1,3-β-Glc and →1,6-β-Glc, ACP containing→1,6-β-Glc and→1,6-β-Gal, AAP and FVP containing→1,4-β-Glc. Conclusions: These five mushroom polysaccharides had different physicochemical properties and immunomodulating activities. Their immunomodulating activities depended on the existence of →1,3-β-Glc and →1,6-β-Glc.
edible mushroom; polysaccharides; physicochemical properties; macrophages; immunomodulation
S646
A
1002-6630(2015)13-0252-05
10.7506/spkx1002-6630-201513047
2014-08-11
刘苏(1990—),女,硕士,研究方向为中草药与功能食品。E-mail:liusu0203@163.com
罗建平(1966—),男,教授,博士,研究方向为中草药与功能食品。E-mail:jianpingluo@hfut.edu.cn
