4,6,16,18-四正丁氧基-11,23-二甲基-1,3,13,15-四磺酸酯间苯大环化合物对Sn2+和Bi3+的识别作用
2015-10-29王文革张德春
王文革,张德春*
(湖南工学院材料与化学工程系,湖南衡阳421002)
4,6,16,18-四正丁氧基-11,23-二甲基-1,3,13,15-四磺酸酯间苯大环化合物对Sn2+和Bi3+的识别作用
王文革,张德春*
(湖南工学院材料与化学工程系,湖南衡阳421002)
利用紫外光谱分析的方法研究了4,6,16,18-四正丁氧基-11,23-二甲基-1,3,13,15-四磺酸酯间苯大环化合物(1)对Ca2+、Pb2+及部分过渡金属等20种金属离子的识别。结果发现:其对Sn2+显示出一定的选择性,由于Sn2+和Bi3+协同作用的影响,在化合物(1)-Sn2+的体系中加入Bi3+,紫外吸收光谱在325nm左右的吸收增强了许多,这说明它对Bi3+显示出优于Sn2+的较好选择性。
大环化合物;磺酸酯;合成;紫外光谱;金属离子识别
芳香大环化合物可作为一个有效的合成平台,通过芳环上下缘结构修饰和骨架桥联部分杂原子化的建构,引入各种官能团,可形成结构和性能较为独特的三维空间,从而可以借助氢键、静电作用和范德华力等对金属阳离子、阴离子和有机分子产生选择性的识别能力[1]。
含氮、硫等杂原子的官能团的引入可以很好的增强对金属阳离子的配位能力[2]。目前,含酰胺基[3]、磺酰胺基[4]、氨基、邻二氮菲[5]、巯基[6]、酮[7]、腈和硫脲等官能团的大环化合物的合成和识别有见报道。我们将磺酸酯基和磺酰胺基引入大环化合物的桥联部分,构建了结构独特、可多点络合的大环化合物[8,9]。在前期工作的基础上,本文利用紫外光谱详细研究了4,6,16,18-四正丁氧基-11,23-二甲基-1,3,13,15-四磺酸酯间苯大环化合物(1)与20种金属离子的配位作用。
1 实验部分
主要仪器与试剂
UV-2700型紫外吸收光谱仪(日本岛津公司);DMF,ZnCl2,CaCl2,Pb(NO3)2,CuCl2,FeCl3,CdCl2,Mn⁃Cl2,CoCl2,NiCl2,CrCl3等均为分析纯试剂,溶剂经干燥处理后使用。实验用水为超纯水;4,6,16,18-四正丁氧基-11,23-二甲基-1,3,13,15-四磺酸酯间苯大环化合物(1)(见图1)按文献[9]的方法合成。

图1 大环化合物(1)的结构式
2 结果与讨论
2.1大环化合物(1)的紫外光谱性质研究
溶液配制:以DMF为溶剂,配制1.0×10-4mol·L-1的大环化合物(1)的溶液;以二次蒸馏水为溶剂,配制1.0×10-3mol·L-1的硝酸盐或氯化物的离子溶液(Zn2+,Ca2+,Pb2+,Cu2+,Fe3+,Cd2+,Mn2+,Co2+,Ni2+,Cr3+,Al3+,Ti3+,Ag+,Na+,Ba2+,Bi3+,Sr2+,Hg2+,Sn2+,K+)。以留备用,紫外光谱测定均在25℃条件下进行。
首先,取浓度为1.0×10-4mol·L-1的大环化合物(1)溶液1mL,用DMF定容至10mL,取3.0mL于比色皿中(石英比色皿厚度为1cm),测定紫外光谱(如2所示)。
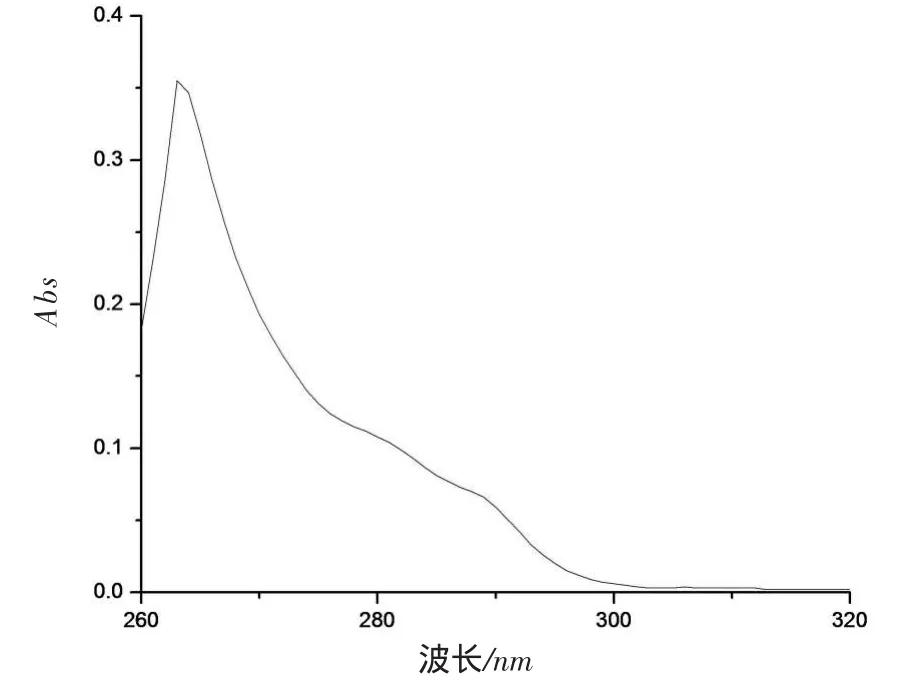
图2 大环化合物(1)(1.0×10-5m ol·L-1)在DMF中的紫外吸收光谱
大环化合物(1)的DMF溶液的最大紫外吸收峰在263nm处,是芳环的π π*跃迁所产生的。大环化合物(1)的摩尔吸光系数分别是3.55×104L·mol-1· cm-1。
2.2大环化合物(1)对金属离子的识别性能
取浓度为1.0×10-4mol·L-1的大环化合物(1)溶液1mL,1.0×10-3mol·L-1的金属离子溶液0.4mL,以DMF定容至10mL,分别配制含等摩尔量不同金属离子的混合溶液,利用紫外光谱,研究其对不同金属离子的选择性识别能力。当分别加入Zn2+,Ca2+,Pb2+,Cu2+,Fe3+,Cd2+,Mn2+,Co2+,Ni2+,Cr3+,Al3+,Ti3+,Ag+,Na+,Ba2+,Bi3+,Sr2+,Hg2+,K+这19种离子后,大环化合物(1)的紫外可见吸收光谱最大吸收峰的位置没有发生明显的变化,只是吸收强度有不同程度的改变。但是,当将Sn2+加入到大环化合物(1)的溶液中后,发生了较明显的变化,大环化合物(1)的吸收谱在300nm至340nm的区间内几乎有相同程度的增加,同时在364nm处出现了新的吸收峰,由于Sn2+在263 nm处有较弱吸收,因此在原来紫外光区的最大吸收峰(263 nm)强度有较小幅度提高(如图3所示)。

图3 大环化合物(1)(2.0×10-5m o l·L-1)-(1.4×10-4m o l·L-1)在加入不同浓度Sn2+后紫外吸收光谱变化曲线C(Sn2+)
另外,我们还研究了不同离子对大环化合物(1)对Sn2+识别的干扰试验。取浓度为1.0×10-4mol· L-1的大环化合物(1)溶液1.0mL,1.0×10-3mol·L-1的Sn2+溶液0.4mL,其它金属离子0.2mL(除Sn2+),定容至10mL,紫外光谱研究其它金属离子对Sn2+的干扰影响。当分别加入Zn2+,Ca2+,Pb2+,Cu2+,Fe3+,Cd2+,Mn2+,Co2+,Ni2+,Cr3+,Al3+,Ti3+,Ag+,Na+,Ba2+,Sr2+,Hg2+,K+这18种离子后,大环化合物(1)对Sn2+的紫外光谱吸收峰没有发生明显的变化,只是在263 nm处吸收强度有不同程度的改变,这是因为某些金属如Co2+,Hg2+,Ca2+等在263nm左右处有吸收。但是,当将Bi3+加入到主体大环化合物(1)和Sn2+的混合溶液后,发生了明显的变化,在325 nm处吸收峰增强了许多,原来在紫外光区的最大吸收峰(263 nm)强度有所降低(如图4所示)。
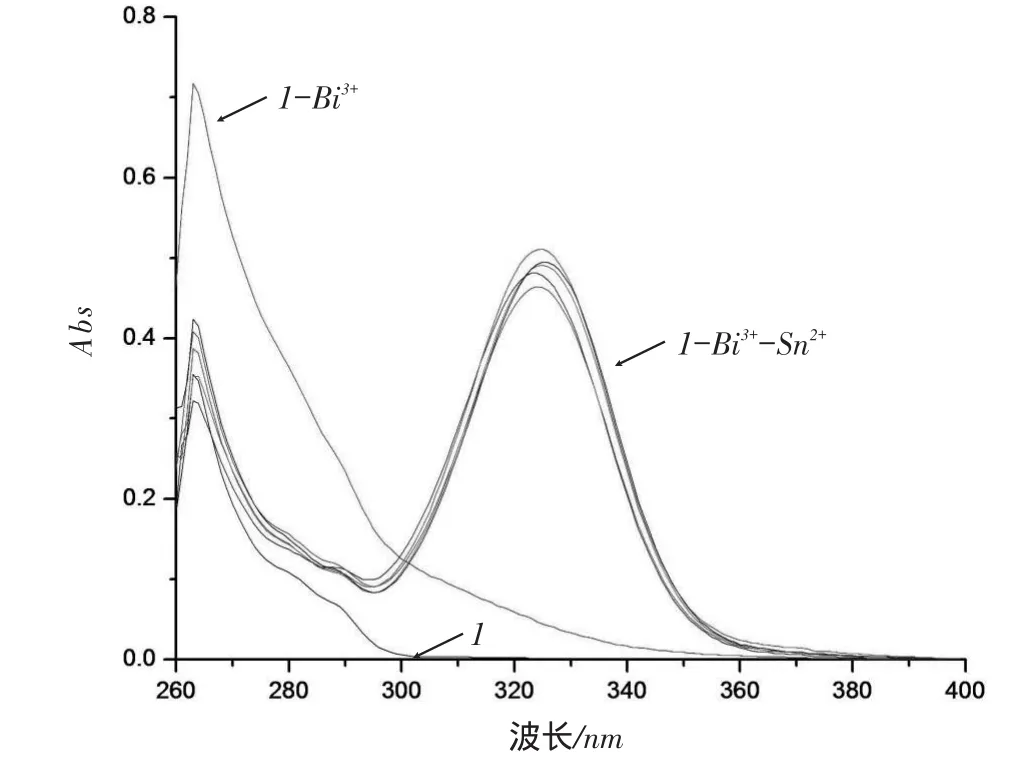
图4 大环化合物(1)(1.0×10-5m ol·L-1)-Bi3+(4.0×10-5m o l·L-1)在加入Sn2+(1.0×10-5-5.0×10-5m o l·L-1)前后紫外吸收光谱变化曲线

图5 大环化合物(1)(1.0×10-5m o l·L-1)-Sn2+(4.0×10-5m o l·L-1)在加入Bi3+(1.0×10-5-5.0×10-5m o l·L-1)前后紫外吸收光谱变化曲线
如图4和图5所示,当将Bi3+加入到大环化合物(1)中紫外吸收光谱发生了变化,是因为Bi3+最大吸收峰在264nm处,谱图是两者吸收峰叠加的结果。因此大环化合物(1)的吸收峰不随Bi3+的浓度改变而改变。我们研究了在Sn2+和Bi3+都存在的情况下,固定Bi3+(或Sn2+)的浓度,大环化合物(1)的吸收谱随Sn2+(或Bi3+)浓度变化的情况。将Sn2+加入大环化合物(1)-Bi3+体系中,紫外吸收光谱在325nm左右出现了强吸收峰,并且峰强度基本不受Sn2+浓度影响;将Bi3+加入大环化合物(1)-Sn2+体系中,紫外吸收光谱在325nm左右强吸收峰增强了许多,并且峰强度随Bi3+浓度的增大而增强,此吸收峰是Sn2+和Bi3+协同作用的结果。Sn2+和Bi3+与大环化合物(1)磺酸酯基中的氧发生配位作用,从而改变了电子跃迁的能级,出现了新的紫外吸收峰。由此,我们利用紫外吸收光谱在325nm左右是否出现了强吸收峰作为判断依据,可将大环化合物(1)用作Bi3+的选择性测定,且需在测定体系中加入少量的Sn2+。
以上的结果表明,大环化合物(1)对Sn2+显示出一定的选择性,但这种作用较弱。在大环化合物(1)-Sn2+(或大环化合物(1)-Bi3+)的体系中加入Bi3+(或Sn2+),由于Sn2+和Bi3+协同作用的影响,使其紫外吸收光谱在325nm左右的吸收增强了许多,这说明大环化合物(1)对Bi3+显示出优于Sn2+的较好选择性。
3 结论
大环化合物(1)紫外吸收光谱最大吸收峰在263nm,根据朗伯-比耳定律,计算得大环化合物(1)的摩尔吸光系数,3.55×104L·mol-1·cm-1。利用紫外光谱分析的方法研究了大环化合物(1)对20种金属离子的识别。结果发现:大环化合物(1)对Sn2+显示出一定的选择性,但这种作用较弱。在大环化合物(1)-Sn2+(或大环化合物(1)-Bi3+)的体系中加入Bi3+(或Sn2+),由于Sn2+和Bi3+协同作用的影响,使其紫外吸收光谱在325nm左右的吸收增强了许多,这说明大环化合物(1)对Bi3+显示出优于Sn2+的较好选择性。关于两种离子Sn2+和Bi3+与大环化合物的作用机理,目前还不清楚,待进一步研究。
可以预见,磺酸酯类桥联大环化合物与金属配位的良好性能会吸引更多的关注,将来会有更好的发展空间。
[1]罗勤慧.大环化学(第一版)[M].北京:科学出版社,2009:130-151.
[2]王鹤文,冯亚青,孟舒献.键合香豆素席夫碱基的杯[4]芳烃的合成及其对金属离子的荧光识别作用[J].应用化学,2013,30(3):300-304.
[3]张德春,王文革.含多种杂原子的桥联杯芳烃的合成研究进展[J].化工新型材料,2011,39(12):22,23,110.
[4]He Lan,An Yu,Yuan Lihua,et al.Shape-persistentmacrocyclic aromatic tetrasulfonamides:Moleculeswith nanosized cavities and their nanotubular assemblies in solid state[J].Proc Natl Acad SciUSA,2006,103(29):10850-10855.
[5]李亮,戚伟光,王超,颜朝国.对叔丁基杯[4]芳烃-1,3-二取代邻菲罗啉衍生物的合成及对Ag+的识别作用[J].有机化学,2013,33,1804-1809.
[6]赵邦屯,周振,颜振宁.含苯并噁唑基的硫桥杯[4]芳烃衍生物的合成及结构[J].有机化学,2009,29(10):1682-1686.
[7]徐志珍,李永霞,卢青,等.杯[8]芳香酮衍生物萃取分离稀土金属钕、铕、镨离子的研究[J].无机化学学报,2012,28(10):2121-2129.
[8]王文革,张德春.几种磺酸酯桥联杯芳烃的一锅法合成及对金属离子的萃取性能[J].应用化学,2013,30(5):511-515.
[9]王文革,张德春,张春燕,等.芳香寡聚磺酰胺大环化合物的合成[J].科学通报,2013,58:438-443.
Selective recognition of4,6,16,18-tetrabutyloxy-11,23-dim ethyl-1,3,13,15-tetrasulfonic acid esterm-benzenemacrocycle toward Sn2+and Bi3+
WANGW en-ge,ZHANG De-chun
(Departmentofmaterials&Chemical Engineering,Hunan Institute ofTechnology,Hengyang Hunan 421002)
The recognition of4,6,16,18-Tetrabutyloxy-11,23-dimethyl-1,3,13,15-Tetrasulfonic Acid Ester m-benzene Macrocycle forCa2+,Pb2+and some transitionmetal ionswere studied by UV spectroscopy.The primary results showed that compound 1 has some recognition abilities for Sn2+,and because of the synergy influence ofthe Sn2+and Bi3+,if Bi3+solution is added into compound and Sn2+system,the absorption peak at 325 nm increased greatly in UV spectroscopy,this showed thatcompound 1 have the betterrecognition abilitiesforBi3+than Sn2+.
macrocyclic compound;sulfonate;synthesis;Uv spectra;metal ion recognition
10.3969/j.issn.1008-1267.2015.06.0005
O625
A
1008-1267(2015)06-0014-04
2015-06-01
湖南省重点学科建设项目、衡阳市科学技术发展计划项目(2014KS39)和广西师范大学药用资源与药物分子工程教育部重点实验室开放基金(CMEMR2011-03)资助。
王文革,(1968~),男,博士,副教授;研究方向:大环化合物的合成和不对称合成及性能研究。
