泽泻的化学成分及生物活性研究进展
2015-10-28徐硕夏路风金鹏飞等
徐硕 夏路风 金鹏飞等


[摘要] 通过查阅国内外相关文献,进行归纳、分析,对泽泻的化学成分及生物活性进行综述,结果显示泽泻所含的化学成分可分为三萜类、倍半萜类、二萜类和其他类。现代药理研究表明,泽泻具有抑制肾结石形成、降血压、抗动脉粥样硬化、降血糖、免疫调节、抗肿瘤等多种生物活性。泽泻的现代研究尽管取得了一定的进展,但仍存在一些问题,需要进一步探讨。
[关键词] 泽泻;化学成分;生物活性
[中图分类号] R285.5 [文献标识码] A [文章编号] 1673-7210(2015)09(c)-0047-05
[Abstract] The domestic and foreign researches on chemical constituents and bioactivities of Alismatis Rhizoma are reviewed and analyzed. Triperpenoids, sesquiterpenoids, diterpenoids and other compounds have been isolated from Alismatis Rhizoma. Modern pharmacological researches indicates that Alismatis Rhizoma shows renal stone formation inhibition, antihypertensive, anti-atherosclerosis, hypoglycemic, immunomodulatory and antitumor effects. Although much progress has been made in modern research of Alismatis Rhizoma, there are still some problems for the further exploration.
[Key words] Alismatis Rhizoma; Chemical constituent; Bioactivity
泽泻为泽泻科植物泽泻Alisma orientale(Sam.)Juzep.的干燥块茎,性寒、味甘,归肾、膀胱经,具有利水渗湿、泄热、化浊降脂之功效,可用于小便不利、水肿胀满、泄泻尿少、痰饮眩晕、热淋涩痛、高脂血症等[1]。泽泻由于含有丰富的化学成分以及多种生物活性而受到药学工作者的关注,对其研究的范围和数量不断扩展。本文对近年来泽泻的化学成分及生物活性研究进行概述,为该药材的进一步研究提供参考。
1 化学成分研究
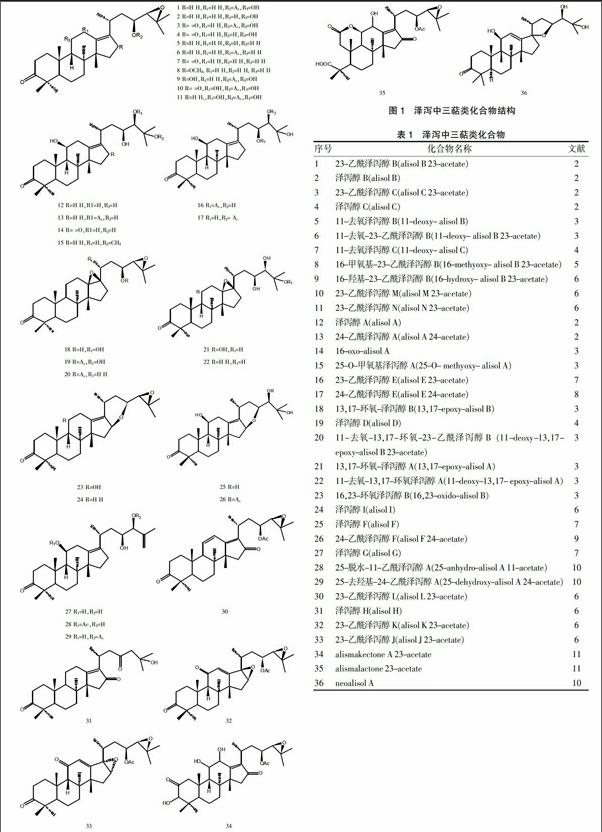
1.1 三萜类化合物
从泽泻中分离得到36个三萜类化合物,其结构多为原萜烷型四环三萜。该类化合物结构见图1,名称见表1。
1.2 倍半萜类化合物
从泽泻中分离得到的16个倍半萜类化合物中,主要为愈创木烷型,其次为吉玛烷型、桉叶烷型及Oplopanane型,其结构见图2,名称见表2。
1.3 二萜类化合物
从泽泻中分得3个贝壳杉烷型四环二萜类化合物,其结构见图3,名称见表3。
1.4 其他类化合物
除以上结构类型外,从泽泻中还分离得到一些其他类成分,见表4。
2 生物活性研究
2.1 抑制肾结石形成
尹春萍等[19]分别采用Robertson籽晶粒度法和活体大鼠肾结石造模法对泽泻水提取液的体内外抗结石作用进行了研究,发现水提取液体外能明显抑制草酸钙结晶的生长和聚集,体内能明显降低肾钙含量和减少肾小管内草酸钙结晶形成而抑制大鼠的实验性肾结石形成。曹正国等[20]和米其武等[21]还发现泽泻乙酸乙酯提取物能通过抑制肾组织内草酸钙晶体的形成和减少肾间α胰蛋白酶抑制物的表达与抑制肾骨蛋白的表达来抑制尿结石的形成。
2.2 对心血管系统的作用
泽泻乙醇提取物给兔静脉注射可使其血压迅速下降,泽泻经甲醇、苯和丙酮提取的组分可使猫和兔的血压下降。离体兔心灌注实验表明,泽泻醇提物的水溶性部分能显著增加冠脉流量,对心率无明显影响,对心肌收缩力呈轻度的抑制作用。体外实验发现泽泻对正常和肝硬变大鼠均具有明显的血管扩张作用。这可能是通过血管内皮细胞增加前列环素(PGI2)和一氧化碳(NO)的释放而发挥扩血管作用[22]。
2.3 降血脂及抗动脉粥样硬化作用
泽泻提取物对兔实验性高胆固醇血症有明显降胆固醇作用,其机制可能与其干扰外源性胆固醇的吸收和内源性胆固醇代谢有关[23]。泽泻能降低血中低密度脂蛋白胆固醇(LDL-C),升高高密度脂蛋白胆固醇(HDL-C),从而防止动脉粥样硬化的发生和发展[24]。泽泻水提物和醇提物能明显降低肥胖小鼠血清总胆固醇(TC)和三酰甘油(TG),升高HDL-C的浓度[25]。
2.4 降血糖作用
泽泻醇提取物具有明显的降血糖作用,并能保护胰岛组织免受损伤,降低血糖作用与促进胰岛素的释放有关[26]。陶雪涛等[27]观察了泽泻提取物对自发性糖尿病(GK)大鼠Bmal1(Arntl)、Acsl5、Gpx1基因表达的影响,结果表明泽泻降低血糖、血脂并用于糖尿病治疗的机制可能与其抑制Bmal1的高表达有关,而对 Acsl5、Gpx1的表达无显著影响。对GK大鼠Bmal1、Acsl5、Gpx1基因的调控方式与中医“治未病”以及“治本”的理念相一致。
2.5 免疫调节作用
小鼠灌胃给予泽泻煎剂能抑制小鼠碳粒廓清速率,对免疫器官重量和血清抗体IgG含量无影响,对绵羊红细胞所致小鼠迟发型超敏反应也无影响,能明显抑制由2,4-二硝基氯苯所致的小鼠接触性皮炎。20 g/kg能减轻二甲苯引起的小鼠耳廓肿,抑制大鼠棉球肉牙组织增生[28]。泽泻的甲醇提取物在Ⅰ型变态反应中能抑制大鼠48 h同源被动皮肤过敏反应;在Ⅱ型变态反应中,能抑制大鼠逆转性皮肤过敏反应;在Ⅳ型变态反应模型中,能抑制由2,4,6-三硝基氯苯诱导的小鼠接触性皮炎的诱导现象[29]。泽泻甲醇提取物在实验性动物模型中能抑制酵母多糖诱导的大鼠后爪浮肿和酵母多糖诱导的血管通透性增高的程度,显示出对经典途径和旁路途径激活的补体诱导的溶血作用均有抑制性作用,它还能抑制低张性休克诱导的溶血作用[30]。
2.6 抗肿瘤作用
以Lewis肺癌自发性转移为模型,泽泻10、20 g/(kg·d)连续给药20 d均可使肺中的转移灶数明显减少,其转移抑制率分别为56.92%和88.82%。荷瘤小鼠红细胞变形指数及比容明显降低,泽泻对其无明显改善。泽泻可使荷瘤小鼠的血清蛋白成分发生显著变化。结果表明泽泻可显著抑制Lewis肺癌的自发性转移,其机制可能与血清中某些蛋白成分的改变有关[31]。
2.7 减肥作用
戴岳等[32]通过对幼年大鼠皮下注射大剂量谷氨酸钠造成大鼠实验性肥胖,从而观察泽泻水煎剂对肥胖大鼠的影响。结果发现注射谷氨酸钠10周后,大鼠体重增加,Lee指数值明显高于对照组,体内大量脂肪蓄积,血清TG含量显著升高。泽泻水煎剂可降低肥胖大鼠的Lee指数、子宫及睾丸周围脂肪指数及血清TG含量,提示可能具有一定的减肥作用。
2.8 保肝作用
王振海等[33]采用大鼠体外肝细胞培养,以DL-乙硫氨酸处理大鼠原代肝细胞,制备大鼠肝脏损伤模型,将泽泻水煎剂作用于该模型。结果表明,泽泻能降低肝细胞内TG、直接低密度脂蛋白胆固醇(D-LDL-C)含量,显著改善肝脏脂质沉积,其作用机制可能和泽泻多途径调节脂质吸收、转运以及代谢有关。泽泻在显著改善大鼠非酒精性脂肪肝病变的同时,能一定程度上抑制肝脏肿大以及转氨酶升高。添加泽泻的各组细胞培养基上清液中谷丙转氨酶(ALT)、谷草转氨酶(AST)活力明显降低,显示其对肝脏具有一定保护作用。
3 结语
从泽泻中分离并鉴定的化学成分包括三萜类、倍半萜类、二萜类和其他类。现代药理研究表明泽泻具有抑制肾结石形成、降血压、抗动脉粥样硬化、降血糖、免疫调节、抗肿瘤等多种生物活性,这些研究成果为临床更好地应用泽泻发挥了重要作用。泽泻的研究尽管取得了一定进展,但目前仍存在一些问题尚待继续探讨。在化学成分研究方面,药理实验表明泽泻水提物具有多种生物活性,而对于水提物中化学成分的研究未见报道,因此需加强对水溶性部位化学成分的研究。在生物活性研究方面,目前的药理作用报道主要是泽泻粗提物,需加强对分离得到化学成分单体的活性测试,发现更多的活性成分,进而更好地阐述药理活性的物质基础。因此,对于泽泻的研究尚待进一步深入,以便更好地开发利用该药材资源。
[参考文献]
[1] 国家药典委员会.中国药典[S].一部.北京:中国医药科技出版社,2010:212.
[2] Murata T,Imai Y,Hirata T,et al. Biological active triterpenoids of Alismstis rhizome [J]. Chem Pharm Bull,1970,18:1347.
[3] Yoshijro N,Yohko S,Masumi K,et al. Terpenoids of Alisma orientale rhizome and the crude drug Alismatis rhizome [J]. Phytochemistry,1994,36(1):119.
[4] Fukuyama Y,Geng PW,Wang R,et al. 11-deoxyalisol C and alisol D:new protostane-type triterpenoids from Alisma plantago-aquatica [J]. Planta Med,1988,54(5):445.
[5] Geng PW,Fukuyama Y,Yamada T,et al. Triterpenoids from the rhizome of Alisma plantago-aquatica [J]. Phytochemistry,1988,27(4):1161.
[6] Masayuki Y,Norimichi T,Toshiyuki M,et al. Studies on Alismatis Rhizoma Ⅲ. Stereostructures of new protostane-type triterpenes,alisols H,I,J-23-acetate,K-23-acetate,L-23-acetate,M-23-acetate,and N-23-acetate,from the dried rhizome of Alisma orientale [J]. Chem Pharm Bull,1999,47(4):524.
[7] Yoshikawa M,Shoko H,Nobumistu T,et al. Crude drugs from aguatic plants I. On the constituents of Alismstis rhizome(1). Absolute stereostructures of alisols E 23-acetate,F and G,three new protostane-type triterpenes from Chinese Alismstis Rhizoma [J]. Chem Pharm Bull,1993,41(11):1948.
[8] 彭国平,朱国元.泽泻三萜成分的研究Ⅲ[J].天然产物研究与开发,2002,14(6):7.
[9] 彭国平,楼凤昌.泽泻三萜成分的研究[J].天然产物研究与开发,2001,13(4):1.
[10] 彭国平,朱国元.泽泻两个三萜新成分的研究Ⅱ[J].天然产物研究与开发,2002,14(4):5.
[11] Yoshikawa M,Murakami T,Ikebata A,et al. Absolute stereostructures of alismalactone 23-acetate and alismaketone A 23-acetate,new seco-protostane and protostane-type protostane-type triterpenes with vasorelaxant effects from Chinese alismatis rhizome [J]. Chem Pharm Bull,1997,45(4):756.
[12] Yoshitem O,Tsuneo I,Hiroshi H. Alismol and alismoxide,sesquiterpenoids of Alisma rhizomes [J]. Phytochemistry,1983,22(1):183.
[13] Masayuki Y,Shoko H,Nobumistu T,et al. Orientalols A,B and C,sesquiterpenoids constituents from Chinese Alismatis rhizoma,and revised structures of alismol and alismoxide [J]. Chem Pharm Bull,1992,40(9):2582.
[14] Peng GP,Tian G,Huang XF,et al. Guaiane-type sesquiterpenoids from Alisma orientalis [J]. Phytochemistry,2003,63(8):877.
[15] Peng GP,Lou FC,Huan CF,et al. Structure of orientanone from Alisma orientalis,a novel sesquiterpene originating from guaiane-type carbon skeleton by isopropyl shift [J]. Tetrahedron,2002,58(44):9045.
[16] 彭国平,楼凤昌.泽泻中二萜成分的结构测定[J].药学学报,2002,37(12):950.
[17] 洪承权,朴香兰,楼彩霞.泽泻化学成分的分离与鉴定[J].重庆工学院学报:自然科学版,2008,22(4):78.
[18] Xian P,Li T. Studies on the constituents from the Rhizoma of Alisma orientalis [J]. J Chin Pharmaceu Sci,1999,8(3):173.
[19] 尹春萍,刘继红,章咏裳,等.泽泻水提取液预防草酸钙结石形成的体外及动物实验研究[J].同济医科大学学报,1997,26(2):99.
[20] 曹正国,刘继红,周四维,等.泽泻提取物对大鼠尿结石形成和间α胰蛋白酶抑制物表达的影响[J].中华实验外科杂志,2004,21(3):295.
[21] 米其武,曹国正,刘继红,等.泽泻有效部位对肾草酸钙结石模型大鼠肾组织骨桥蛋白表达的影响[J].中草药,2005,36(12):1827.
[22] 冯志杰,翟俊霞,孙玉凤,等.泽泻对肝硬变大鼠主动脉的扩血管作用及机制[J].中国中西医结合消化杂志,2003,11(2):90.
[23] 张洪,马红斌,蔡鸿生.降脂中药浅谈[J].时珍国药研究,1995,6(1):34.
[24] 钱家骏.泽泻抗动脉粥样硬化作用系列研究(一)——泽泻研究的进展[J].北京中医学院学报,1991,14(2):42.
[25] 张春海,毛缜,马丽,等.泽泻水提取物、醇提取物对小鼠脂代谢影响的比较[J].徐州师范大学学报:自然科学版,2005,23(2):68.
[26] 杨新波,黄正明,曹文斌,等.泽泻醇提取物对高血糖小鼠血液生化指标及胰岛素的影响[J].中国临床康复,2004, 8(6):1196.
[27] 陶雪涛,姚立,施宁川.泽泻提取物对自发性糖尿病大鼠Bmal1(Arntl)、Acsl5、Gpx1基因表达的影响[J].中华中医药学刊,2013,31(4):833.
[28] 戴岳,黄朝林,李佩珍,等.泽泻对免疫系统的影响及抗炎作用[J].中国中药杂志,1991,16(10):622.
[29] Kubo M,Matsuda H,Tomohiro N,et al. Studies on Alismatis rhizoma Ⅰ. Anti-allergic effects of methanol extract and six terpene components from Alismatis Rhizoma(dried rhizome of Alisma orientale)[J]. Biol Pharm Bull,1997, 20(5):511.
[30] Matsuda H,Tomohiro N,Yoshikawa M,et al. Studies on Alismatis Rhizoma.Ⅱ. Anti-complem entary activities of methanol extract and terpene components from Alismatis Rhizoma(dried rhizome of Alisma orientale)[J]. Biol Pharm Bull,1998,21(12):1317.
[31] 马兵,项阳,李涛,等.泽泻对Lewis肺癌自发性转移的抑制作用及其机制研究[J].中草药,2003,34(8):743.
[32] 戴岳,杭秉茜.泽泻对谷氨酸钠肥胖大鼠的影响[J].中成药,1992,14(2):28.
[33] 王振海,安锡忠,任增超.泽泻对大鼠急性肝脏损伤的保护作用[J].中国动物检疫,2010,27(9):56.
(收稿日期:2015-05-25 本文编辑:张瑜杰)
