TACE术中灌注氟尿嘧啶、奥沙利铂及吡柔比星治疗原发性肝癌的临床效果分析
2015-10-28乔彬彬虞希祥王舒婷郑冰汝朱国庆施振静
乔彬彬,虞希祥,王舒婷,郑冰汝,朱国庆,施振静
TACE术中灌注氟尿嘧啶、奥沙利铂及吡柔比星治疗原发性肝癌的临床效果分析
乔彬彬,虞希祥,王舒婷,郑冰汝,朱国庆,施振静
目的观察评价肝动脉化疗栓塞(TACE)联合灌注奥沙利铂(OXA)、氟尿嘧啶(5-Fu)及吡柔比星(THP)方案治疗原发性肝癌的疗效和安全性。方法回顾分析采用TACE术中动脉灌注OXA/5-Fu/THP化疗药物治疗的原发性肝癌患者65例,及同期行单纯肝动脉栓塞(TAE)治疗的原发性肝癌患者21例,分为TACE组和TAE组。对TACE灌注OXA/5-Fu/THP的疗效、不良反应发生率、无进展生存时间(PFS)及总生存期(OS)进行综合评价,并与单纯肝动脉栓塞进行对比分析研究。结果TACE联合OXA/5 -Fu/THP治疗的65例患者中,客观缓解率(ORR)55.4%,疾病控制率(DCR)81.5%;患者的中位PFS时间为11.5个月,中位OS时间为18.5个月;单因素分析中,Child-Pugh A级、无门脉癌栓、无肿瘤转移、肿瘤直径小及TACE治疗次数多的患者预后较好,差异有统计学意义(P<0.05);巴塞罗那分期(BCLC)B期的患者预后优于C期的患者,差异有统计学意义(P=0.000);Cox多因素分析中门脉癌栓及肿瘤远处转移是患者预后的独立危险因素。与单纯TAE相比,TACE联合OXA/5-Fu/THP可提高患者的mPFS。结论TACE术中动脉灌注OXA/5-Fu/THP治疗原发性肝癌的疗效较好,不良反应少。
原发性肝癌;肝动脉化疗栓塞术;肝动脉栓塞术;吡柔比星;奥沙利铂;氟尿嘧啶
原发性肝癌(PLC)是我国常见的恶性肿瘤,预后较差,大多数患者发现时就已经失去了手术机会,因此肝动脉化疗栓塞(TACE)成为其重要的治疗手段。尽管TACE对PLC的疗效确切,但不同地区、不同医院在进行TACE治疗时联用的化疗药物及药物剂量不尽相同。甚至有学者指出,TACE对肝癌的疗效并不优于单纯的肝动脉栓塞(TAE)[1]。本文就TACE联合灌注奥沙利铂(OXA)、氟尿嘧啶(5-Fu)及吡柔比星(THP)方案进行综合评价,并与单纯TAE进行对比分析,对TACE联合OXA/5-Fu/THP的临床疗效及不良反应发生率进行分析探讨。
1 材料与方法
1.1临床资料
回顾分析2011年7月1日—2014年1月1日期间在我院介入科分别行TACE联合OXA/5-Fu/ THP治疗及单纯TAE治疗的原发性肝癌患者,分为TACE组和TAE组。患者纳入标准:①病理学或临床诊断为PLC,②随访资料完整,③首次治疗方式为TACE或TAE。排除标准:①治疗期间联合应用靶向药物、手术切除或射频消融等其他治疗方式,②在多次TACE治疗过程中更改过灌注化疗方案。最终共有65例患者纳入TACE组,21例患者纳入TAE组。所有患者均随访至死亡或截止至2014年7月31日。
1.2方法
1.2.1治疗方法所有患者都在DSA(AXIOM Artis Zee Ceiling,Siemens,Munich,Germany)透视下进行TACE操作的。将导管选择性插入肝总动脉及肠系膜上动脉造影,确定肿瘤的位置、大小、个数及肿瘤供血动脉;根据供血动脉情况,选择微导管,超选择到肿瘤供血动脉支。TACE组经微导管缓慢灌注化疗药物氟尿嘧啶(750 mg/m2)及奥沙利铂(60 mg/ m2),化疗药物的灌注时间一般不低于15 min;再将适量碘油(用量视肿瘤大小及供血情况而定)与吡柔比星(20 mg/m2)混合成均匀乳剂,在透视下缓慢推注尽量栓塞肿瘤所有供血动脉。TAE组则单纯用碘油或微球栓塞肿瘤供血动脉。所有患者初次介入治疗后,间隔1个月行第2次和第3次介入治疗,而后定期复查增强CT(或MRI)及肿瘤标志物,若发现病灶残存或肿瘤复发,继续进行介入治疗。
1.2.2随访、观察指标及评价标准出院后采用再次来院复查或电话询问的方式随访,随访时间截止于2014年7月31日。以研究时间段内第1次介入治疗开始至影像学检查发现肿瘤进展或患者死亡的时间作为无进展生存期(PFS),以研究时间段内第1次介入治疗开始至患者死亡或末次随访时间作为总生存期(OS)。所有患者术后1~3个月内均有增强CT或MRI影像学检查资料,在TACE治疗前和治疗后2周内均检测血常规、肝肾功能、AFP等血液学指标。疗效评价依据mRECIST标准[2]分为完全缓解(CR)、部分缓解(PR)、疾病稳定(SD)和疾病进展(PD)。以CR+PR计算客观缓解率(ORR),以CR+PR+SD计算疾病控制率(DCR)。
1.3统计学方法
应用SPSS 17.0版软件进行数据处理。TACE组与TAE组的临床特征、ORR、DCR及不良反应率的比较采用卡方检验或Fisher精确概率法,单因素分析采用Kaplan-Meier(Log-rank)检验,多因素分析采用Cox比例风险回归模型。P<0.05为差异有统计学意义。
2 结果
2.1TACE组与TAE组的部分临床特征
TACE组65例治疗211次;TAE组21例治疗60次。TACE组及TAE组在性别、有无肝炎病史、Child-Pugh分级、AFP、门脉癌栓或转移、肿瘤数量、肿瘤大小等方面的差异无统计学意义(表1)。
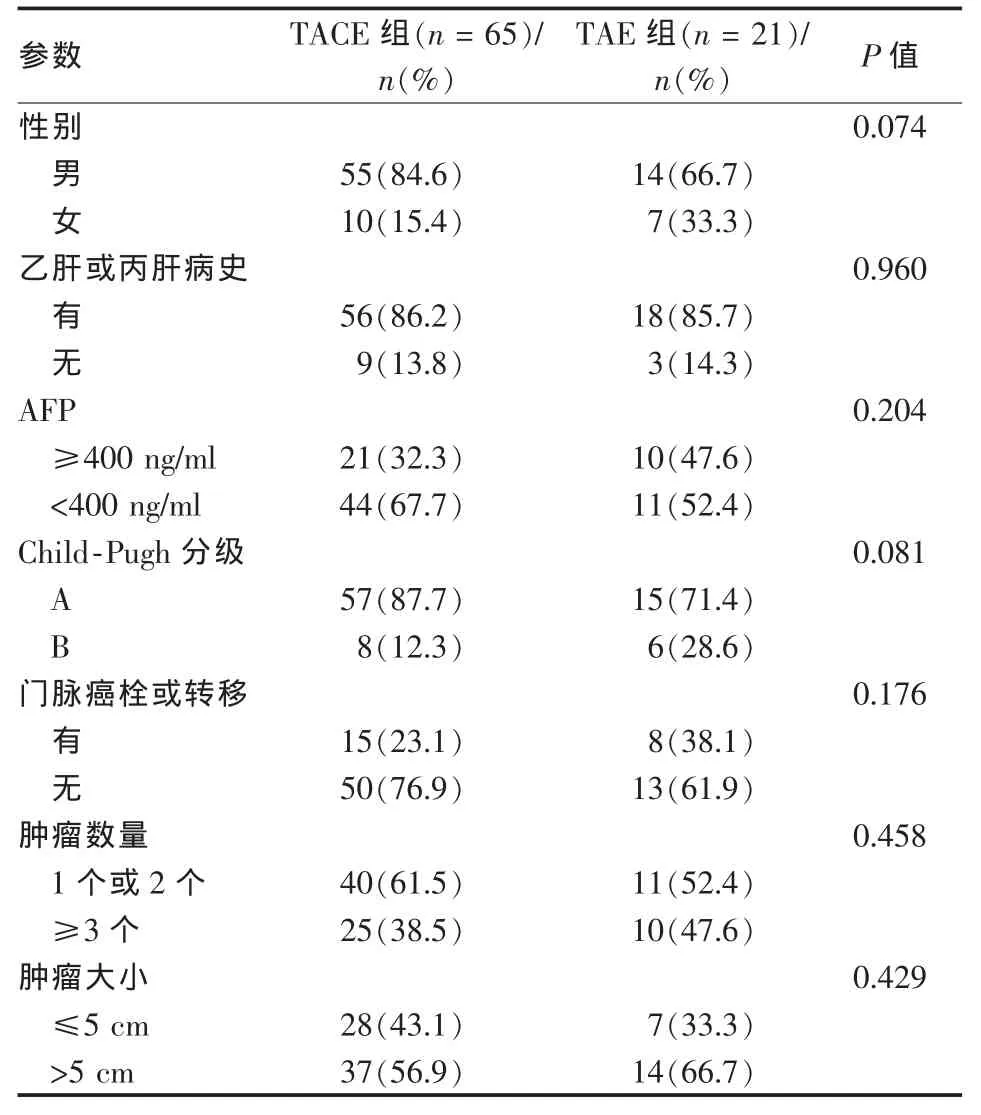
表1 TACE组与TAE组的部分临床特征
2.2疗效评价
对每例患者的首次介入治疗进行mRECIST疗效评价。TACE组评价结果为:CR 9例,PR 27例,SD 17例,PD 12例,ORR 55.4%,DCR 81.5%;TAE组的评价结果为:CR 2例,PR 7例,SD 7例,PD 5例,ORR 42.9%,DCR 76.2%。客观缓解率及疾病控制率在两组间的差异均无统计学意义(P=0.318,P= 0.595)。
2.3生存分析
TACE组及TAE组的中位PFS分别为11个月、7.5个月(图1),两者的差异有统计学意义(P=0.046);TACE组及TAE组的中位OS分别为18.5个月、17个月,两者的差异无统计学意义(P= 0.197)。
TACE组中,将性别、有无肝硬化、有无肝炎病史、Child-Pugh分级、AFP、门脉癌栓、肿瘤转移、肿瘤个数、肿瘤大小及TACE治疗次数纳入单因素分析显示(表2),Child-Pugh A级、无门脉癌栓、无肿瘤转移、肿瘤直径小及TACE治疗次数多的患者,预后较好,差异有统计学意义(P<0.05)。对巴塞罗那分期(BCLC)B期和C期的患者进行单因素分析显示,BCLC分期B期患者的预后好于C期,差异有显著统计学意义(P=0.000)。

图1 TACE组与TAE组的PFS比较
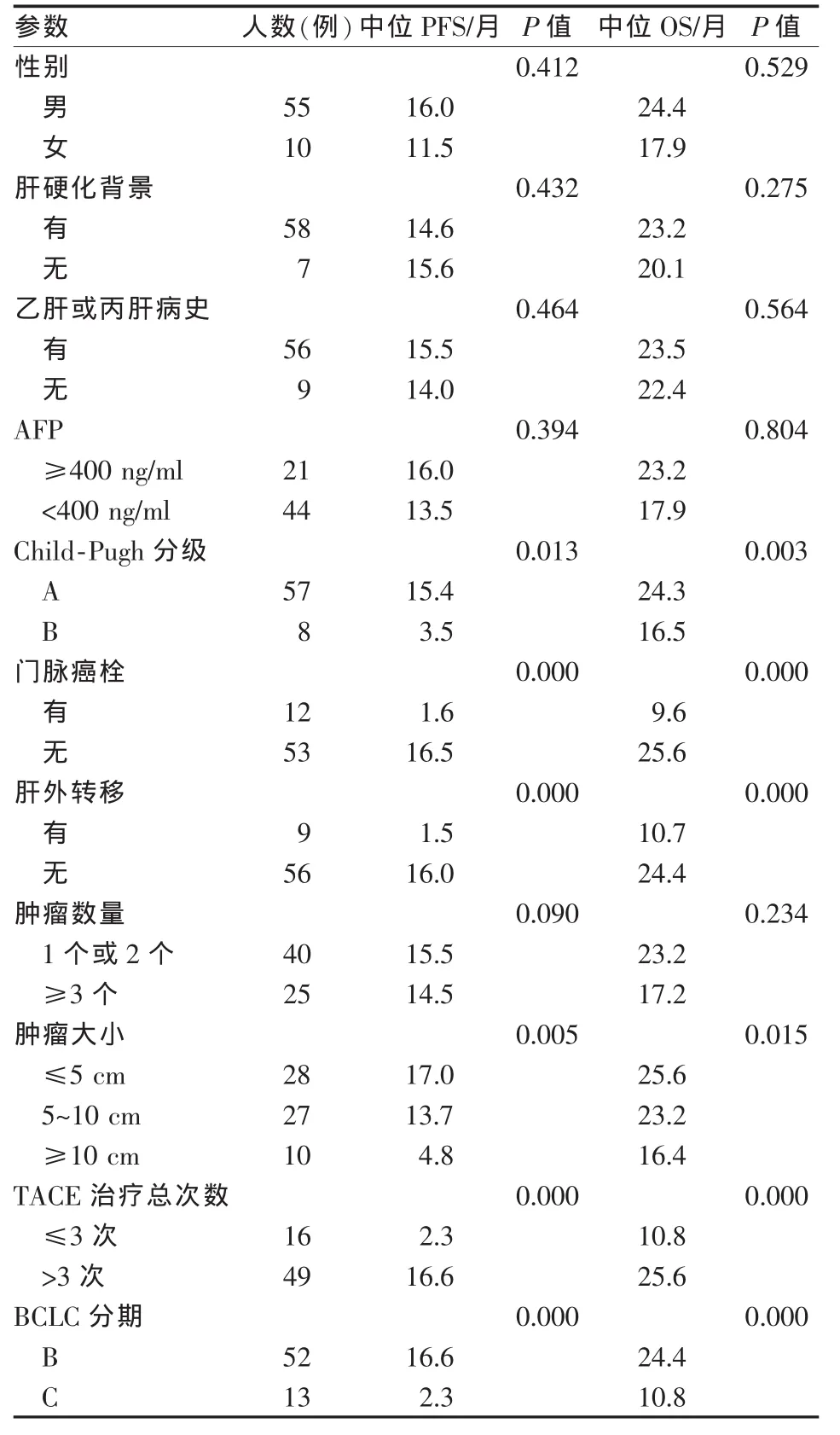
表2 TACE联合OXA/5-Fu/THP治疗的单因素分析
TACE组中,将Child-Pugh分级、门脉癌栓、肿瘤转移、肿瘤大小及TACE次数纳入Cox多因素分析(表3),其中门脉癌栓及肿瘤远处转移是影响患者预后的独立危险因素(P<0.05)。
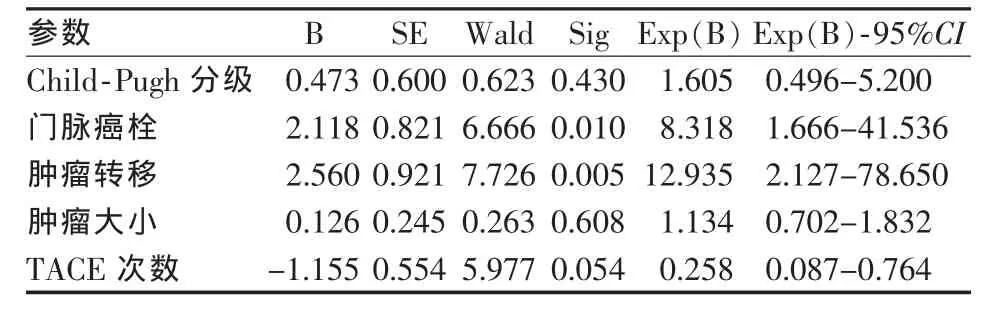
表3 TACE联合OXA/5-Fu/THP治疗Cox多因素分析
2.4不良反应
TACE联合OXA/5-Fu/THP术后的最常见的不良反应为疼痛(63.5%)和发热(43.1%),其次是乏力(33.7%)、恶心(23.2%)、呕吐(18.0%),未出现感觉神经病变及药物过敏;术后对肝功能的影响包括丙氨酸转氨酶的升高(28%)、天冬氨酸转氨酶的升高(16.6%)、总胆红素的升高(13.3%)及白蛋白的下降(42.4%);对造血系统的不良反应包括白细胞减少(6.6%)、中性粒细胞减少(5.7%)、血小板减少(38.9%)及贫血(29.4%)。与TAE组相比,恶心、呕吐的发生率较高,差异有统计学意义(表4)。
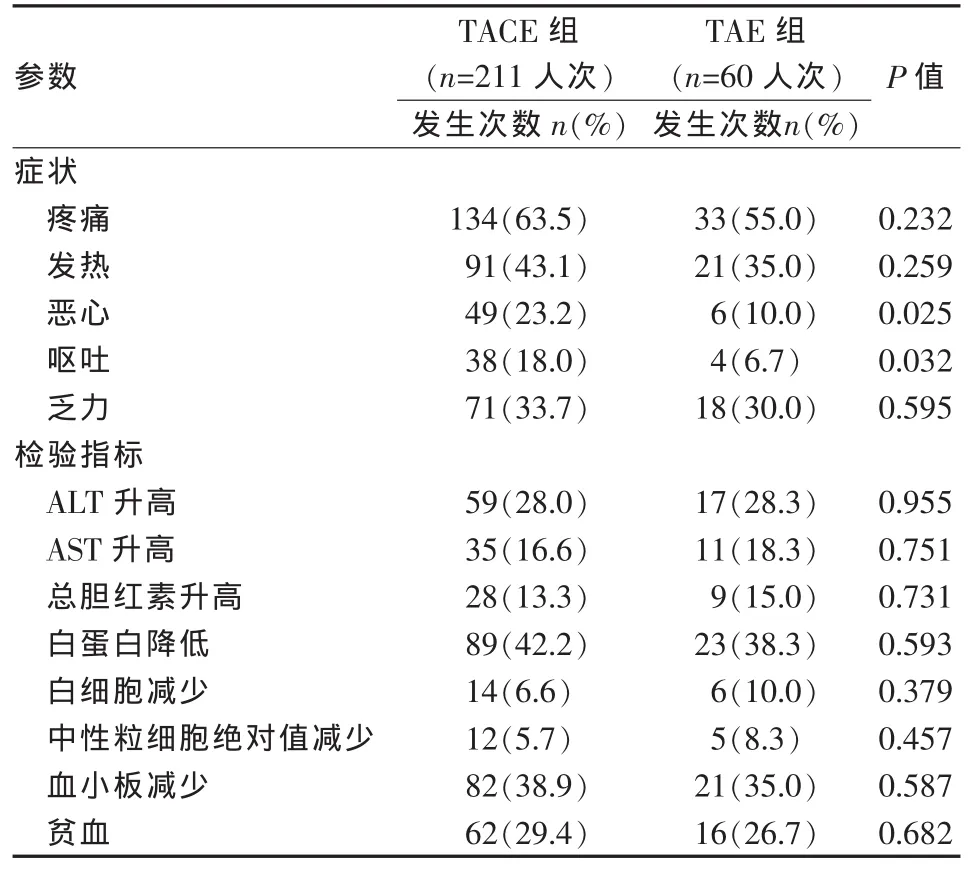
表4 不良反应的发生率
3 讨论
尽管TACE在肝癌中的治疗作用明确[3],但TACE中化疗药物的选用尚未形成共识,且缺乏循证医学及多中心前瞻性试验研究证据。欧美国家常在碘油或微球中单用蒽环类抗肿瘤药物(阿霉素或表阿霉素)做化疗栓塞[4],而在国内,除将蒽环类药物(阿霉素或吡柔比星)混入碘油或微球中做栓塞外,还会应用以奥沙利铂为主的化疗药物做动脉灌注化疗[5-6]。
吡柔比星与阿霉素同属蒽环类抗肿瘤药,两者相比,吡柔比星具有不良反应少、患者更易耐受的优点[7]。临床上,常将吡柔比星与碘油混合成乳剂做化疗栓塞,其疗效明确且患者易耐受[8]。奥沙利铂是第三代铂类抗肿瘤药物,与第一、二代铂类抗肿瘤药物相比,奥沙利铂几乎不存在交叉耐药[9]。尽管肝癌对常规化疗药物不敏感,但将奥沙利铂应用于肝癌的治疗仍取得了较好的效果[5-6,10]。
本研究通过回顾性分析TACE灌注吡柔比星、5-Fu和奥沙利铂治疗原发性肝癌,发现该治疗方案有着较好的临床疗效,患者的mPFS达到11.5个月,mOS达到18.5个月。与单纯栓塞治疗相比,可提高患者的无进展生存期。
从不良反应的发生率来看,患者对TACE治疗方式耐受良好,不良反应较轻。尽管恶心、呕吐的发生率高于单纯栓塞组,但予对症处理后,患者症状多可改善;此外,在TACE组的211次手术中,均未出现与奥沙利铂相关的感觉神经病变及药物过敏反应[11]。无论化疗栓塞还是单纯栓塞,都对肝功能有一定的影响[12],术后可适当给予护肝药物以提高患者对介入手术的耐受、改善患者的预后。
本研究对BCLC B期及C期的患者进行单因素分析发现,BCLC B期患者的预后明显好于C期的患者。尽管BCLC C期患者的中位生存时间较短,但有研究发现[13],BCLC C期的患者仍能从TACE治疗中获益。本研究缺乏前瞻性随机对照且病例数较少,有待进一步的多中心、前瞻性的临床实验研究,此外,还需对化疗药物的用量做进一步的临床研究。
[1]Tsochatzis EA,Fatourou E,O'beirne JA,et al.Transarterial chemoembolization and bland embolization for hepatocellular carcinoma[J].World J Gastroenterol,2014,20:3069-3077.
[2]Lencioni R,Llovet JR.Modified RECIST(mRECIST)assessment for hepatocellular carcinoma[J].Semin Liver Dis,2010,30:52-60.
[3]Llovet JM,Real MI,Montaña X,et al.Arterial embolisation or chemoembolisation versus symptomatic treatment in patients with unresectable hepatocellular carcinoma:a randomised controlled trial[J].Lancet,2002,359:1734-1739.
[4]Vogl TJ,Zangos S,Balzer JO,et al.Transarterial chemoembolization(TACE)in hepatocellular carcinoma:technique,indication and results[J].RoFo,2007,179:1113-1126.
[5]高嵩,朱旭,杨仁杰,等.TACE联合奥沙利铂、氟尿嘧啶、亚叶酸钙肝动脉化疗治疗中晚期原发性肝癌[J].介入放射学杂志,2012,21:377-383.
[6]李坚,王洪林,陈翔,等.含奥沙利铂方案介入治疗中晚期肝癌的疗效观察[J].重庆医学,2005,34:1371-1372.
[7]康昭洵,曾红学,郭守俊.吡柔比星和阿霉素在联合化疗中的临床观察[J].肿瘤研究与临床,2002,14:45-46.
[8]赵许亚,周石.TACE联合经皮瘤内注射碘油吡柔比星乳剂治疗中晚期肝癌疗效分析[J].介入放射学杂志,2012,21:675-678.
[9]Raymond E,Faivre S,Chaney S,et al.Cellular and molecular pharmacology of oxaliplatin1[J].Mol Cancer Ther,2002,1:227-235.
[10]Qin S,Bai Y,Ye S,et al.PhaseⅢstudy of oxaliplatin plus 5-fluorouracil/leucovorin(FOLFOX4)versus doxorubicin as palliative systemic chemotherapy in advanced HCC in Asian patients[J].J Clin Oncol,2010,28:(suppl;abstr 4008).
[11]Cassidy J,Misset JL.Oxaliplatin-related side effects:characteristics and management[J].Semin oncol,2002,29(5 Suppl 15):11-20.
[12]Liapi E,Georgiades CC,Hong K,et al.Transcatheter arterial chemoembolization:current technique and future promise[J]. Tech Vasc Interv Radiol,2007,10:2-11.
[13]Torzilli G,Donadon M,Marconi M,et al.Hepatectomy for stage B and stage C hepatocellular carcinoma in the Barcelona Clinic Liver Cancer classification:results of a prospective analysis[J]. Arch Surg,2008,143:1082-1090.
TACE with infusion of fluorouracil,oxaliplatin and pirarubicin for the treatment of primary livercancer:analysis of clinical effect
QIAO Bin-bin,YU Xi-xiang,WANG Shu-ting,ZHENG Bing-ru,ZHU Guo-qing,SHI Zhen-jing.Department of Intervention Radiology,Third Affiliated Hospital,Wenzhou Medical University,Wenzhou,Zhejiang Province 325200,China
YU Xi-xiang,E-mail:yudsa@126.com
ObjectiveTo evaluate the clinical efficacy and safety of transcatheter arterial chemoembolization(TACE)with oxaliplatin(OXA),fluorouracil(5-Fu)and pirarubicin(THP)scheme in treating primary liver cancer.MethodsA total of 65 patients with primary liver cancer were treated with TACE using infusion of OXA/5-Fu/THP scheme(TACE group).Other 21 patients with primary liver cancer,who were encountered at the Department of Interventional Radiology of authors'hospital during the same period as the patients of TACE group,received simple transarterial embolization(TAE group).The therapeutic effect,the occurrence of adverse reactions,the progression-free survival time(PFS)and overall survival time(OS)of the two groups were comprehensively evaluated.The results were compared between the two groups. ResultsIn the TACE group,the objective response rate(ORR)and disease control rate(DCR)were 55.4% and 81.5%respectively,and the median PFS and median OS were 11.5 months and 18.5 months respectively. Single factor analysis indicated that patients,who had liver function of Child-Pugh A and received more times or treatment,and who had small-sized tumor and no portal vein tumor thrombus or metastasis,usually had a better prognosis,and the differences were statistically significant(P<0.05).The prognosis of the patients with Barcelona staging(BCLC)B was better than that of the patients with Barcelona staging C,and the difference was statistically significant(P=0.000).Cox multivariate analysis revealed that the portal vein tumor thrombus and tumor metastasis were independent risk factors for the prognosis of the patients.Compared with the TAE group,TACE with OXA/5-Fu/THP scheme could effectively improve the mean progression-free survival time. ConclusionFor the treatment of primary liver cancer,TACE with infusion of OXA/5-Fu/THP is clinically effective with fewer adverse reactions.(J Intervent Radiol,2015,24:349-353)
primary liver cancer;transarterial chemoembolization;transarterial embolization;pirarubicin;oxaliplatin;fluorouracil
R735.7
B
1008-794X(2015)-04-0349-05
2014-09-02)
(本文编辑:俞瑞纲)
10.3969/j.issn.1008-794X.2015.04.018
325200浙江省温州市温州医科大学附属第三医院介入科
虞希祥E-mail:yudsa@126.com
