叶酸偶联金纳米棒在兔VX-2肝癌的摄取状况研究
2015-10-28许军贺克武高斌杨会军沈蕾肖卫华
许军,贺克武,高斌,杨会军,沈蕾,肖卫华
·实验研究Experimental research·
叶酸偶联金纳米棒在兔VX-2肝癌的摄取状况研究
许军,贺克武,高斌,杨会军,沈蕾,肖卫华
目的建立兔肝癌模型,观察实验动物对叶酸(FA)偶联二氧化硅包覆的金纳米棒(GNRs@SiO2-FA)的摄取状况,检测GNRs@SiO2-FA对肝癌细胞的靶向性。方法CT引导下穿刺接种法建立兔VX-2肝癌模型27只,行CT、超声检查观察肿瘤生长情况。2周后将实验动物随机分成空白对照组(注入生理盐水)、门静脉注射GNRs@SiO2-FA组和瘤内注射GNRs@SiO2-FA组,术后24、48、72 h每组各处死实验兔3只,取其肿瘤组织和各主要脏器并作冷冻切片,应用激光共聚焦显微镜观察实验动物对GNRs@SiO2-FA的摄取情况。结果成功构建兔VX-2肝癌模型,CT、超声检查显示肿瘤血供较丰富。共聚焦显微镜观察到实验动物摄入GNRs@SiO2-FA 24 h内即可特异性地与肿瘤细胞结合进入肿瘤细胞,并聚集在肿瘤细胞胞质内。结论GNRs@SiO2-FA可在实验动物体内高度靶向性作用于肝癌细胞,在肿瘤靶向定位热疗和125I粒子介入治疗方面具有重要的应用前景。
VX-2肝癌模型;叶酸偶联金纳米棒;叶酸受体;靶向性
肝癌是最常见的致命恶性肿瘤之一,其诊断和治疗一直是临床难题[1]。除少数癌肿可以通过外科手术切除外,目前常用的肝癌治疗手段多集中于化疗和选择性内放疗。然而由于肝癌组织内的独特微环境,抗癌药物在肿瘤组织内分布浓度很低,对肝癌患者5年生存率的提升不到1%[2]。金纳米棒(GNRs)具有独特的光学性质和优势、较低的细胞毒性、良好的生物相容性,在光热治疗、细胞成像和基因传递等生物医学领域展现出广泛的应用前景[3-4]。研究表明叶酸(FA)受体在恶性肿瘤细胞膜表面的表达显著高于正常细胞[5],因此将FA作为靶向配体与FA受体特异性表达的癌细胞结合,为FA靶向肿瘤治疗研究奠定了基础。
本实验在建立兔VX-2肝癌模型的基础上,通过不同途径将前期研究中制备的FA偶联二氧化硅包覆的金纳米棒(GNRs@SiO2-FA)注射进入实验动物体内,采用双光子激光共聚焦显微镜观察动物模型对GNRs@SiO2-FA的摄取情况。现将实验结果总结如下。
1 材料与方法
1.1主要材料和仪器
荷瘤种兔1只(由苏州大学附属第一医院惠赠)、新西兰大耳白兔27只(均为雄性,体重2.5~3.0 kg,由安徽医科大学实验动物中心提供)、GNRs@SiO2-FA(本实验室自制)、FA-2104型电子天平(上海良平仪器仪表有限公司)、Leica双光子激光共聚焦显微镜(德国Carl Zeiss公司)、光学显微镜(日本Olympus公司)、16层螺旋CT(美国通用电气公司)以及手术相关器械。
1.2CT引导下穿刺接种法建立兔VX-2肝癌模型
无菌条件下用戊巴比妥钠(30 mg/kg)静脉全身麻醉荷瘤兔后手术剥离其后腿肌肉内肿块,将取出的生长活跃的肿瘤组织剪碎为1~2 mm3的小块。全身麻醉待接种肿瘤的新西兰白兔后,常规肋下CT扫查其肝脏,明确肝位置并确定待接种部位,用带尖头穿刺针芯的穿刺针沿设定的穿刺角度、方向穿入预定肝位置,眼科镊夹1块瘤块放入针鞘内,平头穿刺针芯将瘤块推入肝内,重复1~2次。直视下来回在针鞘内推动平头穿刺针芯,证实瘤块接种于肝脏。术后连续3 d肌肉注射青霉素40万单位+庆大霉素4万单位。
1.3CT、超声检查
新西兰白兔禁食24 h,戊巴比妥钠(30 mg/kg)静脉全身麻醉后,将其仰卧位固定于CT床上,左右尽量对称。CT扫描参数:120 kV,50 mA,FOV 25 cm,层厚2 mm。增强扫描对比剂选用碘普罗胺注射液(碘浓度300 mg/ml,剂量1 ml/kg),用高压注射器经耳缘注射(流率1 ml/s)。彩色超声诊断仪设置为TESTIS(浅表高频)条件,采用15 L、8 W浅表器官探头,变频率8~13 MHz。
1.4实验动物分组及不同处理
随机将实验白兔分成A、B、C 3组,每组9只。A组为空白对照组:植入肿瘤后2周,从耳缘静脉注射生理盐水5 ml;B组为门静脉注射GNRs@SiO2-FA组:超声引导下辨别并确定兔门静脉主干位置,向门静脉内注射GNRs@SiO2-FA 200 μl;C组为瘤内注射GNRs@SiO2-FA组:超声引导下向肿瘤组织内注射GNRs@SiO2-FA 200 μl。术后24 h、48 h、72 h采用空气栓塞法处死实验兔,每组各处死3只,取其肿瘤组织和各主要脏器(心脏、肝脏、脾脏、肾脏、肺脏)作后续检测。
1.5激光共聚焦显微镜观察实验动物对GNRs@SiO2-FA摄取情况
取实验兔24 h、48 h、72 h的肿瘤组织,瘤周1.5 cm组织,正常肝脏、肾脏、脾脏和肺脏组织切块(<1 cm3),4℃下固定过夜后,用0.01 mol/L PBS缓冲液洗3次。在20%蔗糖中4℃浸泡1 h以上,待组织块下沉后进行冷冻切片。组织块固定后放入样品台的冷冻包埋剂(OCT)中,调整样品位置,打开钢瓶开关使压缩CO2气体喷出,迅速冷冻组织样品。冷冻后的样品转移至冷冻切片机(样品温度平衡至-20℃)中,将组织切成约10 μm切片,粘贴于用多聚赖氨酸处理过的盖玻片(20 mm×40 mm,0.13~0.17 μm厚)上,用双光子激光共聚焦显微镜观察标本内细胞对GNRs@SiO2-FA的摄取情况。
2 结果
2.1影像学及病理学检查建模结果
CT表现:兔VX-2肝癌模型构建1周左右瘤灶较小,2周时直径约1.5 cm,平扫呈低密度,少数呈等密度,坏死为明显低密度。增强双期扫描显示,动脉期肿瘤强化明显,呈高密度;门脉期肿瘤呈稍低密度,肿瘤边缘及正常的肝实质增强使肿瘤显示更清楚(图1)。超声表现:超声声像图上肿瘤表现为低回声,边界清楚,有明显声晕,内部回声欠均匀;血流信号检测可见瘤体内点状、短条状血管分支,肿块周边见环形包绕的丰富血管。肿瘤病理组织学改变:肉眼见肿瘤呈灰白色,质硬,切面呈鱼肉状;光镜下肿瘤细胞呈条索状或腺样排列,细胞体积较大,呈圆形、梭形或不规则形,核大、深染,异型明显并可见核分裂象(图2)。
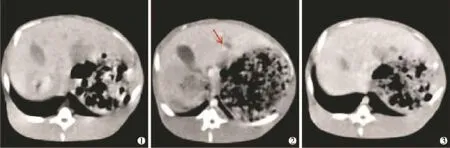
图1 CT平扫和CT增强扫描图像

图2 HE染色后光镜下图像
2.2共聚焦显微镜观察肝癌模型对GNRs@SiO2-FA摄取情况
双光子激光共聚焦显微镜观察发现,肿瘤组织及其他脏器自体荧光发射范围为400~600 nm,GNRs@SiO2-FA荧光范围较广(400~700 nm)。当检测荧光范围超过600 nm时,肿瘤组织和脏器的自体荧光迅速降低而GNRs@SiO2-FA仍具有较强荧光,因此利用这一规律可以将GNRs从肿瘤组织和脏器中区分出来(图3①、②、③)。细胞核在400~700 nm范围内几乎没有自体荧光发出。注射GNRs@SiO2-FA 24 h后,肿瘤细胞胞质内可见大量GNRs积聚,而细胞核内未见GNRs荧光(图3④);脾脏内也可见较多GNRs积聚(图3⑤);GNRs在瘤周1.5 cm肝组织和正常肝组织内可见少量积聚,瘤内注射组较门静脉注射组肝组织内积聚偏少,主要积聚在肝板之间的肝血窦内,而肝细胞内未见积聚;GNRs在肾脏组织内未见积聚。注射GNRs@SiO2-FA 48 h后,肿瘤细胞胞质内GNRs积聚增多,并发现少量GNRs向细胞核内化;脾脏内GNRs积聚较24 h时未见明显变化;瘤周1.5 cm肝组织和正常肝组织内GNRs积聚较24 h时明显减少;肾脏集合管内可见少量GNRs积聚,瘤内注射组较门静脉注射组无明显差异,而肾实质细胞内未见积聚。注射GNRs@SiO2-FA 72 h后,肿瘤细胞胞质内GNRs积聚进一步增多,GNRs向细胞核内化较48 h时变化不明显;脾脏内GNRs积聚较48 h明显减少;瘤周1.5 cm肝组织和正常肝组织内GNRs积聚较48 h时进一步减少,瘤内注射组肝组织内只见极少量GNRs荧光;肾脏集合管内可见较多GNRs积聚,瘤内注射组GNRs积聚少于门静脉注射组(图4)。实验动物肺脏及心脏组织内未见GNRs荧光,对照组肿瘤组织及各器官内均未见GNRs荧光(图5)。
3 讨论
GNRs是一种呈胶囊状的颗粒,在可见光区和近红外区有一个横向等离子共振吸收峰(TSPR)和一个纵向等离子共振吸收峰(LSPR)[6]。GNRs可以强烈吸收近红外激光并转化为热能释放到局部环境,这种光热效应在实体肿瘤治疗中展现出巨大的应用价值[7]。然而传统GNRs合成过程中要使用大量具有较强生物毒性的表面活性剂十六烷基三甲基溴化铵(CTAB),使之在生物医学领域的应用受到了限制[8]。我们在前期研究中以二氧化硅(SiO2)作为壳材制备椭球形SiO2包覆的GNRs(GNRs@SiO2),同时将FA通过氨基偶联到GNRs@SiO2,以降低GNRs的生物毒性,并在体外实验中得到证实[9-10]。本研究中给予正常动物摄入很高剂量(13 mg/kg)的GNRs@SiO2-FA后,并未发现明显的中毒迹象,动物肝肾功能也未见明显变化(观察结果尚未发表)。有研究发现,将GNRs摄入剂量提高到2 700 mg/kg时,实验动物也没有出现明显的毒性反应[11]。
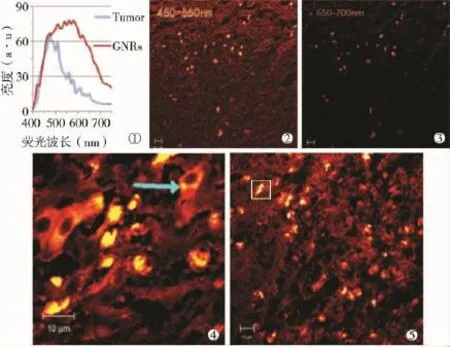
图3 GNRs@SiO2-FA在不同组织的共聚焦图像
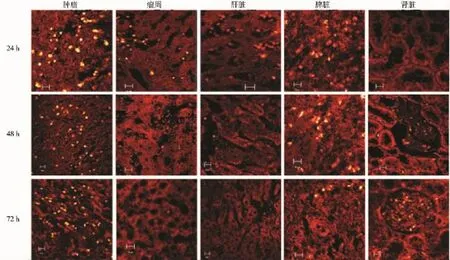
图4 摄入GNRs@SiO2-FA后不同时间段(24 h、48 h、72 h),瘤内注射组动物体内肿瘤组织及各主要器官对GNRs@SiO2-FA的摄取状况(标尺=10 μm)

图5 实验动物肺脏①、心脏组织②及对照组肿瘤组织③内均未见GNRs荧光
FA受体是细胞膜表面糖基化的糖蛋白,在多种上皮组织来源的肿瘤组织中高表达,可与5-甲基四氢FA及游离FA特异结合,并且通过受体介导的胞吞机制将FA及其衍生物高效、特异地载入肿瘤细胞[12]。肝癌属于腺上皮来源,肝癌细胞表面具有丰富的FA受体[13]。本研究通过双光子激光共聚焦显微镜观察肝癌模型对GNRs@SiO2-FA的摄取情况,进一步从细胞水平证明GNRs@SiO2-FA对肿瘤细胞的高度靶向性。有研究[14]证明,GNRs在近红外光激光激发下发出的双光子荧光信号亮度,是相同条件下罗丹明染色荧光亮度的58倍。Tong等[15]将FA偶联的GNRs与FA受体过量表达的KB细胞和NIH-3T3细胞分别进行孵育,通过双光子荧光信号可以很清晰地观察到细胞吞噬纳米颗粒过程中处于吞噬不同阶段的GNRs所在位置。本研究结果显示,GNRs@SiO2-FA可以特异性地与肿瘤细胞结合后进入肿瘤细胞,并聚集在细胞质内。此外,在肝血窦和脾脏的巨噬细胞内也观察到部分GNRs,表明GNRs在体内的循环、代谢与网状内皮系统有关,这与国外的相关研究报道[16]一致。本研究还发现,注射GNRs 24 h后,GNRs开始由肾脏排出体外,瘤内注射组GNRs清除较门静脉组缓慢,GNRs在体内循环时间更长,肿瘤细胞内GNRs聚集更多。
总之,本研究制备的FA偶联的GNRs@SiO-FA可以在实验动物体内特异性识别肝癌。GNRs@SiO2-FA可作为荧光试剂或药物载体,广泛应用于肿瘤的诊断或治疗,尤其是能与FA高表达的癌细胞靶向结合,使其在肿瘤的靶向定位热疗和125I粒子介入治疗方面展现出巨大的应用价值。
[1]Zhang QA,Tong JL,Chen HJ,et al.A novel magnetic nanoparticle hyperthermia combined with ACMF-Dependant drug release by DAMMs injection in VX-2 liver tumors[J].J Nanosci Nanotechnol,2012,12:127-131.
[2]Liang P,Dong B,Yu X,et al.Computer-aided dynamic simulation of microwave-induced thermal distribution in coagulation of liver cancer[J].IEEE Trans Biomed Eng,2001,48:821-829.
[3]Yang DP,Cui DX.Advances and prospects of Gold nanorods[J]. Chem Asian J,2008,3:2010-2022.
[4]Mackey MA,Ali MR,Austin LA,et al.The most effective Gold nanorod size for plasmonic photothermal therapy:theory and in vitro experiments[J].J Phys Chem B,2014,118:1319-1326.
[5]田慧,张奇,项光亚.叶酸受体介导的肿瘤靶向治疗研究进展[J].中国临床药理学杂志,2006,22:227-229.
[6]Hormozi-Nezhad MR,Robatjazi H,Jalali-Heravi M.Thorough tuning of the aspect ratio of Gold nanorods using response surface methodology[J].Anal Chim Acta,2013,779:14-21.
[7]Van De Broek B,Devoogdt N,D'Hollander A,et al.Specific cell targeting with nanobody conjugated branched Gold nanoparticles for photothermal therapy[J].ACS Nano,2011,5:4319-4328.
[8]Ma ZL,Wang JF,Kong SK,et al.Optotransfection of mammalian cells based on a femtosecond laser and facilitated by Gold nanorods[J].Nanotechnology,2013,24:435102-435107.
[9]高斌,李爱华,肖卫华,等.叶酸偶联金纳米棒靶向探针制备及体外肝癌细胞对其摄取状况的研究[J].中华放射学杂志,2013,47:654-658.
[10]李爱华,高斌,贺克武,等.椭球形金纳米棒作为癌细胞靶向探针的研究[J].介入放射学杂志,2013,22:312-316.
[11]Hainfeld JF,Slatkin DN,Smilowitz HM.The use of gold nanoparticles to enhance radiotherapy in mice[J].Phys Med Biol,2004,49:N309-N315.
[12]Franzen S.A comparison of peptide and folate receptor targeting of cancer cells:from single agent to nanoparticle[J].Expert Opin Drug Deliv,2011,8:281-298.
[13]D'angelica M,Ammori J,Gonen M,et al.Folate receptor-alpha expression in resectable hepatic colorectal cancer metastases: patterns and significance[J].Mod Pathol,2011,24:1221-1228.
[14]Wang HF,Huff TB,Zweifel DA,et al.In vitro and in vivo twophoton luminescence imaging of single Gold nanorods[J].Proc Natl Acad Sci USA,2005,102:15752-15756.
[15]Tong L,Zhao Y,Huff TB,et al.Gold nanorods mediate tumor cell death by compromising membrane integrity[J].Adv Mater,2007,19:3136-3141.
[16]Tong L,Wei H,Zhang Y,et al.Visualizing systemic clearance and cellular level biodistribution of Gold nanorods by intrinsic two-photon luminescence[J].Langmuir,2009,25:12454-12459.
The intake of folate-conjugated silica-coated gold nanorods in rabbits with VX-2 liver cancer:anexperimental study
XU Jun,HE Ke-wu,GAO Bin,YANG Hui-jun,SHEN Lei,XIAO Wei-hua.Medical Imaging Center,the Third Affiliated Hospital of Anhui Medical University,Hefei,Anhui Province 230061,China
GAO Bin,E-mail:gaobin_3136@163.com
ObjectiveTo establish the rabbit model with hepatic VX-2 tumor and to investigate the intake of folate-conjugated silica-coated gold nanorods(GNRs@SiO2-FA)in experimental rabbits.Methods Under CT-guidance,animal model with VX-2 liver cancer was established in 27 rabbits by using puncture inoculation method.CT scanning and sonography were employed to observe the tumor growth.After two weeks,the rabbits were randomly and equally divided into blank control group(n=9,injection of saline),portal vein injection group(n=9,injection of GNRs@SiO2-FA)and intra-tumoral injection group(n=9,injection of GNRs@SiO2-FA).Every three rabbits from each group were sacrificed each time at 24 h,48 h and 72 h after the treatment.The tumor tissue and the major organs were collected and sent for pathological examination.The cellular uptake of GNRs@SiO2-FA was studied by confocal laser scanning microscopy. ResultsThe rabbit model of VX-2 liver cancer was successfully established.CT and sonography examination indicated that the tumor was rich in blood supply.Confocal laser scanning microscopy revealed that GNRs@SiO2-FA could specifically bind with tumor cells within 24 hours after injection,then the GNRs@SiO2-FA entered into the tumor cells and gathered in the tumor cytoplasm.ConclusionGNRs@SiO2-FA has highly targeted effect on the liver cancer cells in experimental animals,which has very important application prospect in targeting hyperthermia therapy and in125I seed implantation therapy.(J Intervent Radiol,2015,24:328-332)
VX-2 hepatic tumor model;folate-conjugated gold nanorod;folate receptor;target
R735.7
A
1008-794X(2015)-04-0328-05
2014-10-23)
(本文编辑:边佶)
10.3969/j.issn.1008-794X.2015.04.013
国家自然科学基金(81071240)
230061安徽医科大学第三附属医院影像中心(许军、贺克武、高斌、杨会军、沈蕾);中国科技大学生命科学院(肖卫华)
高斌E-mail:gaobin_3136@163.com
