MS-275对胃腺癌细胞抑制作用及其机制研究
2015-10-28王栋宫卫东黄辞李中华刘振堂吴智群
王栋,宫卫东,黄辞,李中华,刘振堂,吴智群
MS-275对胃腺癌细胞抑制作用及其机制研究
王栋,宫卫东,黄辞,李中华,刘振堂,吴智群
目的采用分子靶向药物治疗胃癌是近年研究热点。探讨组蛋白去乙酰化酶抑制因子MS-275通过多种途径选择性杀伤人胃低分化腺癌细胞株SGC-7901的机制。方法10~100 μmol/L药物浓度梯度的MS-275分别与SGC-7901、人正常胃黏膜上皮细胞株GES-1共培养24 h后,采用WST-1法检测SGC-7901及GES-1细胞存活率,流式细胞仪检测分析SGC-7901细胞线粒体膜电位变化,Western blot、实时荧光定量聚合酶链反应(RTQ-PCR)分别检测处理后胃癌细胞中p21、p27、p57、cyclin B1、cyclin D1基因及相应蛋白表达情况。结果MS-275可使SGC-7901细胞存活率降低(P<0.05),其作用随药物浓度增大更明显,对GES-1细胞无显著影响;MS-275可降低SGC-7901细胞线粒体膜电位(P<0.05);MS-275显著提升p21、p27、p57基因及相应蛋白相对含量,同时降低cyclin B1、cyclin D1基因及其蛋白相对含量(P<0.05)。结论MS-275可选择性杀伤胃腺癌细胞SGC-7901,这一作用可能是通过线粒体凋亡途径及调控细胞周期相关基因和蛋白表达实现的。
MS-275;胃腺癌;SGC-7901;线粒体凋亡;细胞周期阻滞
胃癌是消化系统常见恶性肿瘤,在全球范围内的发病率很高[1]。胃癌发病机制复杂,涉及多种因素、多个病理过程。研究表明,胃癌发生与核小体核心组蛋白N端赖氨酸残基乙酰化和去乙酰化失衡有着密切关系[2]。组蛋白去乙酰化酶抑制因子(HDACi)通过调节组蛋白乙酰化和去乙酰化,发挥抑制肿瘤细胞生长、促进肿瘤细胞凋亡的作用,并且对正常组织的不良反应较小[3-5]。MS-275系人工合成的苯甲酰胺类HDACi,前期研究表明其对胃腺癌细胞具有选择性杀伤作用,但具体机制尚不十分清楚[6-7]。本研究旨在前期研究基础上,深入探究MS-275对人胃低分化腺癌细胞株SGC-7901选择性杀伤的作用机制,为临床治疗提供理论依据。
1 材料与方法
1.1实验材料
人胃低分化腺癌细胞株SGC-7901和人正常胃黏膜上皮细胞株GES-1由第四军医大学细胞生物中心提供,MS-275购自德国Merck公司,RPMI-1640培养基、DMEM高糖培养基、胰蛋白酶及胎牛血清(FBS)购自美国Gibco公司,二甲基亚砜(DMSO)购自美国Sigma公司,WST-1试剂盒及ROS检测试剂盒购自上海碧云天生物技术公司,JC-1线粒体膜电位检测试剂盒购自北京泛博生物技术公司,所用PCR引物购自北京奥科鼎盛生物科技有限公司。
1.2SGC-7901、GES-1细胞培养
SGC-7901细胞在含10%胎牛血清、100 mg/ml链霉素、100 U/ml青霉素的RPMI-1640培养基中培养,GES-1细胞在含10%胎牛血清、100 mg/ml链霉素、100 U/ml青霉素的DMEM高糖培养基中培养;所有细胞均在37℃、5%CO2培养箱中培养。每2~3天换液1次,铺满培养瓶底面积85%以上即可传代,传代时PBS缓冲液洗涤3次,0.25%胰酶消化1 min,一般按1∶3传代。
1.3细胞存活率检测
分别取对数生长期GES-1和SGC-7901细胞,用胰酶消化后吹打成单细胞悬液,以1×105/ml细胞浓度接种于96孔板(每孔100 μl,实验组),以不含细胞的培养基为空白对照(对照组),培养过夜。待细胞充分贴壁,加入MS-275,终浓度分别设置为10、20、40、60、80 μmol/L,每个浓度3个平行孔;对照组不加MS-275。培养24 h后取出,每孔加入10 μl WST-1检测液,37℃温箱中温育4 h后酶标仪450 nm测定吸光值(D),空白对照孔调零后根据吸光值结果计算肿瘤细胞存活率:肿瘤细胞存活率(%)=D实验组/D对照组×100%。
1.4线粒体膜电位检测
分别取SGC-7901细胞和GES-1细胞,用20~80 μmol/L MS-275作用24 h,PBS缓冲液洗涤2次后,按照JC-1线粒体膜电位检测试剂盒说明书操作。用流式细胞仪进行分析,JC-1单体和聚合物荧光信号分别在FL1和FL2探测器上获得,FL1-H、FL2-H分别代表绿色荧光强度和红色荧光强度。
1.5Western blot检测p21、p27等蛋白表达
用三去污试剂从SGC-7901细胞中提取总蛋白,分别采用十二烷基磺酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)对p21、p27、p57、cyclin B1、cyclin D1进行分离,然后转至聚偏二氟乙烯(PVDF)膜上,5%牛奶室温下摇动封闭后加入一抗,4℃过夜;室温下洗膜后加入二抗,用ECL Plus超敏发光液显影。
1.6实时荧光定量聚合酶链反应检测
采用Trizol试剂提取细胞总RNA,反转录获得cDNA,然后作实时荧光定量聚合酶链反应(RTQPCR)检测,并分析检测结果;对待测样品目的基因进行定量,并用管家基因GAPDH进行校正。基因扩增引物及条件见表1。

表1 基因扩增引物及条件
1.7统计学分析
应用SPSS13.0统计软件进行统计学分析。数据用均数±标准差表示,多组间两两比较用单向方差分析,P<0.05为差异有统计学意义。
2 结果
2.1MS-275可选择性降低SGC-7901细胞存活率
WST-1检测结果显示,实验组HDACi MS-275能够明显降低人胃低分化腺癌细胞株SGC-7901存活率,且这种作用具有浓度依赖性,与空白对照组相比,差异有统计学意义(P<0.05)。然而,在相同条件下,人正常胃黏膜上皮细胞株GES-1存活率并未随MS-275浓度升高出现明显降低(P>0.05)(图1)。MS-275对SGC-7901细胞作用24 h的IC50约为80 μmol/L。
2.2MS-275可降低SGC-7901细胞线粒体膜电位
线粒体膜电位变化用流式细胞仪和JC-1试剂盒进行检测。JC-1是一种广泛用于检测线粒体膜电位(Δψm)的理想荧光探针。线粒体膜电位较高时,JC-1聚集在线粒体基质中,形成聚合物,可产生红色荧光;线粒体膜电位较低时,JC-1不能聚集在线粒体基质中,此时JC-1为单体,可产生绿色荧光。由图2可看出,实验组红色荧光强度与绿色荧光强度比值较对照组降低,且具有浓度依赖性,说明MS-275降低了SGC-7901细胞的线粒体膜电位;但在MS-275浓度为80μmol/L时,线粒体膜电位出现升高。2.3MS-275对SGC-7901细胞周期的影响
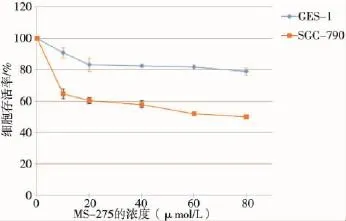
图1 MS-275对不同细胞生存率的影响
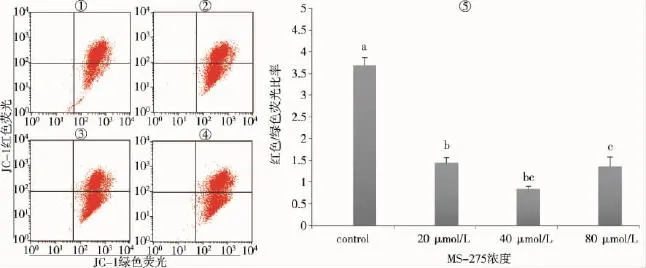
图2 流式细胞仪分析MS-275对SGC-7901细胞体膜电位的影响
Western blot检测显示,MS-275能不同程度地上调SGC-7901细胞周期p21、p27、p57蛋白表达,同时下调cyclin B1、cyclin D1蛋白表达(图3)。
2.4MS-275对肿瘤相关基因mRNA水平的影响
随着MS-275作用浓度增高,p21、p27及p57相对含量逐渐升高,cyclin B1、cyclin D1相对含量逐渐降低(图4),各数据间均有显著性差异(P<0.05)。
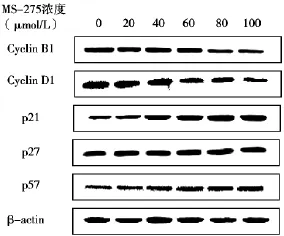
图3 MS-275处理24 h后SGC-7901细胞中肿瘤相关蛋白表达变化
3 讨论
MS-275作为一种人工合成的苯甲酰胺类HDACi,可通过抑制组蛋白去乙酰化酶活性,使靶细胞内组蛋白高度乙酰化,从而使细胞核内染色质结构疏松,并通过影响多种特异性基因表达调控细胞凋亡途径,发挥肿瘤杀伤作用[8-9]。前期大量实验证明,MS-275的肿瘤杀伤作用具有选择性,即它可以显著抑制肿瘤细胞生长,而对正常细胞没有影响[10-11]。
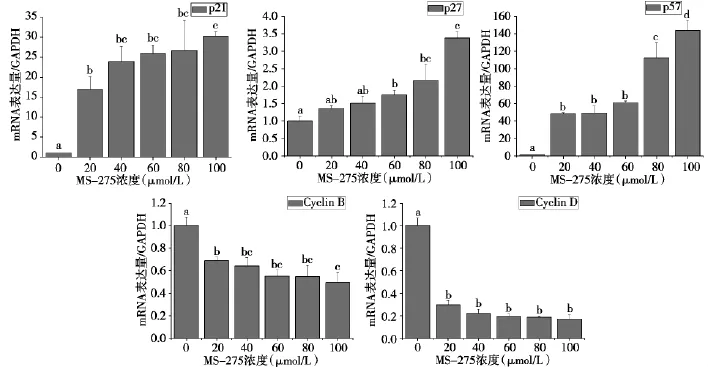
图4 MS-275对SGC-7901细胞中肿瘤相关基因表达的影响
我们课题组前期研究证实,MS-275可明显抑制人胃低分化腺癌细胞株SGC-7901增殖,并具有时间及剂量依赖性,但对人正常胃黏膜上皮细胞株GES-l和张氏肝细胞株却没有致凋亡作用,即MS-275对胃癌细胞具有选择性杀伤作用[6];实验结果显示,MS-275浓度在1~8 μmol/L范围内作用24 h,胃癌细胞存活率虽有下降,但并不具有显著性差异;细胞存活率实验证明,将MS-275浓度调至10 μmol/ L作用24 h,胃癌细胞存活率为64.50%,出现明显的细胞增殖抑制效应,随着药物浓度逐渐增高,细胞存活率不断下降,在80 μmol/L时细胞存活率降至49.79%,说明MS-275对SGC-7901细胞的增殖抑制效应不断增强。为此,我们在本研究中将MS-275浓度范围提升至10~100 μmol/L。
我们通过检测MS-275作用前后线粒体膜电位变化发现,MS-275可使SGC-7901细胞线粒体膜电位下降,且这种作用具有浓度依赖性,提示MS-275经由线粒体途径诱导SGC-7901细胞凋亡。这与Meng等[12]报道HDACi制滴菌素A(trichostatin A,TSA)对结肠直肠癌的作用,Rosato等[13]报道MS-275对白血病细胞的作用相一致。但MS-275在作用浓度为80 μmol/L时,线粒体膜电位出现了升高,这可能与高浓度MS-275对SGC-7901的直接毒性作用有关。
我们前期研究表明,MS-275具有阻滞细胞周期的作用,可诱导SGC-7901细胞停滞于G1/S期[6]。本研究进一步发现,MS-275能显著增加SGC-7901细胞内p21、p27及p57蛋白量,同时降低cyclin B1、cyclin D1蛋白量;RTQ-PCR检测显示MS-275提高了p21、p27及p57基因的相对含量,同时降低了cyclin B1、cyclin D1的相对含量,且作用均具有浓度依赖性。p21、p27、p57、cyclin B1及cyclin D1是重要的细胞周期调控蛋白,参与细胞生长、分化、衰老及死亡过程,同时与肿瘤发生密切相关。p21、p27及p57同属于细胞周期蛋白依赖性激酶抑制因子(CDKI),可通过抑制cyclin-细胞周期蛋白依赖性激酶(CDK)活性来调控细胞周期,并可直接结合增殖细胞核抗原(PCNA)抑制细胞DNA合成,导致细胞停滞在G1期,阻止细胞周期分裂[14]。cyclin B1、cyclin D1基因是重要的原癌基因,它们的蛋白产物分别在G2/M期和G1早期发挥促细胞增殖的正向调控作用[15]。MS-275作用后p21、p27、p57基因及它们的蛋白表达产物相对含量提高,提示MS-275通过上调CDKI使SGC-7901细胞停滞于G1/S期,从而发挥杀伤作用。同时,MS-275可通过下调cyclin B1、cyclin D1抑制SGC-7901细胞增殖。这与Zhou等[16]报道HDACi辛二酰苯胺异羟肟酸(SAHA)及丁酸钠(SB)对成熟神经干细胞的作用,吴伟琪等[17]报道HDACi TSA对胃癌细胞的作用相一致。
综上所述,MS-275可通过线粒体凋亡途径及调控细胞周期相关基因和蛋白的表达发挥对人胃低分化腺癌细胞株SGC-7901的生长抑制作用及选择性杀伤作用。MS-275对人胃低分化腺癌细胞的作用机制复杂,尚需进行后续实验深入研究。进一步揭示MS-275抗胃癌机制,有利于为胃癌治疗提供新途径。
[1]Thrumurthy SG,Chaudry MA,Hochhauser D,et al.The diagnosis and management of gastric cancer[J].BMJ,2013,347:f6367.
[2]Sun WJ,Zhou X,Zheng JH,et al.Histone acetyltransferases and deacetylases:molecular and clinical implications to gastrointestinal carcinogenesis[J].Acta Biochim Biophys Sin(Shanghai),2012,44:80-91.
[3]Bose P,Dai Y,Grant S.Histone deacetylase inhibitor(HDACI)mechanisms of action:Emerging insights[J].Pharmacol Ther,2014,143:323-336.
[4]Ververis K,Hiong A,Karagiannis TC,et al.Histone deacetylase inhibitors(HDACIs):multitargeted anticancer agents[J].Biologics,2013,7:47-60.
[5]Batty N,Malouf GG,Issa JP.Histone deacetylase inhibitors as anti-neoplastic agents[J].Cancer Lett,2009,280:192-200.
[6]刘瑾,任亚蝉,吴智群.组蛋白去乙酰化酶抑制剂MS-275在体外抑制胃癌细胞的实验研究[J].中国癌症杂志,2011,21:585-588.
[7]Zhang Y,Adachi M,Zhao X,et al.Histone deacetylase inhibitors FK228,N-(2-aminophenyl)-4-[N-(pyridin-3-yl-metho-xycarbonyl)amino-methyl]benzamide and m-carboxycinnamic acid bishydroxamide augment radiation-induced cell death in gastrointestinal adenocarcinoma cells[J].Int J Cancer,2004,110:301-308.
[8]Bose P,Dai Y,Grant S.Histone deacetylase inhibitor(HDACI)mechanisms of action:emerging insights[J].Pharmacol Ther,2014,143:323-336.
[9]Hess-Stumpp H,Bracker TU,Henderson D,et al.MS-275,a potent orally available inhibitor of histone deacetylases:the development of an anticancer agent[J].Int J Biochem Cell Biol,2007,39:1388-1405.
[10]Baradari V,Höpfner M,Huether A,et al.Histone deacetylase inhibitor MS-275 alone or combined with bortezomib or sorafenib exhibits strong antiproliferative action in human cholangiocarcinoma cells[J].World J Gastroenterol,2007,13:4458-4466.
[11]Larsson C.Epigenetic aspects on therapy development for gastroenteropancreatic neuroendocrine tumors[J].Neuroendocrinology,2013,97:19-25.
[12]Meng J,Zhang HH,Zhou CX,et al.The histone deacetylase inhibitor trichostatin A induces cell cycle arrest and apoptosis in colorectal cancer cells via p53-dependent and-independent pathways[J].Oncol Rep,2012,28:384-388.
[13]Rosato RR,Almenara JA,Grant S.The histone deacetylase inhibitor MS-275 promotes differentiation or apoptosis in human leukemia cells through a process regulated by generation of reactive oxygen species and induction of p21CIP1/WAF1 1[J]. Cancer Res,2003,63:3637-3645.
[14]Bonelli P,Tuccillo FM,Borrelli A,et al.CDK/CCN and CDKI alterations for cancer prognosis and therapeutic predictivity[J]. Biomed Res Int,2014:361020.
[15]Mani S,Wang CG,Wu KM,et al.Cyclin-dependent kinase inhibitors:novel anticancer agents[J].Expert Opin Investig Drugs,2000,9:1849-1870.
[16]Zhou Q,Dalgard CL,Wynder C,et al.Histone deacetylase inhibitors SAHA and sodium butyrate block G1-to-S cell cycle progression in neurosphere formation by adult subventricular cells[J].BMC Neurosci,2011,12:50.
[17]吴伟琪,施敏,王玉刚,等.曲古霉素A对人胃癌细胞的抑制作用及其机制探讨[J].胃肠病学,2013,18:143-148.
Inhibitory effect of MS-275 on gastric glandular cancer cells and its possible mechanism
WANGDong,GONG Wei-dong,HUANG Ci,LI Zhong-hua,LIU Zhen-tang,WU Zhi-qun.Department of Interventional Radiology,Tangdu Hospital,Fourth Military Medical University,Xi'an,Shaanxi Province 710038,China
WU Zhi-qun,E-mail:zhiqunwu@aliyun.com
ObjectiveThe use of targeting therapy for the treatment of gastric glandular cancer has been a hot topic in recent years.This study aims to clarify that through what ways the histone deacetylase inhibitor MS-275 completes its selectively killing effect on gastric glandular cancer cell line SGC-7901.Methods SGC-7901 cells and GES-1 cells were respectively cultured for 24h,with(10-100)μmol/L concentrations of MS-275.(1)The survival rate of SGC-7901 cells,GES-1 cells and the normal cells were analyzed by WST-1;(2)The change of the mitochondrial membrane potential in SGC-7901 was estimated by flow cytometry;(3)The expression levels of p21,p27,p57,cyclinB1,cyclinD1 were determined by Western blot and PCR methods.Results(1)MS-275 could decrease the survival rate of SGC-7901 cells,the effect was significantly enhanced with the increasing of the concentration(P<0.05),but MS-275 showed no obvious effect on normal gastric mucosa epithelial cells GES-1;(2)MS-275 treatment could decreased the mitochondrial membrane potential of SGC-7901 cells(P<0.05);(3)MS-275 treatment could increase the relative contents of p21,p27,p57 genes and their protein and,at the same time,decrease the relative contents of CyclinB1 and CyclinD1(P<0.05).ConclusionMS-275 treatment can selectively kill gastric glandular cancer cells SGC-7901 through several possible ways,such as inducing mitochondrial apoptosis and regulating the expression levels of cell cycle-related genes and proteins.(J Intervent Radiol,2015,24:333-337)
MS-275;gastric glandular cancer;SGC-7901;mitochondrial apoptosis;cell-cycle arrest
R735.2
A
1008-794X(2015)-04-0333-05
2014-09-04)
(本文编辑:边佶)
10.3969/j.issn.1008-794X.2015.04.014
国家自然科学基金(30973464)
710038西安第四军医大学唐都医院介入科
吴智群E-mail:zhiqunwu@aliyun.com
