北京鸭胚胎后肾间充质干细胞分离培养及鉴定
2015-10-27陈佳王桂艳张宇
陈佳 王桂艳 张宇
(佳木斯大学,佳木斯 154007)
北京鸭胚胎后肾间充质干细胞分离培养及鉴定
陈佳 王桂艳 张宇
(佳木斯大学,佳木斯 154007)
建立禽类后肾间充质干细胞(Metanephric mesenchymal stem cells,MMSCs)体外培养体系,研究其生物学特性和多向分化潜能。采用酶消化法分离北京鸭胚胎MMSCs,绘制生长曲线,通过免疫荧光和RT-PCR对MMSCs进行鉴定,诱导MMSCs向脂肪细胞和胰岛细胞分化。结果表明,鸭胚胎MMSCs具有良好的增殖活力,表达间充质干细胞(Mesenchymal stem cells,MSCs)特异性标志物,并诱导分化为脂肪细胞和胰岛细胞。北京鸭胚胎MMSCs在体外具有较强的自我更新能力及多向分化潜能,可作为组织工程的种子细胞进行保存。
鸭;后肾间充质干细胞;生物学特性;诱导分化
间充质干细胞(Mesenchymal stem cells,MSCs)具有高度增殖、自我更新和多向分化潜能,广泛存在于骨髓、脂肪、牙周膜、新生儿脐带和胎盘组织中,目前大部分的研究集中于人和小鼠,关于家禽类胚胎后肾间充质干细胞(Metanephric mesenchymal stem cells,MMSCs)的相关研究较少[1]。胚胎发育过程中,肾脏有3个相互连接、略为重叠的发育过程,即前肾、中肾和后肾,后肾发育为永久性的肾脏。后肾发育过程中,后肾间充质干细胞有自我更新及多向分化能力,发育为所有肾单位及基质细胞[2]。对胚胎后肾间充质干细胞的研究有助于理解肾脏疾病发生、发展及恢复的病理生理机制,为肾脏组织工程研究提供充足的无免疫原性的肾脏种子细胞[3]。MMSCs在不同诱导条件下可分化为脂肪细胞、成骨细胞、肝样细胞、上皮细胞和胰岛细胞,作为前体细胞使其在组织工程创伤修复、细胞移植、支持造血、基因治疗等方面具有广阔的临床应用前景[4]。
北京鸭是家养鸟纲雁形目鸭科动物,繁殖能力强,有稳定的遗传特性,是北京地区特有的优良品种,也是制作正宗北京烤鸭唯一的原材料。本研究选取北京鸭为实验材料,以胚胎后肾间充质干细胞为研究对象,从形态学、细胞增殖、表面标志物以及多向诱导分化潜能等方面进行鉴定,为家禽干细胞研究及畜禽遗传资源保存提供实验依据。
1 材料与方法
1.1 材料
北京鸭胚胎由中国农业科学院北京畜牧兽医研究所昌平实验基地种禽场提供。
DMEM/F12培养基、胰蛋白酶、EDTA二钠盐(Gibco),胎牛血清(FBS)(Hyclone),多聚甲醛(北京化工厂),兔抗鸡Vimentin、CD44单克隆抗体(BIOSS),兔抗鸡CD34单克隆抗体(Santa Cruz),EGF、bFGF、HGF、Active A(Peprotech),地塞米松、IBMX、胰岛素、DAPI、lV型胶原酶、TritonX-100、β-毓基乙醇、尼克酞胺、L-谷氨酰胺、双硫腙(Sigma),山羊血清、山羊抗兔FITC标记二抗(北京中杉金桥),Trizol(Invitrogen),反转录试剂盒(TaKaRa)。
1.2 方法
1.2.1 MMSCs的分离培养和传代 取18日龄的北京鸭胚胎,解剖取出后肾,去除输尿管芽,用磷酸盐缓冲溶液(phosphate-buffered saline,PBS)反复冲洗,将组织块剪碎成1 mm3大小,37℃ 用0.1% IV型胶原酶消化20 min,0.125%胰蛋白酶和0.02% EDTA消化10 min,用含10%FBS的DMEM/F12培养基终止消化[5],过200目筛,1200 r/min离心10 min,加入完全培养基(DMEM/F12,13%FBS,1% 200 mmol/L L-谷氨酰胺),将细胞密度调整为1 × 106个/ mL,接种到培养皿,置于37℃,5%CO2培养箱中[6]。细胞汇合至80%时,吸弃培养基,PBS洗 2次,用0.125%胰蛋白酶和0.02%EDTA消化,观察细胞形态,有大量细胞收缩变圆发亮时,用完全培养基终止消化,进行传代[7]。
1.2.2 绘制生长曲线 取生长状态良好的P5、P10和P15代MMSCs,胰酶消化收集细胞,以1.0 ×104个/ mL的细胞密度接种于24孔板,每日随机选3个孔,计算细胞个数,取平均值,连续计数8 d,绘制生长曲线,横坐标为培养时间,纵坐标为细胞密度[8,9]。
1.2.3 MMSCs RT-PCR鉴定 选取P4、P8和P12 代MMSCs,Trizol法提取总RNA,测定总RNA浓度及纯度[10],经反转录体系合成cDNA[11],用Primer Premier 5.0软件进行特异性引物设计(表1),间充质干细胞特异性标记基因:Vimentin、CD73、CD44和CD29;造血干细胞特异性标记基因:CD34和CD45;脂肪细胞特异性标记基因:PPAR-γ和LPL;胰岛细胞特异性标记基因:PDX-1和Insulin;内参基因:GAPDH。PCR产物进行2.5%琼脂糖凝胶电泳[12],紫外透射仪检测目的基因是否表达,凝胶成像系统拍照。

表1 RT-PCR反应引物序列表
1.2.4 MMSCs免疫荧光鉴定 细胞汇合至60%时,PBS洗3次,4%多聚甲醛固定20 min,PBS洗3次,0.25%Triton X-100通透15 min,PBS洗3次,山羊血清封闭1 h[13]。弃掉封闭液,加入一抗:兔抗鸡Vimentin、CD44、CD34(1∶100),4℃孵育过夜。PBS洗3次,避光加入FITC标记的山羊抗兔IgG(1∶100),室温孵育1 h,PBS洗3次,1 μg/mL DAPI 避光染核20 min,PBS洗3次[14]。用激光扫描共聚焦显微镜观察并拍照。
1.2.5 MMSCs向脂肪细胞诱导分化及鉴定 P6代MMSCs汇合至70%时,随机分为诱导组和对照组,对照组用完全培养基,诱导组用脂肪细胞诱导液(DMEM/F12 +10%FBS+10-6mol/L地塞米松+10 μg/mL胰岛素+ 60 μmol/L吲哚美辛+ 0.5 mmol/L 3-1-甲基异丁基黄嘌呤(IBMX)+1%L-谷氨酰胺)[15],连续诱导12 d,观察细胞形态,油红O染色[16]。RT-PCR检测脂肪细胞特异性基因过氧化物酶体增殖因子活化受体-γ(Peroxisome proliferator activatedreceptor -γ,PPAR-γ)和脂蛋白脂酶(Lipoproteinlipase,LPL)的表达[17]。
1.2.6 MMSCs向胰岛细胞诱导分化及鉴定 P6代MMSCs汇合至60%时,随机分为诱导组和对照组。对照组用完全培养基,诱导组用胰岛细胞预诱导液(15 ng/mL bFGF+15 ng/mL EGF+2%B27+ DMEM/F12),3 d后换为诱导液(15 ng/mL HGF+30 ng/mL active A+1 mmol/L β-巯基乙醇+10 mmol/L 尼克酰胺+2% B27+ DMEM/F12)[18]。诱导15 d后诱导组和对照组进行双硫腙染色[19]。RT-PCR检测胰岛细胞特异性基因胰岛素(Insulin)和胰岛素促进因子-1(Pancreatic duodenal homeobox-1,PDX-1)的表达情况[20]。
2 结果
2.1 MMSCs的形态学观察和传代培养
原代细胞接种12 h后完全贴壁,40 h后开始增殖,呈长梭形或纺锤形漩涡状生长。细胞形态良好,增殖迅速,传代所需时间短,有利于传代培养。MMSCs易被胰酶消化,传代时可通过控制胰酶消化时间进行纯化,P3代后获得较纯的MMSCs,P18代后,细胞显示衰老迹象(图1),MMSCs共传25代。

图1 北京鸭胚胎MMSCs的形态学观察
2.2 MMSCs生长曲线
P5、P10和P15代MMSCs增殖过程经历潜伏期,对数期,平台期和衰退期,细胞增殖规律均呈典型的“S”形(图2)。

图2 北京鸭胚胎MMSCs生长曲线
2.3 MMSCs RT-PCR和免疫荧光鉴定
P4、P8和P12代MMSCs通 过RT-PCR鉴 定 Vimentin,CD29,CD44和CD73呈阳性,CD34和CD45为阴性,GAPDH为内参基因(图3)。免疫荧光鉴定MSCs特异性标记物Vimentin和CD44阳性表达,造血干细胞特异性标记物CD34阴性表达(图4)。

图3 北京鸭胚胎MMSCs RT-PCR鉴定
2.4 MMSCs向脂肪细胞诱导分化及鉴定
MMSCs经3 d诱导后,细胞增殖缓慢,形态呈扁平状,胞质内出现少量脂滴,诱导8 d后,肥大细胞中脂滴更加明显,脂滴数量随诱导天数的增加而增加并由小的脂滴逐渐聚集成大的脂滴,油红O染色呈阳性,脂滴被染成红色。对照组形态无明显变化,无脂滴出现,油红O染色呈阴性(图5)。RT-PCR鉴定诱导组表达PPAR-γ和LPL,对照组不表达PPAR-γ和LPL(图6)。

图4 北京鸭胚胎MMSCs免疫荧光鉴定

图5 MMSCs向脂肪细胞诱导分化的形态学观察及油红O染色

图6 MMSCs向脂肪细胞诱导分化RT-PCR鉴定
2.5 MMSCs向胰岛细胞诱导分化及鉴定
诱导组在无血清的预诱导液中,细胞增殖减慢,形态无明显变化,换诱导液后,形态发生变化,少量细胞聚团生长,随诱导时间的延长,细胞团簇数量逐渐增加、变大且折光性较强。对照组细胞数量增加,形态无明显变化,无聚团现象。诱导处理15 d后,诱导组双硫腙染色呈阳性,细胞团被染成棕红色,表明诱导细胞的胞浆中富含锌离子,符合胰岛细胞的特征。对照组双硫腙染色呈阴性(图7)。RT-PCR鉴定诱导组表达Insulin和PDX-1,对照组呈阴性表达(图8)。
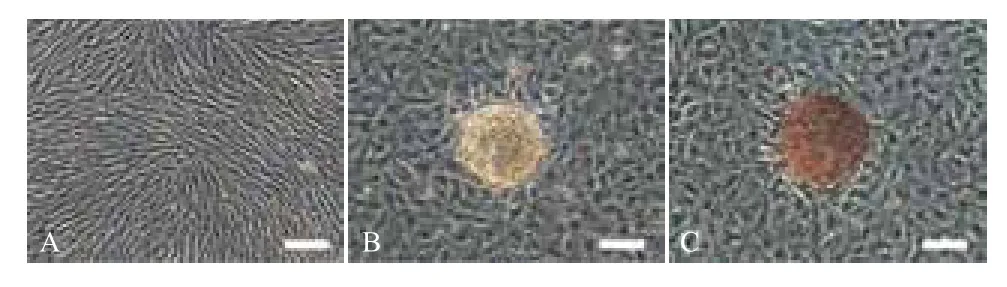
图7 MMSCs向胰岛细胞诱导分化的形态学观察及双硫腙染色
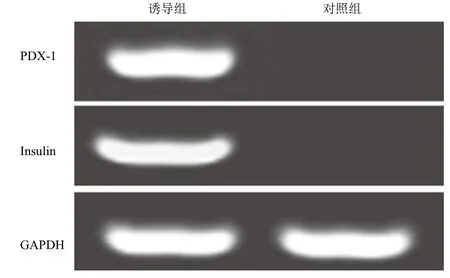
图8 MMSCs向胰岛细胞诱导分化RT-PCR鉴定
3 讨论
有研究表明低密度接种有利于细胞增殖[21]。本研究发现,接种密度过低,细胞增殖缓慢,难以形成集落样生长,细胞容易老化;接种密度过高,细胞增殖较快,短时间内传代次数增多,细胞受机械和化学损伤严重,容易出现空泡、核收缩现象。所以本试验低代次以1∶2传代,高代次以2∶3传代。胰酶对细胞的伤害性很大,要严格控制消化时间,细胞与胰酶充分接触后,将胰酶吸出来,当细胞变圆回缩时,立刻加入终止液,避免了培养液中残留的胰酶对细胞的伤害。
MMSCs生长曲线呈典型的“S”形,经历潜伏期、对数期、平台期和衰退期,符合细胞体外生长的一般规律[22]。传代培养过程中存在机械和化学损伤,细胞需要有适应和恢复时间,即潜伏期,在这之后,细胞已完全适应新的环境并进入对数期。由于细胞密度增大,细胞与细胞之间存在接触抑制,细胞生长缓慢进入平台期,随着接触抑制逐渐明显,细胞数量呈下降趋势进入衰退期。细胞代次越高,受外部环境的影响越大,增殖能力逐渐减弱,细胞逐渐老化。
迄今为止,还没有发现MMSCs特异性标记基因,只能根据MMSCs的形态学特征和报道过的MSCs表面标记基因进行鉴定,本实验选择免疫荧光和RTPCR检测MMSCs与MSCs是否具有相似的生物学特性,进而证实分离培养的MMSCs即为后肾来源的间充质干细胞。
本研究用地塞米松、胰岛素、IBMX和吲哚美辛共同作用诱导MMSCs分化为脂肪细胞。诱导后胞质内形成大量脂滴,油红O染色是鉴定脂滴的常用方法。LPL是脂肪分化前期的标记基因,PPAR-γ是脂肪分化中期的标记基因,RT-PCR检测LPL和PPAR-γ阳性表达,表明MMSCs在适当条件下能够诱导成脂肪细胞,为脂肪组织工程研究提供种子细胞。
糖尿病的发病率逐年升高,将MSCs诱导分化为胰岛细胞,移植到患者体内己经成为治疗糖尿病的新疗法[23]。HGF能促进胰岛细胞形成,Activin A能诱导胰岛素阳性细胞的分化,尼克酰胺促进细胞分化成熟和聚集,增加胰岛细胞数量,加快胰岛细胞团的形成。双硫腙染色呈阳性,表明细胞团含有丰富的锌离子,RT-PCR检测胰岛细胞标记基因Insulin和PDX-1呈阳性表达,说明诱导的细胞符合胰岛细胞特征,可为胰岛细胞移植治疗糖尿病提供种子资源。
4 结论
本研究成功建立了北京鸭胚胎后肾间充质干细胞体外分离培养体系,通过RT-PCR和免疫荧光鉴定MSCs的特异性标记基因,对MMSCs自我增殖和多向分化潜能进行鉴定,证实分离培养的MMSCs为后肾来源的间充质干细胞。
[1] Choi MY, Kim HI, Yang YI, et al. The isolation and in situ identification of MSCs residing in loose connective tissues using a nichepreserving organ culture system[J]. Biomaterials, 2012, 33(18):4469-4479.
[2] Chai OH, Song CH, Park SK, et al. Molecular regulation of kidney development[J]. Anat Cell Biol, 2013, 46(1):191.
[3] Morikawa S, Mabuchi Y, Kubota Y. et al. Prospective identification,isolation and systemic transplantation of multipotent mesench -ymal stem cells in murine bone marrow[J]. J Exp Med, 2009, 206(11):2483-2496.
[4] Rotter N, Oder J, Schlenke P, et al. Isolation and characterization of adult stem cells from human salivary glands[J]. Stem Cells Dev,2008, 17(3):509-518.
[5] Du XW, Wu HL, Zhu YF, et al. Experimental study of therapy of bone marrow mesenchymal stem cells or muscle-likecells/ calcium alginate composite gel for the treatment of stress urinary incontinence[J]. Neurourol Urodyn, 2013, 32(3):281-286.
[6] Manochantr S, Tantrawatpan C, Kheolamai P, et al. Isolation,characterization and neural differentiation potential of amnion derived mesenchymal stem cells[J]. J Med Assoc Thai, 2010, 93(7):183-191.
[7] Tantrawatpan C, Manochantr S, Kheolamai P, et al. Pluripotent gene expression in mesenchymal stem cells from human umbilical cord Wharton’s jelly and their differentiation potential to neural-like cells[J]. J Med Assoc Thai, 2013, 96(9):1208-1217.
[8] Yang XF, He X, He J, et al. High efficient isolation and systematic identification of human adipose-derivedmesenchymal stem cells[J]. J Biomed Sci, 2011, 19(18):59.
[9] Wang J, Wei X, Ling J, et al. Identification and characterization ofside population cells from adult human dental pulp after ischemic culture[J]. J Endod, 2012, 38(11):1489-1497.
[10] De Schauwer C, Meyer E, Van de Walle GR. Markers of stemness in equine mesenchymal stem cells:a plea for uniformity[J]. Theriogenology, 2011, 75(8):1431-1443.
[11] Roszek K, Bomastek K, Drożdżal M, et al. Dramatic differences in activity of purines metabolizing ecto-enzymes between mesenchymal stem cells isolated from human umbilical cord blood and umbilical cord tissue[J]. Biochem Cell Biol, 2013, 91(6):519-525.
[12] Huo SZ, Shi P, Pang XN, et al. Culture and identification of human amniotic mesenchymal stem cells[J]. Chin Med Sci J, 2010, 25(4):211-214.
[13] Fei X, Jiang S, Zhang S, et al. Isolation, culture and identification of amniotic fluid-derived mesenchymal stem cells[J]. Cell Biochem Biophys, 2013, 67(2):689-694.
[14] Ayatollahi M, Geramizadeh B, Zakerinia M, et al. Human bone marrow-derived mesenchymal stem cell:A source for cell-based therapy[J]. Int J Organ Transplant Med, 2012, 3(1):32-41.
[15] Lorenz K, Sicker M, Schmelzer E, et al. Multilineage differentiation potential of human dermal skin-derived fibroblasts[J]. Exp Dermatol, 2008, 17(11):925-932.
[16] Huang HI, Chen SK, Ling QD, et al. Multilineage differentiation potential of fibroblast-like stromal cells derived from human skin[J]. Tissue Eng Part A, 2010, 16(5):1491-1501.
[17] Nesti LJ, Jackson WM, Shanti RM, et al. Differentiation potential of multipotent progenitor cells derived from war-traumatized muscle tissue[J]. J Bone Joint Surg Am, 2008, 90(11):2390-2398.
[18] Silva AC, Percegona LS, França AL, et al. Expression of pancreatic endocrine markers by mesenchymal stem cells from human adipose tissue[J]. Transplant Proc, 2012, 44(8):2495-2496.
[19] Wang HW, Lin LM, He HY, et al. Human umbilical cord mesenchymal stem cells derived from Wharton’s jelly differentiate into insulin-producing cells in vitro[J]. Chin Med J(Engl),2011, 124(10):1534-1539.
[20] Gabr MM, Zakaria MM, Refaie AF, et al. Insulin-producing cells from adult human bone marrow mesenchymal stem cells control streptozotocin-induced diabetes in nude mice[J]. Cell Transplant, 2013, 22(1):133-145.
[21] Sotiropoulou PA, Perez SA, Papamichail M. Clinical grade expansion of human bone marrow mesenchymal stem cells[J]. Methods Mol Biol, 2007, 407:245-263.
[22] Dhar M, Neilsen N, Beatty K, et al. Equine peripheral blood-derived mesenchymal stem cells:isolation, identification, trilineage differentiation and effect of hyperbaric oxygen treatment[J]. Equine Vet J, 2012, 44(5):600-605.
[23] Li HY, Chen YJ, Chen SJ, et al. Induction of insulin-producing cells derived from endometrial mesenchymal stem-likecells[J]. J Pharmacol Exp Ther, 2010, 335(3):817-829.
(责任编辑 李楠)
Isolation,Culture and Identification of Beijing Duck Embryonic Metanephric Mesenchymal Stem Cells
Chen Jia Wang Guiyan Zhang Yu
(University of Jaimusi,Jiamusi 154007)
This study aimed to establish in vitro culture system for the poultry metanephric mesenchymal stem cells(MMSCs), and study their biological characteristics and multi-directional differentiation potential. Enzyme digestion method was applied to separate Beijing duck embryo MMSCs and to draw the growth curve. MMSCs were identified by immunofluorescence and RT-PCR. MMSCs were induced to differentiate into adipocytes and islet cells. The results showed that MMSCs had solid proliferative activity and could express MSCs specific markers, and be induced to differentiate into adipocytes and islet cells. In summary, Beijing duck embryo MMSCs have a strong self-renewing ability and multi-directional differentiation potential in vitro, and can be saved as seed cells for tissue engineering.
duck;metanephric mesenchymal stem cell;biological characteristics;induced differentiation
10.13560/j.cnki.biotech.bull.1985.2015.06.028
2014-10-06
国家自然科学基金项目(31472099 ),国家家养动物种质资源平台项目(2014年)
陈佳,女,硕士研究生,研究方向:药物化学;E-mail:chenjia321@126.com
王桂艳,女,副教授,研究生导师,研究方向:药物化学;E-mail:guiyan713@126.com
