犬α干扰素在家蚕杆状病毒表达系统中的表达及其抗病毒活性的测定
2015-10-27李皓洋胡小元易咏竹杨鑫张志芳李轶女
李皓洋胡小元易咏竹杨鑫张志芳李轶女
(1.中国农业科学院生物技术研究所,北京100081;2.中国农业科学院蚕业研究所,镇江 212018)
犬α干扰素在家蚕杆状病毒表达系统中的表达及其抗病毒活性的测定
李皓洋1胡小元1易咏竹2杨鑫1张志芳1李轶女1
(1.中国农业科学院生物技术研究所,北京100081;2.中国农业科学院蚕业研究所,镇江 212018)
犬α干扰素(CaIFNα)在犬病防治过程中应用广泛。旨在开发一种高效的CaIFNα表达方法。首先按家蚕密码子的偏好性对GenBank中的一个CaIFNα基因进行了优化与合成,将其克隆到杆状病毒转移载体pVL1393中,并与亲本病毒BmBacmid共转染家蚕细胞进行细胞内重组。得到的重组病毒用于感染家蚕幼虫,收集发病幼虫的蚕血淋巴用于CaIFNα检测。采用细胞病变抑制法在MDCK-VSV*GFP系统中测定其抗病毒活性。结果显示家蚕表达的CaIFNα能有效抑制VSV*GFP在细胞内的复制,其抗病毒活性不低于1.78×106U/mL。
犬α干扰素;家蚕杆状病毒表达系统;抗病毒活性检测
干扰素(Interferon,IFN)是一类具有抗病毒活|性、调节细胞增殖分化和免疫调节作用等多种生理活性的细胞因子,在自然免疫以及适应免疫中都发挥着重要作用。IFN于1957年由Isasscs等[1]在进行流感病毒感染鸡胚的实验中首先发现,随后逐渐成为国内外学者的研究热点。IFN因其抗病毒、抗肿瘤和抗寄生虫等功效[2-4],一直被当作一种广谱性治疗药物使用。而天然干扰素的含量非常稀少,而且提取纯化的成本高昂,极大地制约了其广泛应用。因此,应用基因工程手段表达高活性的干扰素产品,一直以来都是生命科学研究的热点问题。
随着我国犬饲养量逐年升高,随之而来的疾病问题也日趋严重。狂犬病、犬细小、犬瘟热等病毒性疾病已经成为制约犬饲养业发展的主要疾病,并且时常引起人类感染,严重威胁人类健康和社会安全。CaIFN在多种犬病毒性疾病的防治过程中发挥了重要作用。CaIFN的研究开始于20世纪80年代,Himmler等[5]用人IFNα的探针从犬基因组中克隆出了CaIFNα的基因,并利用大肠杆菌对CaIFNα进行了原核表达,最后得到了抗病毒活性为3×105U/L的CaIFNα产物。这是对CaIFN研究的首次报道。1992年Devos等[6]用鼠的IFNγ探针从犬基因组中克隆出了CaIFNγ基因,并成功将CaIFNγ在中国仓鼠卵巢细胞(CHO细胞)中进行了表达,得到了有抗病毒活性的CaIFNγ产物。之后,人们又利用基因工程手段在多种表达体系中对犬干扰素进行了表达,并且取得了一系列的表达产品用于犬类疾病的预防和治疗[7,8]。
CaIFN在多种犬类疾病的预防和治疗过程中都发挥着重要作用。王红等[9]给患病毒性肠炎的实验组病犬注射CaIFNα发现,其发病症状明显减轻,并且症状持续时间明显缩短,说明CaIFNα在犬病毒性肠炎的治愈过程中发挥了重要作用。王忠海等[10]将CaIFN用作人用狂犬疫苗的佐剂,注射小鼠后发现CaIFN能诱导中和抗体更早、更多的产生,说明CaIFN在疫苗制备方面有极大的应用潜力。与CaIFN的巨大应用潜力相比,目前市场中的CaIFN制剂的供应量却略显不足,一些犬类疾病,如犬过敏性皮肤炎[11]等仍用猫干扰素进行治疗。因此,简单、高效、安全的CaIFN表达方法的研究具有重要价值。
CaIFNα是治疗犬病毒病的主要药物,其主要作用原理是通过增加MHCⅠ类分子的表达,从而增强细胞毒性T细胞对其靶细胞的杀伤作用,同时增加自然杀伤细胞(NK细胞)的裂解潜能,使机体能有效地抵御外源病毒的感染[12]。利用基因工程手段表达CaIFNα具有可观的研究价值和应用前景。本研究将CaIFNα在家蚕杆状病毒表达系统中进行表达,并在犬细胞系中检测其抗病毒活性,以期开发一种高效的CaIFNα表达手段。
1 材料与方法
1.1 材料
大肠杆菌感受态Trans I由北京全式金生物技术有限公司提供。载体构建过程中用到的限制性内切酶购自Promega公司。昆虫细胞培养基(TC-100)购自AppliChem公司。哺乳动物细胞培养基(高糖DMEM),胎牛血清(FBS)购自Gibco公司。CaIFNα基因由南京金斯瑞生物科技有限公司优化合成。杆状病毒转移载体pVL1393、犬肾细胞(MDCK)、家蚕细胞(Bm-N)、ORF1629缺损的亲本杆状病毒BmBacmid(专利号:201110142492.4)和表达绿色荧光蛋白的水疱性口炎病毒(VSV *GFP)均由本实验室保存。
1.2 方法
1.2.1 CaIFNα基因的优化和合成 本研究选取GenBank中的一条CaIFNα基因序列(HQ680864.1),根据家蚕的密码子偏好性对基因核苷酸序列进行了优化改造,在不改变蛋白序列的前提下,优化处理了可能影响蛋白表达与折叠的因素,如GC含量、mRNA的二级结构等,以提高CaIFNα基因在家蚕体内的表达效率。在优化好的CaIFNα基因序列起始密码子前添加了Kozak序列,以提高CaIFNα在真核表达体系中的表达效率。此外,为了方便后续的克隆实验,在CaIFNα的5'末端和3'末端分别添加了的BamHⅠ和XbaⅠ位点。CaIFNα序列由南京金斯瑞公司优化合成,并连接到pUC57载体上,形成pUC57-CaIFNα。
1.2.2 转移载体pVL-CaIFNα的构建 将pUC57-CaIFNα进行BamHⅠ和XbaⅠ双酶切处理,回收目的基因CaIFNα片段。将得到的CaIFNα与同样用BamHⅠ和XbaⅠ双酶切处理的杆状病毒转移载体pVL1393连接,连接后的质粒转化大肠杆菌感受态Trans I。挑取单菌落提取质粒,并进行酶切鉴定,选取含有目的基因的质粒送北京擎科新业生物技术有限公司测序,测序结果与预期结果一致的质粒命名为pVL-CaIFNα。
1.2.3 重组病毒的共转染及筛选 采用脂质体介导法将pVL-CaIFNα与线性化的亲本病毒DNA共转染Bm-N细胞,使其在细胞内进行重组[13]。共转染后将Bm-N细胞置于27℃环境中培养6 h,弃上清,补加含10% FBS的TC-100培养基,在27℃环境中继续培养。连续观察约4-5 d,待细胞病变浮起后,收集上清液,得到重组病毒。将重组病毒液按105pfu/头的剂量接种五龄起蚕,待家蚕发病后,收集蚕血淋巴,得到家蚕表达产物,-20℃保存。
1.2.4 CaIFNα抗病毒活性的鉴定 采用细胞病变抑制法[14],利用MDCK-VSV*GFP系统检测家蚕表达的CaIFNα的抗病毒活性。样品以10倍稀释度做梯度稀释,共5个稀释度,每个稀释度设6个重复。每个细胞孔加入处理后的样品100 μL,攻毒100TCID50。同时设置病毒对照组(只加病毒不加干扰素)和空白对照组(不加病毒和干扰素)。攻毒24 h后,观察细胞病变情况,根据绿色荧光蛋白的表达量来评估细胞的病变水平。
2 结果
2.1 合成质粒pUC57-CaIFNα的酶切鉴定
对南京金斯瑞公司优化合成的pUC57-CaIFNα质粒,进行BamHⅠ和XbaⅠ双酶切鉴定。经电泳分离后,出现了一条大小约为600 bp的条带(图1)。CaIFNα的基因为564 bp,预期结果与实验结果一致。经测序分析表明CaIFNα序列合成无误,可用于进一步的实验。
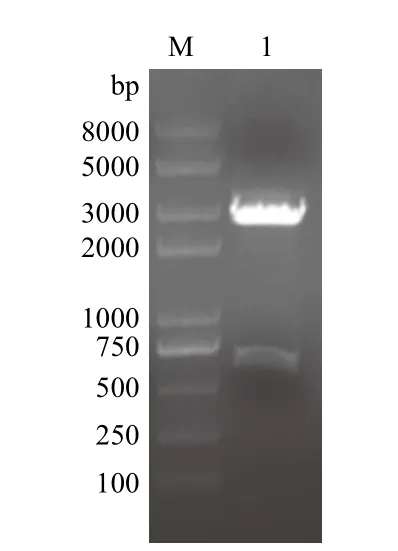
图1 合成质粒pUC57-CaIFNα的酶切鉴定
2.2 重组转移载体pVL-CaIFNα的酶切鉴定
目的基因CaIFNα片段与经双酶切pVL1393载体连接后,转化大肠杆菌感受态,挑取单菌落提取质粒后,用BamHⅠ和XbaⅠ对质粒进行双酶切鉴定,经电泳分离后,出现于预期结果大小相似的目的条带(图2)。将含有目的条带的重组质粒进行测序,测序分析表明CaIFNα已正确连接到pVL-1393中。
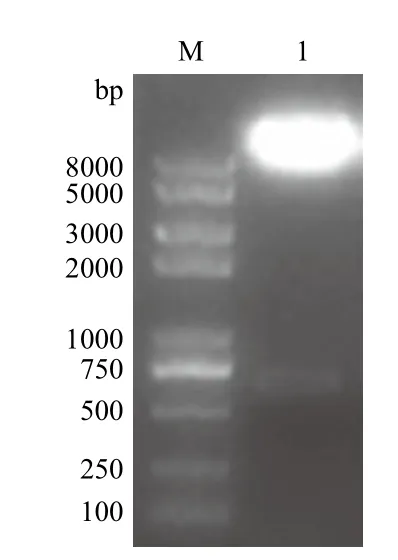
图2 重组转移载体pVL-CaIFNα的酶切鉴定
2.3 CaIFNα抗病毒活性检测
利用细胞病变抑制法测定表达的CaIFNα的抗病毒活性,攻毒大约24 h后,观察到空白对照组细胞生长状态正常,无荧光出现,实验组加入高浓度干扰素的细胞孔病毒复制被完全抑制,无荧光(图3-A),当干扰素稀释到105倍时,部分细胞孔出现细胞病变,但病变程度仍明显小于病毒对照组,说明该稀释度下干扰素已无法完全抑制病毒复制,但仍有明显的抑制作用(图3-B),病毒对照组所有细胞孔都出现荧光(图3-C)。出现绿色荧光的细胞孔即记为细胞病变,记录细胞病变情况(表1),统计病变孔与非病变孔的个数,按照Reed-Muench法计算干扰素的效价。选取多次重复测定结果中的较有代表性的一次数据进行计算和分析,计算其效价至少可达1.78×106U/mL。
3 讨论
随着养犬业规模的不断扩大,犬类疾病对人类健康的影响也越来越严重。CaIFNα作为一种具有广谱抗病毒、细菌和寄生虫活性的生物制剂,在犬类疾病的预防与治疗方面有广阔的应用前景。CaIFNα的高效表达一直是生命科学的一个研究热点,目前,CaIFNα已在多种表达体系内得到表达。随着外源蛋白表达技术越来越成熟,如何进一步简化生产工艺,降低生产成本,提高外源蛋白的生物活性将是今后蛋白表达技术发展的方向。
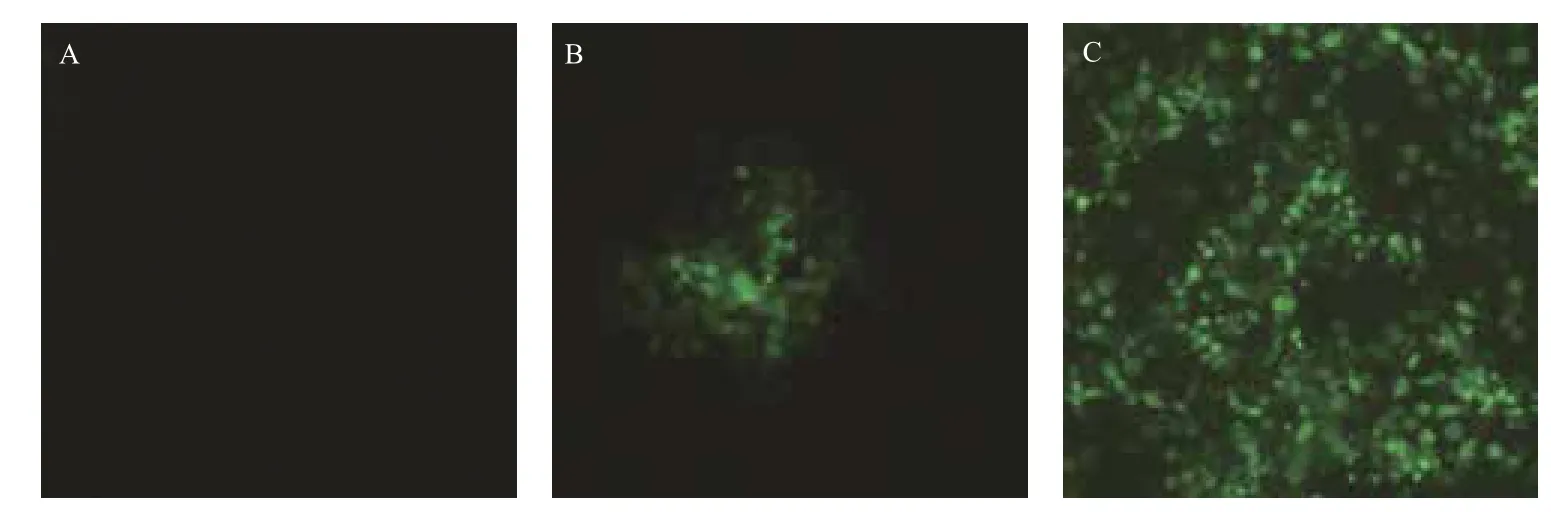
图3 利用MDCK/VSV*GFP 系统检测家蚕表达的CaIFNα的抗病毒活性
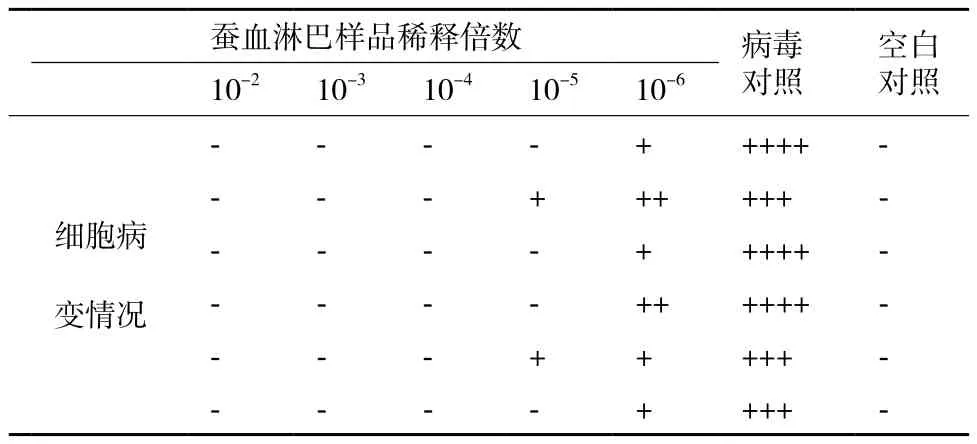
表1 家蚕表达的CaIFNα抗病毒活性检测
大肠杆菌作为一种传统的外源蛋白表达工具,因其遗传背景清楚、培养周期短、目的基因表达水平高等优点一直被广泛使用。殷玉和等[15]合成了编码CaIFNα的基因片段,在大肠杆菌中进行诱导表达。表达产物经纯化后利用MDCK-VSV系统进行了检测,测定纯化后CaIFNα蛋白的比活为3×107U/mg。毕赤酵母作为一种真核表达工具,具有翻译后修饰的功能,能使表达的外源蛋白正常的进行糖基化等修饰,有利于提高外源蛋白的活性,因此也常被用于干扰素的表达。王玉等[16]将经过密码子优化的CaIFNα基因在毕赤酵母内表达,得到最高活性为1.58 × 108U/mg的CaIFNα产品。但外源蛋白在大肠杆菌中的表达产物经常形成包涵体,不具备有效的生物活性,要获得具有活性的蛋白质需要经过变性复性等一系列过程,操作复杂且成本高昂;在毕赤酵母中的表达也面临复杂的纯化过程,这不可避免地增加了干扰素的生产工序和生产成本。杆状病毒表达系统是一种优秀的真核表达系统,具有高安全性,高表达量和良好的外源蛋白翻译后加工修饰功能等优点,在高活性真核蛋白表达过程中被广泛采用[17]。故本研究选用家蚕-杆状病毒表达系统来进行CaIFNα的表达。
由于不同物种中密码子的使用存在偏好性,因此采用PCR法直接克隆的功能蛋白的DNA序列,在异源宿主体内表达时经常面临蛋白表达量低,活性差等一系列问题。密码子偏好性优化是提高异源蛋白表达量的有效手段[18]。Zhou等[19]在利用哺乳动物细胞表达牛乳头瘤病毒的衣壳蛋白时,通过密码子优化,使表达量提高了1 000多倍。因此,本实验根据NCBI中的CaIFN-α基因序列,按家蚕密码子偏好性对其进行优化。同时,在优化过程中去除了mRNA二级结构,重复序列等不利于蛋白表达的因素,然后采取化学合成法合成用于表达的完整的CaIFNα序列,以期使CaIFNα在家蚕细胞内得到良好表达。
在进行CaIFNα抗病毒活性测定时,本研究采用了重组VSV*GFP病毒,该病毒感染细胞后可以在细胞中复制,并产生绿色荧光蛋白,通过观察荧光的有无即可确定细胞是否被病毒感染[20]。有效避免了用普通VSV测定干扰素活性时细胞病变不明显,观察结果偏差大的问题,大大提高了检测的灵敏度与结果的可靠性。经多次重复实验,测得家蚕表达的CaIFNα抗病毒活性基本稳定,抗病毒活性不低于1.78×106U/mL。
4 结论
本研究对犬α干扰素基因进行合理的优化设计,并成功表达出具有良好抗病毒活性的CaIFNα,每毫升蚕血淋巴中CaIFNα的抗病毒活性不低于1.78×106U,为低成本、高活性的CaIFNα生物制剂的高效制备提供了一种有效途径。
[1] Isaacs A, Lindenmann J. Virus interference. I. The interferon[J]. Proc R Soc Lond B Biol Sci, 1957, 147(927):258-267.
[2] 夏伦斌, 王新华, 连宏军, 等. γ干扰素及其在动物疾病防控中的应用[J]. 动物医学进展, 2007, 28(5):74-78.
[3] Nishikawa Y, Iwata A, Nagasawa H, et al. Comparison of the growth inhibitory effects of canine IFN-alpha, -beta and -gamma on canine cells infected with Neospora caninum tachyzoites[J]. J Vet Med Sci, 2001, 63(4):445-448.
[4] Yasukawa K, Saito S, Kubo T, et al. Low-dose recombinant canine interferon-gamma for treatment of canine atopic dermatitis:an open randomized comparative trial of two doses[J]. Vet Dermatol,2010, 21(1):42-49.
[5] Himmler A, Hauptmann R, Adolf GR, et al. Structure and expression in Escherichia coli of canine interferon-alpha genes[J]. J Interferon Res, 1987, 7(2):173-183.
[6] Devos K, Duerinck F, Van Audenhove K, et al. Cloning and expression of the canine interferon-gamma gene[J]. J Interferon Res,1992, 12(2):95-102.
[7] Zhao N, Yao H, Lan L, et al. Efficient production of canine interferonalpha in silkworm Bombyx mori by use of a BmNPV/Bac-to-Bac expression system[J]. Appl Microbiol Biotechnol, 2008, 78(2):221-226.
[8] Taira O, Watanugi I, Hagiwara Y, et al. Cloning and expression of canine interferon-alpha genes in Escherichia coli. [J]. J Vet Med Sci, 2005, 67(10):1059-1062.
[9] 王红. 犬α-干扰素的表达及其治疗犬病毒性肠炎临床疗效观察[D]. 北京:中国农业科学院, 2009.
[10] 王忠海. 干扰素在狂犬病疫苗中的佐剂效果研究[J]. 中国药业, 2009, 18(24):17-19.
[11] Litzlbauer P, Weber K, Mueller RS. Oral and subcutaneous therapy of canine atopic dermatitis with recombinant feline interferon omega[J]. Cytokine, 2014, 66(1):54-59.
[12] 郑拓, 吴长德. 犬干扰素的研究进展[J]. 中国兽医杂志,2012, 48(1):77-79.
[13] Li Z, Yi Y, Yin X, et al. Expression of foot-and-mouth disease virus capsid proteins in silkworm-baculovirus expression system and its utilization as a subunit vaccine[J]. PLoS One, 2008, 3(5):e2273.
[14] 李田田, 杨灵, 易咏竹, 等. 鸡α干扰素在家蚕中的表达及抗病毒活性测定[J]. 生物技术通报, 2014(3):171-176.
[15] 殷玉和, 李莹莹, 刘新涛, 等. 犬α干扰素的原核表达及活性检测[J]. 畜牧与兽医, 2013, 44(7):69-72.
[16] 王玉, 朱艳平, 郭霄峰. 犬干扰素α1基因的修饰及在毕赤酵母中的表达[J]. 中国生物制品学杂志:, 2011, 24(9):1064-1067.
[17] Usami A, Suzuki T, Nagaya H, et al. Silkworm as a host of baculovirus expression[J]. Curr Pharm Biotechnol, 2010, 11(3):246-250.
[18] Gustafsson C, Govindarajan S, Minshull J. Codon bias and heterologous protein expression[J]. Trends Biotechnol, 2004, 22(7):346-353.
[19] Zhou J, Liu W, Peng S, et al. Papillomavirus capsid protein expression level depends on the match between codon usage and tRNA availability[J]. J Virol, 1999, 73(6):4972-4982.
[20] 温志远, 葛金英, 胡森, 等. 表达增强绿色荧光蛋白重组水疱性口炎病毒印第安纳株的构建[J]. 中国预防兽医学报,2007, 29(12):905-911.
(责任编辑 李楠)
Expression of Canine Interferon Alpha in Silkworm-baculovirus Expression System and the Antiviral Activity Assay
Li Haoyang1Hu Xiaoyuan1Yi Yongzhu2Yang Xin1Zhang Zhifang1Li Yinü1
(1. Biotechnology Research Institute,Chinese Academy of Agricultural Sciences,Beijing 100081;2. The Sericultural Research Institute,Chinese Academy of Agricultural Sciences,Zhenjiang 212018)
Canine interferon alpha(CaIFNα)was widely used in the prophylaxis and cure of canine diseases. The purpose of this study is to develop an efficient method to express CaIFNα. A canine interferon alpha gene in GenBank was optimized according to the codon bias of silkworm and synthesized, and then cloned into the baculovirus transfer vector pVL1393 to construct the recombinant plasmid pVL-CaIFNα. The pVL-CaIFNα was co-transfected with the BmBacmid DNA into silkworm cells and after in vivo recombination. The recombinant virus was gathered and used to infect silkworm larvae. The hemolymph of infected larvae was collected for antiviral activity assay. The antiviral activity of expressed CaIFNα was examined on Madin-Darby canine kidney cells infected with the vesicular stomatitis virus expressing green fluorescent protein(VSV*GFP). The result showed that CaIFNα expressed in silkworm can inhibit the multiplication of VSV*GFP and the antiviral activity was about 1.78×106U/mL.
canine interferon alpha;silkworm-baculovirus expression system;antiviral activity assay
10.13560/j.cnki.biotech.bull.1985.2015.06.022
2015-03-17
国家高技术研究发展计划“863”计划(2011AA100603),国家重点基础研究发展计划“973”计划(2012CB114600)
李皓洋,男,硕士,研究方向:昆虫杆状病毒表达系统;E-mail:815579279@qq.com
李轶女,女,博士,副研究员,研究方向杆:杆状病毒表达系统;E-mail:liyinv@caas.cn
