小鼠神摯母细胞瘤细胞株用于A型肉毒毒素重链体外实验的可行性研究
2015-10-27王红高美玲兰婧乔欢李夏青
王红高美玲兰婧乔欢李夏青
小鼠神摯母细胞瘤细胞株用于A型肉毒毒素重链体外实验的可行性研究
王红1高美玲1兰婧1乔欢2李夏青1
目的 探讨小鼠神经瘤母细胞(Neuro-2a)细胞株用于A型肉毒毒素重链(BoNT/A HC)体外细胞模型的可行性。方法 对体外培养1 ~ 5 h的Neuro-2a细胞和经A型肉毒毒素(BoNT/A)重链作用的Neuro-2a细胞(细胞接种于96孔培养板后随机分为对照组、0.01 nmol/L组、0.1 nmol/L组、1 nmol/L组和10 nmol/L组),进行BoNT/A HC相关受体的检测,观察BoNT/A HC作用不同时间(24、48及72 h)后BoNT/A HC对细胞突起生长状况的影响,包括有突起细胞的百分比、细胞突起的长度以及突起总数。数据经GraphPad Prism 5.0 One-way ANOVA分析。结果 体外培养后Neuro-2a细胞表达高亲和力的突触囊泡蛋白2 (SV2)和低亲和力的三涎酸神经节苷脂亚型1b (GT1b)受体。与对照组相比,BoNT/A HC能明显促进Neuro-2a细胞突起再生及突起长度增加,其中0.1 nmol/L BoNT/A HC作用24 h后突起的Neuro-2a细胞百分比为(20.61± 4.87)%高于对照组[(15.27± 3.56)%,F = 37.7,P < 0.001]、神经突起的总数量为(2.18 ± 1.24)个高于对照组(1.68 ± 0.99)个,(F = 9.54,P < 0.001)、平均突起的长度为(38.76 ± 38.11) μm,与对照组(23.38 ± 27.13)μm相比差异无统计学意义;当BoNT/A HC的浓度增加为1、10 nmol/L时,有突起的Neuro-2a细胞百分比分别为(15.08 ± 5.27)%和(12.65 ± 5.65)%,神经突起的总数量分别为(1.65 ± 0.85)个和(1.64 ± 0.85)个、平均突起的长度分别为(33.75 ± 39.11)μm和(18.95 ± 21.71) μm,与对照组相比差别不大,差异无统计学意义。随作用时间的延长(48 h和72 h)0.1 nmol/L组有突起细胞的百分比、细胞突起的长度以及突起总数与对照组相比均增高,且差异具有统计学意义,而1,10 nmol/L组中细胞变化差异无统计学意义。结论 Neuro-2a细胞可用于BoNT/A HC体外研究的细胞模型,BoNT/A HC的作用表现为低浓度(0.1 nmol/L)的促进作用而高浓度(10 nmol/L)时呈现抑制。
肉毒毒素类; 突触蛋白类; 神经节苷脂类
A型肉毒毒素(botulinum neurotoxin serotype A,BoNT/A)是由BoNT/A杆菌产生分泌的外毒素,是所有肉毒毒素血清类型中毒性作用最强且研究也最为广泛的一种[1]。研究证实BoNT/A的毒性作用主要是通过阻断胆碱能神经末梢释放乙酰胆碱导致神经肌肉接头去神经化,骨骼肌不能收缩发生麻痹而致。利用该机制,近半个世纪以来,BoNT/A广泛用于美容除皱,治疗斜视、眼睑和面肌痉挛、痉挛性斜颈、以及其它肌肉收缩过度的临床病症[1-2]。越来越多的临床观察BoNT/A在缓解临床慢性病理性疼痛方面亦具有明显疗效[2]。此外体内实验也发现BoNT/A局部注射后期可伴有运动终板样结构形成[3-6],培养液内加入一定浓度的BoNT/A可以刺激脊髓运动神经元突起生长的作用[7]。因此,BoNT/A已经成为治疗许多临床顽症的新药制剂研究方向之一。
BoNT/A主要通过与宿主细胞膜上的相应受体结合形成毒素-膜受体复合物,介导毒素进入细胞而发挥毒性作用。受体分为蛋白受体和神经节苷脂两种,其中突触囊泡蛋白2(synaptic vesicle 2,SV2)是与BoNT/A结合的高亲和力受体[8-13],三涎酸神经节苷脂亚型1b(trisialoganglioside 1b, GT1b)是与BoNT/A结合的低亲和力受体[14]。GT1b与BoNT/A的结合可以促进细胞膜上高亲和力受体在膜上的漂移和簇集,使得毒素快速有效地与膜蛋白结合形成毒素—受体复合物入胞[15]。
BoNT/A由重链(heavy chain, HC)和轻链(light chain, LC)两部分组成。HC主要含有与宿主膜蛋白相结合的功能区域,HC与宿主相应膜蛋白受体结合形成毒素—受体复合物而介导LC入胞;LC为BoNT/A的活性部位,具有金属依赖性蛋白水解酶的活性。本文采用纯化的重组BoNT/A HC作用于小鼠神经瘤母细胞(mouse neuroblastoma neuro-2a cells, Neuro-2a)细胞株,检测其对神经突起生长变化的影响。
材料与方法
一、材料
Neuro-2a细胞购自中国科学院上海细胞库,胎牛血清和DMEM-HG购自美国Hyclone公司,人工重组BoNT/A HC来自美国List Biological Laboratories公司,鼠抗GT1b单克隆抗体购自美国Merck Millipore公司,兔抗SV2多克隆抗体购自德国Synaptic Systems GmbH公司,Alexa Fluro 488标记的驴抗鼠及Alexa Fluro 488标记的驴抗兔均购自美国Invitrogen Corporation公司。
二、方法
1.细胞培养:Neuro-2a细胞置于含有10%胎牛血清和1%青链霉素的DMEM-HG培养液内,置于37℃、5% CO2孵箱培养,每隔2 d进行半换液1次。待细胞长满培养瓶底部的80%时胰酶消化细胞配成细胞悬液备用。
2.免疫荧光法:将Neuro-2a细胞以1 × 104个细胞/孔接种到已铺被多聚赖氨酸96孔培养板内,培养一定时间后吸弃培养液,预冷PBS(4℃)洗涤2次,4%多聚甲醛固定细胞室温60 min。细胞经PBS洗涤(5 min × 3次),0.1% Trixton X-100室温透膜10 min,10%正常驴血清封闭1 h,分别加入鼠抗GT1b单克隆抗体(1:800)、兔抗SV2多克隆抗体(1:800),湿盒中4℃冰箱孵育过夜。次日PBS洗涤,加入Alexa Fluro 488标记的驴抗鼠(1:500)及Alexa Fluro 488标记的驴抗兔(1:500)荧光二抗,湿盒内室温避光孵育1 h,PBS洗涤。适量的含有DAPI的长效抗衰败荧光封片剂覆盖于细胞表面置于Olympus激光共聚焦显微镜下观察。
3.BoNT/A HC作用后Neuro-2a细胞突起测定:细胞接种后随机分为对照组和实验组(0.01 nmol/L组、0.1 nmol/L组、1 nmol/L组和10 nmol/L组)每组8个孔,于细胞贴壁生长后4 h时,实验组加入不同浓度的BoNT/A HC,阴性对照组加入等剂量的DMEM基础培养液,分别于给药后24 h、48 h和72 h时将细胞置于相差倒置显微镜摄影,每孔随机视野拍摄2 ~ 3张图片,每组共20张图片,用于细胞突起的测定,包括:(1)具有突起的细胞占细胞总数的比例(%);(2)计数细胞突起总数;(3)测量神经突起长度。
三、统计学分析方法
神经突起的长度采用Cell Sens Entry软件进行测量(单位:μm),实验数据(具有突起的细胞占细胞总数的比例、神经突起的总数量以及神经突起长度)以±s表示。数据经GraphPad Prism 5.0 One-way ANOVA分析,以P < 0.05为差异有统计学意义。
结 果
一、Neuro-2a细胞表达BoNT/A HC相关受体
应用SV2免疫荧光染色,在激光共聚焦显微镜下观察到从Neuro-2a接种于培养板后的1 ~ 5 h SV2阳性染色呈渐强的趋势,且从开始时的胞膜附近逐渐增强呈现灶状强阳性区。Neuro-2a细胞接种1 h即可看到SV2阳性染色,主要集中于胞膜附近,部分细胞可见SV2在细胞膜附近形成灶性强阳性区,随培养时间的延长SV2表达呈现坚强的趋势。当培养时间达到4 h时,可见Neuro-2a细胞呈SV2免疫染色强阳性,部分阳性聚集局部区域呈现灶性阳性团块(图1)。
采用抗GT1b抗体对不同时间点Neuro-2a细胞进行免疫荧光染色,观察Neuro-2a细胞上GT1b的分布及含量发现,Neuro-2a细胞表达GT1b,且GT1b主要分布于细胞膜区域和细胞突起;随培养时间的延长GT1b的含量呈逐步增多的趋势(图2)。
二、BoNT/A HC刺激Neuro-2a细胞神经突起再生
根据SV2及GT1b在Neuro-2a细胞的表达情况,确定加入BoNT/A HC的时间为细胞接种后4 h。观察BoNT/A HC作用不同时间后Neuro-2a细胞突起生长情况。
1.具有突起的Neuro-2a细胞百分比:不同浓度的BoNT/A HC作用后,与对照组相比具有突起的Neuro-2a细胞百分比增长不尽相同,如图3所示。0.1 nmol/L BoNT/A HC作用24 h后,具有突起的Neuro-2a细胞百分比(20.61 ± 4.87)%较对照组(15.27 ± 3.56)%明显增多,而1 nmol/L和10 nmol/L浓度时则为负增长[分别为(15.08 ± 5.27)%和(12.65 ± 5.65)%]。随着BoNT/A HC的作用时间延长,具有突起的细胞百分比有增加趋势,其中以0.1 nmol/L组增加最为明显,如表1所示。
2. BoNT/A HC 影响下神经突起平均数量的变化:加入低浓度(0.01 nmol/L、0.1 nmol/L)BoNT/ A HC作用不同时间后,每个突起细胞的平均突起数量均比对照组增多,以0.1 nmol/L组增加最为明显;加入高浓度(1 nmol/L、10 nmol/L)BoNT/A HC后与对照组相比突起数量变化不明显,差异无统计学意义。没有BoNT/A HC影响时,三个时间细胞的平均突起数量[24 h为(1.68 ± 0.99)个,48 h为(1.82 ± 1.13)个,72 h为(1.84 ± 0.96)个]差异无统计学意义,加入0.1 nmol/L BoNT/A HC后,突起的平均数量依次为(2.18 ± 1.24)个、(2.28 ± 1.11)个、(2.33 ± 1.22)个,与同一时间点对照组相比差异具有统计学意义(P < 0.05),如表2所示。
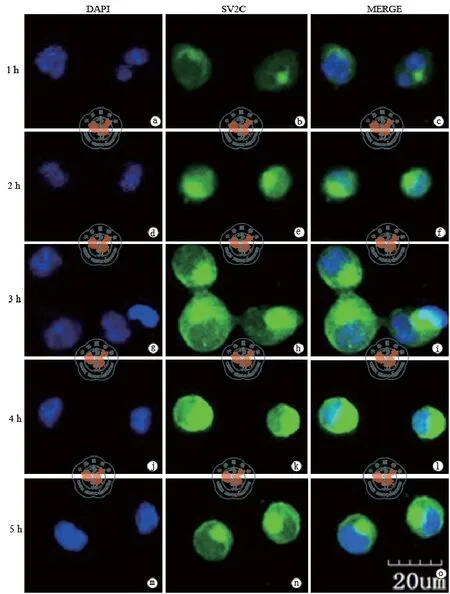
图1 激光共聚焦显微镜下观察不同培养时间点Neuro-2a细胞表达SV2及分布特征(免疫荧光染色×100)
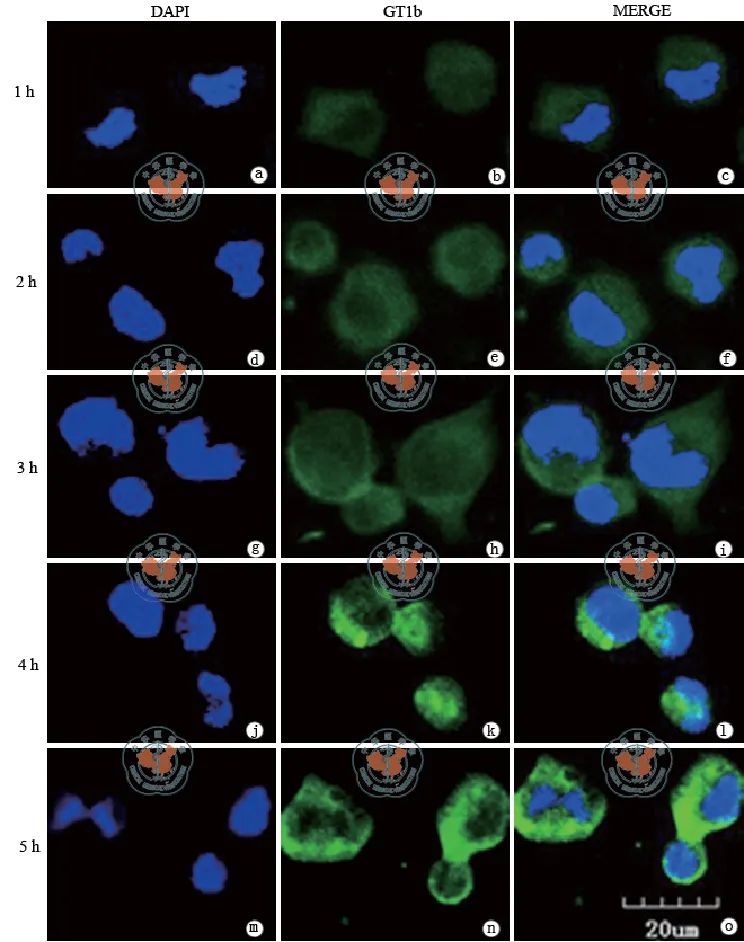
图2 激光共聚焦显微镜观察Neuro-2a细胞在不同时间点GT1b的表达及分布情况(免疫荧光染色法×100)
3. BoNT/A HC对Neuro-2a细胞神经突起长度的影响:采用Olympus Cell Sens Entry软件对Neuro-2a细胞的突起进行长度测定,结果显示:加入低浓度(0.01 nmol/L,0.1 nmol/L)的BoNT/A HC后神经突起的长度比对照组长,尤以0.1 nmol/ L组增长明显。其中0.1 nmol/L BoNT/A HC作用48 h、72 h后细胞的突起长度均比对照组显著增加(分别为70.12 ± 6.73 μm、89.63 ± 7.75 μm、45.07 ± 3.57 μm),差异具有统计学意义(P < 0.05),如表3所示。而加入高浓度(1 nmol/L,10 nmol/L)的BoNT/A HC后神经突起的长度与对照组相比增长不明显甚至出现抑制效应。
表1 不同浓度BoNT/A HC作用后不同时间突起细胞的百分比(%,±s)
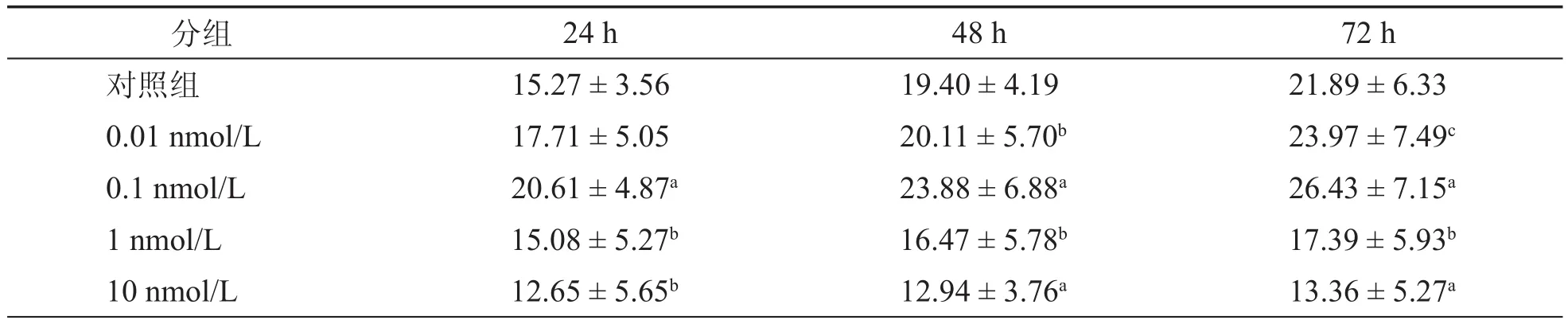
表1 不同浓度BoNT/A HC作用后不同时间突起细胞的百分比(%,±s)
注:与同一时间对照组相比,aP < 0.05;与同一时间0.1 nmol/l组相比,bP < 0.05,;与同浓度24 h组相比,cP < 0.05
分组24 h48 h72 h对照组15.27 ± 3.5619.40 ± 4.1921.89 ± 6.33 0.01 nmol/L17.71 ± 5.05 20.11 ± 5.70b23.97 ± 7.49c0.1 nmol/L 20.61 ± 4.87a23.88 ± 6.88a26.43 ± 7.15a1 nmol/L 15.08 ± 5.27b16.47 ± 5.78b17.39 ± 5.93b10 nmol/L 12.65 ± 5.65b12.94 ± 3.76a13.36 ± 5.27a
表2 BoNT/A HC作用后每个突起细胞的平均突起数量(个,±s)

表2 BoNT/A HC作用后每个突起细胞的平均突起数量(个,±s)
注:与同一时间对照组相比,aP < 0.05;与同一时间0.1nmol/L组相比,bP < 0.05
分组24 h48 h72 h对照组1.68 ± 0.991.82 ± 1.131.84 ± 0.96 0.01 nmol/L1.84 ± 1.071.95 ± 1.051.99 ± 1.22 0.1 nmol/L 2.18 ± 1.24a2.28 ± 1.11a2.33 ± 1.22a1 nmol/L 1.65 ± 0.85b1.74 ± 0.95b1.84 ± 1.16b10 nmol/L 1.64 ± 0.85b1.70 ± 0.90b1.60 ± 1.16b
表3 0.1 nmol/L的HC作用不同时间后突起细胞的平均突起长度(μm,±s)
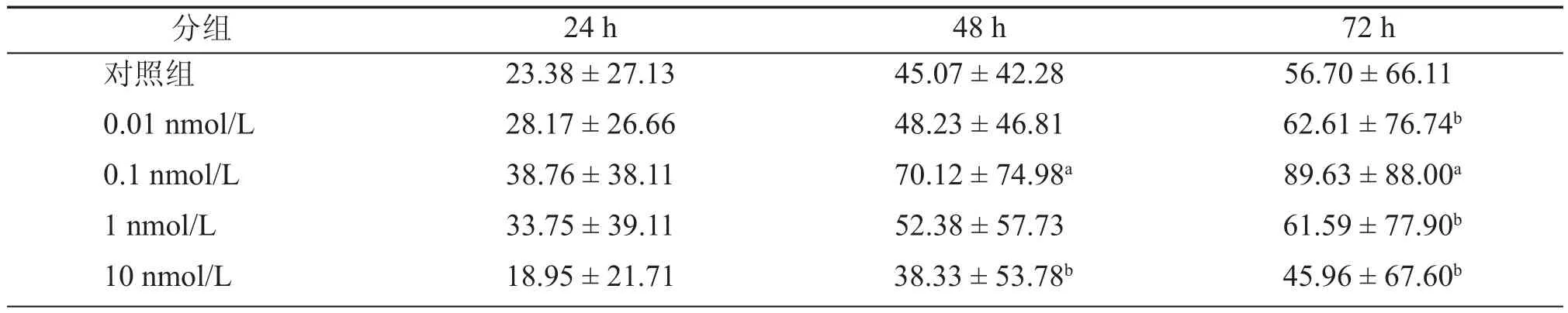
表3 0.1 nmol/L的HC作用不同时间后突起细胞的平均突起长度(μm,±s)
注:与对照组相比,aP < 0.05;与同一时间0.1nmol/L组相比,bP < 0.05
分组24 h48 h72 h对照组23.38 ± 27.1345.07 ± 42.2856.70 ± 66.11 0.01 nmol/L28.17 ± 26.6648.23 ± 46.81 62.61 ± 76.74b0.1 nmol/L38.76 ± 38.11 70.12 ± 74.98a89.63 ± 88.00a1 nmol/L33.75 ± 39.1152.38 ± 57.73 61.59 ± 77.90b10 nmol/L18.95 ± 21.71 38.33 ± 53.78b45.96 ± 67.60b
讨 论
Neuro-2a细胞株,又称小鼠神经母细胞瘤细胞株,是建立于A型白化小鼠的自发性肿瘤细胞株,具有神经干细胞的特性,因其具有细胞成分均一、无其他细胞干预的特点,故已经替代神经细胞原代培养用于神经突起的实验研究[16]。
BoNT/A导致宿主中毒的机理主要是由于毒素分子可与神经末梢前膜的特异性毒素结合蛋白(受体)结合,通过毒素-受体复合物内吞入胞而发挥其阻断神经递质释放的毒性作用[13,17]。BoNT/A的分子由两条链组成,即HC和LC,二者通过二硫键相互连接。其中HC是毒素的抗原成分,负责识别和结合特定的神经细胞表面受体,而LC则是毒素的酶活性成分,随毒素—受体复合物进入细胞浆,选择性裂解突触前膜上的SNARE蛋白(soluble N-ethylamleimide-sensitive factor attachment protein receptor,SNAP)中分子量为25 kDa的相关蛋白,SNAP-25[18-19],裂解后的SNAP-25丧失了介导突触囊泡膜与细胞膜融合的作用,使神经递质—乙酰胆碱的释放受抑,进而导致神经肌肉麻痹。BoNT/A HC同时包含了两个功能域:C端的受体结合域和N端的介导域。目前已经证实,宿主细胞表面有两种可与BoNT/ A HC结合的成分,一种是BoNT/A HC的高亲和力受体,称为突触囊泡蛋白2(Synaptic vesicle 2,SV2)[8-13],另一种是BoNT/A HC的低亲和力受体,称为神经节苷脂(ganglioside),主要是三涎酸神经节苷脂1b(Trisialoganglioside 1b, GT1b)[14]。GT1b与HC结合可促进SV2在细胞膜的漂移及簇集以加快毒素与受体的结合。然而,Neuro-2a细胞是否具有BoNT/A HC结合的相应蛋白目前尚无报道。本研究结果证实,Neuro-2a细胞含有BoNT/A HC结合的相应膜结合蛋白或受体,可以用于BoNT/A相关体外实验。
已有研究证实BoNT/A全毒素能够促进体外培养的原代运动神经元神经轴突的生长[19],其机理可能是毒素与细胞膜上相应受体结合后激活了细胞内与再生相关的信号通路(譬如PI3K/AKT信号通路以及MAPK/ERK信号通路)从而促进了细胞神经突起的生长,基于HC为BoNT/A与宿主细胞结合的主要分子成分,本实验利用人工重组的HC,运用不同浓度的BoNT/A HC作用Neuro-2a细胞,观察对细胞突起生长的影响,结果显示:BoNT/A HC促进Neuro-2a细胞突起生长的作用随浓度的增加而增强,但当浓度增加至一定程度后发现促进作用减弱甚至出现抑制现象(10 nmol/L),这种低浓度促进而高浓度抑制的现象与毒素反应曲线相符。一定剂量(0.1 nmol/L)的BoNT/A HC作用于培养4 h的Neuro-2a细胞发现HC具有促进细胞突起生成及刺激神经突起增长的作用,结果与以往采用BoNT/A全毒素或灭活轻链的BoNT/A促进神经突起再生的实验结果基本吻合[7]。提示BoNT/A HC有可能促使幼稚细胞向神经细胞的形态分化,即具有促进神经细胞成熟分化的潜能,但需要今后进一步证实。
本研究中发现在正常培养液内生长的Neuro-2a细胞随着培养时间的延长有突起细胞占细胞总数的百分比、有突起细胞的突起总数量以及突起的总长度均有所增加;当培养液内加入不同浓度的BoNT/A HC后,对Neuro-2a细胞神经突起的生长起到了一定的干预作用:当BoNT/A HC的浓度为0.01、0.1 nmol/L时有突起细胞占细胞总数的百分比、有突起细胞的突起总数量以及突起总长度较对照组都明显增加,尤以0.1nmol/L浓度表现明显,但当BoNT/A HC的浓度达到10 nmol/L时,上述指标则较相应对照组减少,产生这种现象的原因是多方面的,譬如:作为药物,BoNT/A HC有可能有一个最佳的剂量范围,超过这个范围效应不再显示,或者相对较高的剂量对细胞的毒性作用较强,又或者商品化的BoNT/A HC溶解在一定的佐剂后可能对细胞具有一定的副作用,随着BoNT/A HC剂量的加大,佐剂的含量也相应增加,从而造成对细胞的损伤,而其具体机制目前尚不清楚,需作进一步的研究证实。
神经系统的损伤在临床上是一种较常见疾病,但对于损伤后神经系统的恢复效果却不尽如人意,故寻找促进损伤后神经系统功能的新药(制剂)日渐成为人们研究的重点,而神经系统功能的恢复除了神经细胞自身的存活和功能正常以外,更重要的是神经轴突的再生情况,包括再生的速度,再生轴突与周围组织的连接情况,以及再生后的神经轴突对相应效应器的支配情况等[19]。因此,本文的研究结果为临床寻找促进神经突起再生的新药(制剂)提供了思路。然而,由于实验的局限性,今后还需就HC促进神经突起再生进行更进一步的研究,譬如:(1)HC促进神经突起再生的细胞内信号通路;(2)加大BoNT/A HC剂量或延长BoNT/A HC用药时间是否对细胞的其它功能代谢产生影响;(3)毒素的这种促再生作用在体内和体外的关联程度如何等都需要在今后的实验中加以探讨。
1 郭若愚, 任圆圆, 朱金土. A型肉毒毒素临床应用研究进展[J]. 世界中西医结合杂志, 2011, 6(4):350-352.
2 代娟丽, 张德仁. A型肉毒毒素与神经病理性疼痛[J].实用疼痛学杂志, 2007, 3(6):455-458.
3 Comella JX, Molgo J, Faille L. Sprouting of mammalian motor nerve terminals induced by in vivo injection of botulinum type-D toxin and the functional recovery of paralyzed neuromuscular junctions[J]. Neurosci Lett, 1993,153(1):61-64.
4 Juzans J, Comella JX, Molgo J, et al. Nerve terminal sprouting in botulinum type-A treated mouse levator auris longus muscle[J]. Neuromuscul Disord, 1996, 6(3):177-185.
5 Foran PG, Davletov B, Meunier FA. Getting muscles moving again after botulinum toxin: novel therapeuti challenges[J]. Trends Mol Med, 2003, 9(7):291-299.
6 Ko CP. Do nerve terminal sprouts contribute to functional recovery from botulinum neurotoxin A[J]. J Physiol, 2008,586(13):3021-3021.
7 Coffield JA, Yan X. Neuritogenic actions of botulinum neurotoxin A on cultured motor neurons[J]. J Pharmacol Exp Therapeu, 2009, 330(1):352-358.
8 Yu YZ, Ma Y, Chen YX, et al. Activity and immunogenic characterization of recombinant C-terminal quarter and half of the heavy chain of botulinum neurotoxin serotyoe A[J]. Human Vaccines, 2011, 7(10):1090-1095.
9 Rummel A, Eichner T, Weil T, et al. Identification of the protein receptor binding site of botulinum neurotoxins B and G proves the double-receptor concept[J]. Proc Natl Acad Sci USA, 2007, 104(1):359-364.
10 Dong M, Yeh F, Tepp WH, et al. SV2 is the protein receptor for botulinum neurotoxin A[J]. Science, 2006, 312(5773):592-596.
11 Lalli G, Herreros J, Osborne SL, et al. Functional characterisation of tetanus and botulinum neurotoxins binding domains[J]. J Cell Sci, 1999, 112(16):2715-2724.
12 Singh BR. Intimate details of the most poisonous poison[J]. Nat Struct Biol, 2000, 7(8):617-619.
13 Benoit1 RM, Frey D, Hilbert M, et al. Structural basis for recognition of synaptic vesicle protein 2C by botulinum neurotoxin A[J]. Nature, 2014, 505(7481):108-111.
14 Rummel A, Mahrhold S, Bigalke H, et al. The Hcc-domain of botulinum neurotoxins A and B exhibits a singular ganglioside binding site displaying serotype specific carbohydrate interaction[J]. Molecular Microbiology, 2004,51(3):631-643.
15 Baldwin MR, Barbieri J. Asscciation of botulinum neurotoxins with synaptic vesicle protein complexes[J]. Toxicon, 2009, 54(5):570-574.
16 马志奎, 赵炜疆. Neuro-2a细胞替代神经元原代培养进行神经轴突测量实验研究[J]. 中国实用神经疾病杂志,2012, 15(10):4-6.
17 Montal M. Botulinum neurotoxin:a marvel of protein design[J]. Annu Rev Biochem, 2010, 79:591-617.
18 Peng L, Tepp WH, Johnson EA, Dong M. Botulinum Neurotoxin D Uses synaptic Vesicle Protein SV2 and Gangliosides as Receptors[J]. PLoS Pathog, 2011, 7(3):e1002008.
19 王然芸, 郭永明, 郭义. 周围神经再生和修复的研究进展[J]. 天津中医药, 2011, 28(3):260-261.
Feasibility of mouse neuroblastoma neuro-2a cells cell line as a model for the study of botulinum neurotoxin serotype-A heavy chain in vitro x
ischemiaQiao Huan2, Li Xiaqing1. 1Department of Pathophysiology, Shanxi Medical University, Taiyuan 030001, China;2Department of orthopedics, the Central Hospital of Linfen, Linfen 041000,China
Li Xiaqing, Email:xqli2013@126.com
Objective To investigate the feasibility of neuro-2a cell line for evaluation of bioactivity of botulinum neurotoxin serotype-A heavy chain (BoNT/A HC). Methods The expression levels of synaptic vesicle 2 (SV2) and trisialoganglioside 1b (GT1b)that were two essential membranous components of BoNT/A HC receptors were detected by immunofluorescence on the Neuro-2a cells. Cells were treated by DMEM-HG mediumwith or without BoNT/A HC (which were divided into control group, 0.01 nmol/L group, 0.1 nmol/L group, 1 nmol/L group and 10nmol/L group in 96-well culture plates) for 24, 48, or 72 hours respectively. The percentage of cells with neurites, the average number of neurites and the average length of neurites after BoNT/A -HC treatment were measured. All the data were analyzed by GraphPad Prism 5.0 One-way ANOVA.Results SV2 and GT1b proteins were expressed in Neuro-2a cells. BoNT/A HC at low dosage (0.1 nmol/L) could promote the generation and growth of neurites of Neuro-2a cells under DMEM-HG medium for 24 hours. The percentage of cells with neurites [(20.61 ± 4.87)%&(15.27 ± 3.56)%, P < 0.001],F = 37.7); the total number of neurites (2.18 ± 1.24 &1.68 ± 0.99, P < 0.001, F = 9.54), and the average length of neurites [(38.76 ± 38.11)μm& (23.38 ± 27.13)μm] were significantly different(P < 0.05) compared with controls. Longer treatment time (48 and 72 hours) further increased the percentage of cells with neurites, the total number of neurites or the average length of neurites. However, BoNT/A HC at high dosages (1 nmol/L and 10 nmol/L) was ineffective(P > 0.05). Conclusion Neuro-2a cells could be used as acell model for BoNT/A HC study in vitro, and BoNT/A HC at low dosage (0.1 nmol/L) was most effective in promoting neurite production.
Botulinum toxins; synapsins; gangliosides
2015-08-11)
(本文编辑:陈媛媛)
10.3877/cma.j.issn.2095-1221.2015.04.004
国家自然科学基金面上项目(81171178);山西省自然科学基金项目(2012011036-3);山西省留学人员科研资助项目(2012-047)
030001 太原,山西医科大学病理学与病理生理学教研室1;041000 临汾,临汾市中心医院骨科2
李夏青,Email:xqli2013@126.com
