人肿瘤坏死因子相关凋亡诱导配体稳定过表达基因工程修饰人脐带间充质干细胞亚细胞系的建立
2015-10-27林榕左伟敏祝玲王瑾路君黄梁浒王庆华谭建明王水良
林榕 左伟敏 祝玲 王瑾 路君 黄梁浒 王庆华 谭建明 王水良
·论著·
人肿瘤坏死因子相关凋亡诱导配体稳定过表达基因工程修饰人脐带间充质干细胞亚细胞系的建立
林榕 左伟敏 祝玲 王瑾 路君 黄梁浒 王庆华 谭建明 王水良
目的 通过基因工程修饰法建立肿瘤坏死因子相关凋亡诱导配体(TRAIL)稳定过表达的人脐带间充质干细胞亚系(hUC-MSC_TRAIL)。方法 人TRAIL全长蛋白编码序列(CDS)由PCR法扩增而得,PCR产物经NotⅠ和MluⅠ双酶切并纯化后,亚克隆至经同样双酶切的慢病毒表达载体pLEX-MCS。重组载体经PCR法和限制性内切酶酶切法鉴定,再行DNA直接测序验证后命名为人TRAIL表达慢病毒载体pLEX-hTRAIL。pLEX-hTRAIL与相应包装质粒psPAX2和pMD2.G经聚乙烯亚胺介导共转染HEK293T细胞以包装慢病毒。P4代hUC-MSC经慢病毒感染24 h,再行嘌呤霉素筛选2周后,抽提细胞基因组DNA,行PCR法鉴定hTRAIL cDNA在hUC-MSC基因组中的整合情况;同时抽提细胞总RNA,并行RT-PCR法检测外源hTRAIL在hUC-MSC中的mRNA表达水平,以及实时定量RT-PCR法检测周期调控相关蛋白Cyclin D1、Cyclin E1、p21WAF1/CIP1和p27的表达,采用方差分析和t检验进行统计学分析。结果 PCR法和限制性内切酶酶切法鉴定结果表明,本研究已成功构建人TRAIL慢病毒表达载体pLEX-hTRAIL,直接DNA测序结果证实克隆得到的人TRAIL蛋白编码序列准确无误;病毒包装及细胞感染的鉴定结果说明,慢病毒感染法可成功介导外源人TRAIL在hUC-MSC的稳定整合和高表达;实时定量RT-PCR法检测结果则显示,与对照慢病毒感染后的细胞相比,hTRAIL表达慢病毒感染后其细胞周期调控相关蛋白Cyclin D1、Cyclin E1、p21WAF1/CIP1和p27的mRNA表达水平分别是对照组的1.19倍(P = 0.141)、0.94倍(P = 0.745)、0.95倍(P = 0.047)和1.01倍(P = 0.567),表明外源TRAIL高表达对体外培养的hUC-MSC生长增殖等表型无显著影响。结论 本研究经基因工程修饰法成功构建了具外源TRAIL稳定高表达的hUC-MSC亚细胞系,该亚细胞系的建立为后续靶向攻击TRAIL敏感肿瘤细胞的细胞治疗的探索奠定了基础。
基因修饰; 脐带; 间质干细胞; TRAIL; 细胞系,肿瘤
间充质干细胞(mesenchymal stem cell, MSC)因其高度自我更新和增殖能力、以及多向分化潜能而在退行性疾病以及老年相关性疾病的细胞治疗中得以广泛应用[1]。众多研究早已表明,MSC也能靶向迁移至肿瘤组织,从而成为肿瘤微环境中重要的组成成分[2-3]。迄今,尽管MSC在肿瘤发生发展过程中的确切作用尚存争论,可能因肿瘤的组织类型和发生发展阶段的不同而各异,但其富集至肿瘤组织这一特性使其成为向肿瘤靶向运送特异性抗癌活性分子的合适载体细胞而备受关注[4-7]。
肿瘤坏死因子相关凋亡诱导配体(tumor necrosis factor-related apoptosis-inducing ligand,TRAIL)可通过与细胞表面的跨膜死亡受体DR4和DR5结合而特异诱导特定肿瘤细胞的凋亡,TRAIL触发的凋亡通路中关键分子也因而成为肿瘤靶向治疗中良好的候选靶标,基于这些靶标的诸多肿瘤靶向治疗策略如重组TRAIL或DR激动性抗体的导入在体外细胞水平、临床前动物水平、以及一些临床试验中都显示出较好的抗肿瘤效应[8-9]。鉴于重组TRAIL在血清中的半衰期短,这在较大程度上限制了其临床抗肿瘤的疗效[10]。为探索人脐带间充质干细胞(human umbilical cord mesenchymal stem cell, hUC-MSC)是否可作为向肿瘤靶向递送TRAIL的载体细胞,本研究中经基因工程修饰法成功构建了具外源TRAIL稳定高表达的hUC-MSC亚细胞系,该亚细胞系的建立为后续靶向攻击TRAIL敏感肿瘤细胞的细胞治疗的探索奠定了基础。
材料与方法
一、材料
1.细胞和质粒:hUC-MSC来源于福州总医院泌尿外科实验室干细胞组,取P4代细胞。人胚肾上皮细胞系HEK293T购自美国典型培养物保藏中心(ATCC)。慢病毒表达载体pLEX-MCS购自美国Open Biosystem公司,慢病毒包装质粒psPAX2 和pMD2.G购自美国Addgene公司。
2.酶和试剂:PCR试剂盒及DNA marker购自日本TaKaRa公司;PCR引物由上海生工生物工程公司合成(序列见表1);PhusionTM高保真DNA聚合酶、限制性内切酶NotⅠ和MluⅠ、快速连接试剂盒为New England BioLabs公司产品;胎牛血清、DMEM/F12培养基、低糖DMEM购自美国Hyclone公司;Polybrene和聚乙烯亚胺(PEI)购自美国Sigama公司;嘌呤霉素购自ACROS公司;MTS和PMS购自美国Promega公司;TRIzol购自美国Life technolgies公司;逆转录试剂盒购自美国Fermentas公司;质粒小提试剂盒和基因组DNA抽提试剂盒购自美国TIANGEN公司;SYBR和质粒大提试剂盒购自美国ROCHE公司。
二、方法
1.细胞培养:人胚肾上皮细胞系HEK293T的培养使用含10%胎牛血清的DMEM/F12;hUC-MSC的培养使用含10%胎牛血清的低糖DMEM培养基,置于含5% CO2饱和湿度的37℃温箱中。
2.人TRAIL慢病毒表达载体pLEX-hTRAIL的构建:常规抽提hUC-MSC总RNA,并经逆转录为总cDNAs,再以其为模板利用PhusionTM高保真DNA聚合酶通过常规的两轮PCR法扩增得到人TRAIL的完整编码区(hTRAIL-CDS),所用引物为:上游5'-ATAGCGGCCGCATGGCTAT GATGGAGGTCCA-3';下游5'-GCG ACGCGTTT AGCCAACTAAAAAGGCCCCA-3';上下游引物分别含NotⅠ和MluⅠ酶切位点(粗斜体下划线所示),PCR扩增片段为866 bp。PCR产物纯化后经NotⅠ和MluⅠ双酶切,重新胶回收纯化并与同样经NotⅠ和MluⅠ双酶切的慢病毒表达载体pLEX-MCS连接构建成人TRAIL慢病毒表达载体pLEX-hTRAIL(质粒构建流程见图1)。重组载体经酶切和PCR法鉴定后再行测序(上海生工生物工程公司)以证实,正确的重组质粒经大量扩增后-20℃保存待用。人TRAIL慢病毒表达载体pLEX-hTRAIL的构建流程见图1所示。

图1 人hTRAIL 慢病毒表达载体pLEX-hTRAIL 的构建流程

表1 RT-PCR扩增引物序列、扩增片段及退火温度
3.慢病毒的包装:正常培养的HEK293T细胞传入100 mm培养皿后,待细胞长至80%汇合度时,以聚乙烯亚胺(PEI)为介导,将pLEX-hTRAIL(或空载体pLEX-MCS)连同两个包装质粒psPAX2和pMD2.G行共转染;转染12 h后吸去转染液,换正常培养基并置回温箱培养,每隔24 h后收集含慢病毒的培养液,经过滤(0.45 μm滤器)后分装,-80℃保存待用。
4.慢病毒的感染:正常培养的P4代hUCMSC接种至100 mm培养皿,待细胞长至80%汇合度时吸去培养基,将适量慢病毒稀释入含Polybrene(终浓度8 μg/ml)的常规培养基后加至培养皿中。感染24 h后,弃去感染液,换含嘌呤霉素(终浓度1 μg/ml)的新鲜培养基筛选;此后细胞正常传代培养,并维持嘌呤霉素筛选两周。
5.外源hTRAIL-CDS在hUC-MSC基因组整合的鉴定:常规法抽提细胞基因组DNA,行PCR法鉴定外源hTRAIL-CDS在hUC-MSC基因组中的整合情况,所用引物为人TRAIL表达鉴定的RT-PCR引物(表1),PCR体系同后述常规PCR扩增体系。
6.RT-PCR:依TRIzol法抽提培养细胞的总RNA;取各样本2 μg总RNA,经逆转录制备cDNA。以β-actin为内参,行常规及实时定量RT-PCR法分析TRAIL、Cyclin D1、Cyclin E1、p21和p27基因mRNA在对照和TRAIL表达慢病毒感染后hUC-MSC中的表达情况。各基因RT-PCR扩增引物及PCR退火温度见表1,常规PCR扩增体系含:2.5 μl 10 × buffer、上下游引物各100 pmol、1.5 μl dNTP(2.5 mmol/L each)、Taq酶1.25 U、cDNA 1 μl,ddH2O补足至25 μl。PCR反应条件,94℃预变性3 min;94℃变性30 s,特定温度退火30 s,72℃延伸30 s的条件下循环30次;最后72℃延伸5 min。PCR产物1.5%琼脂糖凝胶电泳鉴定,凝胶成像仪成像。实时定量RT-PCR反应体系为:10 μl 2 × SYBR混合物、上下游引物各100 pmol、cDNA 1 μl,ddH2O补足至20 μl;PCR循环条件同上,反应于ABI 7900HT Fast PCR仪上完成。基因表达的相对定量方法为:以β-actin基因mRNA的表达为内对照,首先依据公式ΔCt = Ct靶基因- Ct β-actin,分别计算实验组和对照组的ΔCt;再依公式ΔΔCt = ΔCt实验组-ΔCt对照组计算出ΔΔCt值;最后计算相对表达量的差值即2-ΔΔCt。
三、统计学分析方法
采用SPSS 13.0统计软件进行统计学处理,实时定量RT-PCR实验重复3次,每次做3个重复孔,取各次实验的±s为最后结果,并以t检验行差异显著性分析。以P < 0.05为差异有统计学意义。
结 果
一、人TRAIL蛋白编码序列全长的获得
鉴于hUC-MSC中TRAIL呈低表达,故本研究采取同样引物行两轮PCR扩增法以获得足够量的hTRAIL-CDS,即第一轮PCR以hUCMSC的总cDNAs为模板,第二轮PCR以第一轮PCR的产物经1:100稀释后作模板再行扩增。人TRAIL蛋白编码序列全长共846 bp,上、下游扩增引物另含酶切位点及保护碱基20 bp,故PCR扩增产物总大小为866 bp,如图2所示,二轮PCR产物与预期相符,且产物量丰富。

图2 人hTRAIL 蛋白编码区CDS 的PCR 扩增结果
二、重组人TRAIL慢病毒表达载体pLEX-hTRAIL的鉴定
重组慢病毒表达载体pLEX-hTRAIL初步以酶切和PCR法鉴定。依酶切图谱分析,正确的重组载体经NotⅠ单酶切后线性化,大小为11 528 bp(图3a泳道1);而经NotⅠ和MluⅠ双酶切后应可见一大小为846 bp的小片段即人TRAIL蛋白编码序列,另一大片段为骨架质粒10 682 bp(图3a泳道2)。同时,PCR法也证实重组载体含人TRAIL完整编码区(图3b);重组质粒还经直接测序,并与GenBank中的参考序列(NCBI序列号:NM_003810)比对后,证实重组载体中的hTRAIL-CDS序列准确无误(结果未显示)。
三、外源hTRAIL-CDS在hUC-MSC基因组中整合及稳定表达
hUC-MSC经对照或hTRAIL表达慢病毒感染并筛选两周后,抽提基因组DNA并行PCR法鉴定,结果表明:外源hTRAIL-CDS已整合入经hTRAIL表达慢病毒感染的hUC-MSC基因组中(图4)。同时,普通以及实时定量RT-PCR鉴定结果也证实,外源hTRAIL在hUC-MSC中得以成功高表达(表2,图5)。

图3 重组人TRAIL 慢病毒表达载体pLEXhTRAIL的鉴定
四、外源人TRAIL过表达对体外培养hUCMSC生长增殖调控相关蛋白的表达无显著影响
经初步观察,与对照病毒感染的hUCMSC_CV相比,TRAIL过表达hUC-MSC_TRAIL其形态以及细胞生长增殖速率并无明显改变。普通和实时定量RT-PCR法检测结果则显示,与对照慢病毒感染相比,TRAIL过表达hUCMSC_TRAIL细胞周期调控相关蛋白Cyclin D1、Cyclin E1、p21WAF1/CIP1和p27 mRNA表达水平分别是对照组的1.19倍(P = 0.141)、0.94倍(P = 0.745)、0.95倍(P = 0.047)和1.01倍(P = 0.567)(表2,图6,7)。依实时定量RT-PCR结果的判定标准,通常认为相对表达倍数> 2或< 0.25为差异具有统计学意义;据此,RT-PCR分析结果表明外源TRAIL高表达对体外培养的hUC-MSC生长增殖等表型无显著影响。

表2 hUC-MSC细胞TRAIL及细胞周期调控相关蛋白mRNA表达水平的实时定量RT-PCR结果

图4 外源hTRAIL-CDS 在hUC-MSC 基因组中整合的鉴定

图5 外源hTRAIL 在hUC-MSC 中表达的RT-PCR 鉴定
讨 论
细胞治疗作为一种新的治疗手段,迄今已在包括肿瘤在内的多种疾病中得以广为应用[1,11]。在细胞的选择中,MSC作为成体干细胞的一种,因其自我更新和增殖能力强、并具多向分化潜能和体内输注后定向迁移至受损伤或肿瘤部位等特点而成为细胞治疗良好的候选细胞[12]。依其来源不同,MSC有骨髓MSC、脂肪MSC和UCMSC之分;其中UC-MSC以其低免疫原性和来源丰富而成为众多临床细胞治疗的首选[13]。
随着肿瘤细胞和分子生物学研究的不断深入,MSC在肿瘤发生发展过程中的作用日益凸显;但在不同肿瘤以及同一肿瘤发生发展的不同阶段,MSC所起的作用却大相径庭,其作用机理也各异。例如,Zhu等[14]曾报道人MSC可通过分泌DKK-1而抑制肿瘤细胞的增殖;但同时,诸多研究也证实MSC有助于肿瘤细胞逃避化疗药物所诱导的凋亡以及促进肿瘤转移,从而发挥促进肿瘤发展的“助纣为虐”性作用[15-17]。鉴于此,在充分阐明MSC在某一特定肿瘤发生发展的特定阶段所起作用的确切分子机理的基础上,如何通过药物(或生物活性分子)处理和/或基因工程修饰等手段,以期“趋利避害”,将MSC最终改造成为能靶向攻击特定肿瘤的载体细胞,这对其临床疗效的取得将至关重要。

图6 TRAIL 过表达hUC-MSC 细胞周期调控相关蛋白mRNA 表达水平RT-PCR 分析结果
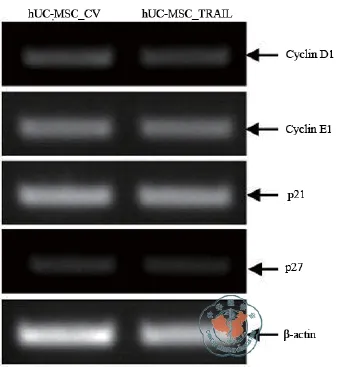
图7 普通RT-PCR 的琼脂糖凝胶电泳结果
在通过基因工程修饰定向改造肿瘤靶向MSC的探索中,较早纳入研究的有包括NK4[5]和CX3CL1[7]等多种基因;近年来,TRAIL则因其高效介导多种肿瘤细胞的凋亡效应而备受关注[8-10]。2012年,Lee等[18]的研究发现,通过TNF-α预处理的MSC其TRAIL的表达显著增高,并可高效诱导MDA-MB-231等TRAIL敏感肿瘤细胞的凋亡。鉴于经预处理的MSC其TRAIL的高表达仍为瞬时效应,细胞输注至体内后其TRAIL的高表达及其抗癌活性所维系的时间也势必有限。在本研究中,基于前期工作基础[19],为建立TRAIL稳定高表达hUC-MSC亚系,本研究首先经分子克隆法成功地构建了人TRAI表达慢病毒载体pLEX-hTRAIL;随之,通过慢病毒包装及细胞感染和鉴定,结果表明慢病毒感染法可成功介导外源人TRAIL在hUC-MSC的稳定整合和高表达。同时,初步的表型观察表明,TRAIL过表达并不会造成体外培养的hUC-MSC形态的明显改变;细胞周期调控相关蛋白表达的分析结果则显示,与对照慢病毒感染后的细胞相比,hTRAIL表达慢病毒感染后其Cyclin D1、Cyclin E1、p21WAF1/CIP1和p27的mRNA表达水平与对照组无显著差别,表明外源TRAIL高表达对体外培养的hUC-MSC生长增殖等表型无明显的影响。
综上,尽管其体外和体内抗肿瘤的效应性仍有待进一步的研究证实,但本研究建立的外源TRAIL稳定高表达的hUC-MSC亚细胞系无疑为后续靶向攻击TRAIL敏感肿瘤细胞的细胞治疗的探索奠定了基础。诚然,随着MSC靶向迁移至肿瘤部位分子机理的深入阐明[20-21],如何通过基因工程修饰等方法进一步修饰TRAIL高表达MSC,以期实现其体内输注后更加高效地富集至肿瘤部位以发挥其抗癌效应将是下一步努力的方向。
1 Wang J, Liao L, Wang S, et al. Cell therapy with autologous mesenchymal stem cells—how the disease process impacts clinical considerations[J]. Cytotherapy, 2013,15(8):893-904.
2 Reagan MR, Kaplan DL. Concise review. Mesenchymal stem cell tumor homing: detection methods in disease model systems[J]. Stem Cells, 2011, 29(6):920-927.
3 Goldstein RH, Reagan MR, Anderson K, et al. Human bone marrow-derived MSCs can home to orthotopic breast cancer tumors and promote bone metastasis[J]. Cancer Res,2010, 70(24):10044-10050.
4 Studeny M, Marini FC, Dembinski JL, et al. Mesenchymal stem cells: potential precursors for tumor stroma and targeted-delivery vehicles for anticancer agents[J]. J Natl Cancer Inst, 2004, 96(21):1593-1603.
5 Kanehira M, Xin H, Hoshino K, et al. Targeted delivery of NK4 to multiple lung tumors by bone marrow-derived mesenchymal stem cells[J]. Cancer Gene Ther, 2007,14(11): 894-903.
6 Kucerova L, Altanerova V, Matuskova M, et al. Adipose tissue-derived human mesenchymal stem cells mediated prodrug cancer gene therapy[J]. Cancer Res, 2007, 67(13):6304-6313.
7 Xin H, Kanehira M, Mizuguchi H, et al. Targeted delivery of CX3CL1 to multiple lung tumors by mesenchymal stem cells[J]. Stem Cells, 2007, 25(7):1618-1626.
8 Ashkenazi A. Targeting the extrinsic apoptosis pathway in cancer[J]. Cytokine Growth Factor Rev, 2008,19(3-4):325-331.
9 Johnstone RW, Frew AJ, Smyth MJ. The TRAIL apoptotic pathway in cancer onset, progression and therapy[J]. Nat Rev Cancer, 2008, 8(10):782-798.
10 Kelley SK, Harris LA, Xie D, et al. Preclinical studies to predict the disposition of Apo2L/tumor necrosis factor-related apoptosis-inducing ligand in humans: characterization of in vivo effi cacy, pharmacokinetics, and safety[J]. J Pharmacol Exp Ther, 2001, 299(1):31-38.
11 Ramdasi S, Sarang S, Viswanathan C. Potential of Mesenchymal Stem Cell based application in Cancer[J]. Int J Hematol Oncol Stem Cell Res, 2015, 9(2):95-103.
12 Chen JR, Cheng CC. Sheu GF, et al. Transplanted bone marrow stromal cells migrate, differentiate and improve motor function in rats with experimentally induced cerebral stroke[J]. J Anat, 2008, 213(3):249-258.
13 Romanov YA, Svintsitskaya VA, Smirnov VN. Searching for alternative sources of postnatal human mesenchymal stem cells:candidate MSC-like cells from umbilical cord[J]. Stem Cells, 2003, 21(1):105-108.
14 Zhu Y, Sun Z, Han Q, et al. Human mesenchymal stem cells inhibit cancer cell proliferation by secreting DKK-1[J]. Leukemia, 2009, 23(5):925-933.
15 Kurtova AV, Balakrishnan K, Chen R, et al. Diverse marrow stromal cells protect CLL cells from spontaneous and drug-induced apoptosis: development of a reliable and reproducible system to assess stromal cell adhesion-mediated drug resistance[J]. Blood, 2009,114(20):4441-4450.
16 Patel SA, Meyer JR, Greco SJ, et al. Mesenchymal stem cells protect breast cancer cells through regulatory T cells:role of mesenchymal stem cell-derived TGF-beta[J]. J Immunol, 2010, 184(10):5885-5894.
17 Karnoub AE, Dash AB, Vo AP, et al. Mesenchymal stem cells within tumour stroma promote breast cancer metastasis[J]. Nature, 2007, 449(7162):557-563.
18 Lee RH, Yoon N, Reneau JC, et al. Preactivation of human MSCs with TNF-α enhances tumor-suppressive activity[J]. Cell Stem Cell, 2012, 11(6):825-835.
19 林凤锦, 王水良, 黄粱浒, 等.慢病毒载体系统介导hUC-MSC绿荧光蛋白和荧光素酶共表达技术体系的建立[J/CD].中华细胞与干细胞杂志:电子版,2013,3(3):118-125.
20 Ho IA, Yulyana Y, Sia KC, et al. Matrix metalloproteinase-1-mediated mesenchymal stem cell tumor tropism is dependent on crosstalk with stromal derived growth factor 1/C-X-C chemokine receptor 4 axis[J]. FASEB J, 2014,28(10):4359-4368.
21 Lourenco S, Teixeira VH, Kalber T, et al. Macrophage migration inhibitory factor-CXCR4 is the dominant chemotactic axis in human mesenchymal stem cell recruitment to tumors[J]. J Immunol, 2015,194(7):3463-3474.
Genetically engineered human umbilical cord mesenchymal stem cells with stable overexpression of human tumor necrosis factor-related apoptosis-inducing ligand
Lin Rong,Zuo Weimin, Zhu Ling, Wang Jin, Lu Jun, Huang Lianghu, Wang Qinghua, Tan Jianming, Wang Shuiliang. Fujian Key Laboratory of Transplant Biology, Fuzhou General Hospital, Xiamen University, Fuzhou 350025, China
Wang Shuiliang, Email: shuiliang.wang@xmu.edu.cn
Objective To establish genetically engineered human umbilical cord mesenchymal stem cells (hUC-MSC) with overexpression of hTRAIL for cancer therapy. Methods The entire coding sequence (CDS) of human tumor necrosis factor (TNF)-related apoptosis-inducing ligand (TRAIL) was amplified from cDNAs of hUC-MSC cells. Theamplified fragments were purified and digested with Not I and Mlu I, and then inserted into the lentiviral expression vector LentiORF pLEX-MCS. The recombinant was identified with both PCR and restriction digestion. After verification by DNA sequencing, the recombinant (with accurate sequence of hTRAIL CDS) was nominated as pLEX-hTRAIL. The lentiviral expression vector pLEX-hTRAIL and lentivirus packaging plasmids psPAX2 and pMD2.G were cotransfected into virus packaging cell line HEK293T using PEI to produce lentiviruses. Human umbilical cord mesenchymal stem cells were infected with hTRAIL-expressing lentiviruses and then subjected to selection with puromycin. The integration of exogenous hTRAIL cDNA into the genome of hUC-MSCs was detected with PCR and overexpression of hTRAIL was analyzed with both regular and real-time qRT-PCR. Also, the same method was carried out to analyze the mRNA expression of cell cycle regulators Cyclin D1, Cyclin E1, p21WAF1/CIP1 and p27. Analysis of variance and t test was used for statistical analysis. Results The recombinant pLEX-hTRAIL with insert of human TRAIL cDNA was verified by PCR, restriction digestion,as well as direct DNA sequencing. After infection, the integration of exogenous hTRAIL cDNA in the genome of hUC-MSC was shown by PCR and the successful expression of exogenous hTRAIL in hUC-MSC was confirmed by both regular and real-time quantification RTPCR. In addition, the real-time RT-PCR results indicated that the lentiviral system mediated overexpression of exogenous hTRAIL in hUC-MSC did not cause any significant change of expression of cell cycle regulators Cyclin D1 (1.19 fold, P = 0.141), Cyclin E1 (0.94 fold,P = 0.745), p21WAF1/CIP1(0.95 fold, P = 0.047), and p27 (1.01 fold, P = 0.567) as compared with those of control viral infection. Conclusion We reported here an establishment of genetically engineered human umbilical cord mesenchymal stem cells with overexpression of hTRAIL. Its anti-cancer therapeutic potential in vitro and in vivo is awaiting further investigation.
Genetically modified; umbilical cord; mesenchymal stem cell; TRAIL; cell Line, tumor
2015-07-08)
(本文编辑:蔡晓珍)
10.3877/cma.j.issn.2095-1221.2015.04.002
国家自然科学基金面上项目(81272922);福建省科技计划重大专项专题项目(2012YZ0001-1)
350025福州,南京军区福州总医院厦门大学附属东方医院福建省移植生物学重点实验室
王水良,Email: shuiliang.wang@xmu.edu.cn
