脱氢表雄酮用于卵巢储备功能低下59例效果研究
2015-10-26李海霞
李海霞
(河北省丰宁满族自治县妇幼保健院,河北丰宁068350)
脱氢表雄酮用于卵巢储备功能低下59例效果研究
李海霞
(河北省丰宁满族自治县妇幼保健院,河北丰宁068350)
目的观察人工周期促排卵疗法联合脱氢表雄酮(DHEA)治疗卵巢储备功能低下(DOR)不孕症的临床疗效。方法选取医院产科收治的121例DOR不孕症患者,随机分为治疗组59例和对照组62例。对照组患者给予乙烯雌酚联合安宫黄体酮人工周期促排卵疗法,连续治疗3个月经周期;治疗组患者在上述基础上加服DHEA片,每日3次,每次25mg,疗程为3个月。治疗前后监测患者激素水平与窦卵泡计数(AFC),治疗结束后随访3个月,观察受孕率。结果治疗3个周期后,两组患者雌二醇(E2)、促卵泡激素(FSH)水平较治疗前显著降低(P<0.05),且治疗组显著低于对照组(P<0.05);两组子宫内膜厚度、双侧卵巢AFC均较治疗前显著改善(P< 0.05),且治疗组改善幅度更明显(P<0.05);两组胃部不适、乳房胀痛发生率比较,无明显差异(P>0.05);随访3个月内,治疗组妊娠率为25.42%,与对照组的12.90%比较,无显著性差异(P>0.05)。结论DOR不孕症患者在人工周期疗法基础上联合口服DHEA能明显降低FSH水平,改善卵巢功能储备,有一定助孕功效,且未见明显不良反应,安全性高。
卵巢储备功能低下;脱氢表雄酮;人工周期;卵泡刺激素;妊娠;窦卵泡数
卵巢储备功能低下(DOR)是指卵巢内存留卵泡数量和质量的下降导致生育能力减弱,可引发排卵困难、妊娠率降低,近年来已成为不孕症治疗的难点。目前,临床多采取人工周期疗法促排卵治疗。脱氢表雄酮(DHEA)在肾上腺网状带合成,是具有弱雄激素作用的甾体物质,在外周组织主要转化成睾酮(T)和雌二醇(E2)。补充DHEA能有效提高卵巢储备功能与反应性,改善促排卵效果[1]。笔者观察了DHEA与人工周期疗法结合治疗DOR致不孕症的临床疗效,现报道如下。
1 资料与方法
1.1一般资料
选择我院妇产科2012年4月至2014年10月收治的DOR患者121例,诊断依据《中华妇产科学》[2]中相关标准诊断。纳入标准:年龄不超过40岁;正常性生活3年以上未孕;卵巢功能储备不足(>10 U/L)月经周期第3天促卵泡激素(FSH)≤40 U/L;彩超显示双侧卵巢基础窦卵泡数(AFC)≤5。排除标准:子宫内膜病;高催乳素血症;单侧卵巢、多囊卵巢综合征或右卵巢手术史;免疫性因素、外生殖器及子宫因素、配偶精液异常导致的不孕症;近3个月内有激素治疗史;盆腔结核、肾上腺肿瘤或雄激素分泌性肿瘤。121例患者年龄26~37岁,不孕年限3~7年,月经初潮平均年龄(13.3±1.9)岁。按随机数字表法分为治疗组59例和对照组62例。两组患者一般资料比较,差异无统计学意义(P> 0.05),具有可比性,见表1。
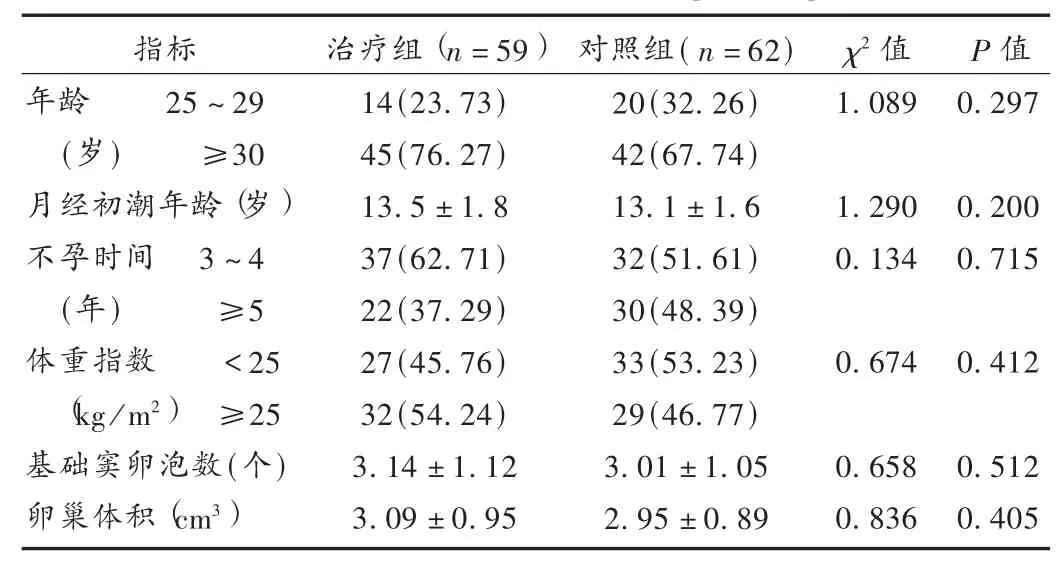
表1 两组患者一般资料比较[例(%)]
1.2方法
对照组患者采用人工周期疗法,口服乙烯雌酚(合肥久联制药有限公司,国药准字H24021250,规格为每片0.5mg),每天1次,每次1.0mg,晚餐后0.5 h服用,连续服用21 d;每个月经周期最后10 d每晚睡前加服安宫黄体酮片(浙江仙琚制药股份有限公司,国药准字H33020715,规格为每片2mg),每天1次,每次10mg;停药后来月经,从月经第5天开始重复使用上述药物,若未来月经,停药7 d后重复使用上述药物,3个周期为1个疗程。治疗组患者在对照组基础上每日加服DHEA片(美国进口PP普瑞森DHEA青春素,规格为每片25mg),连续治疗3个月。
1.3观察指标
治疗前后监测患者激素水平与AFC,比较两组患者治疗3个周期后卵巢储备功能的改善情况及受孕率。治疗前与治疗后当月月经第2~4天采空腹静脉血,采用罗氏E170型电化学发光全自动免疫分析仪及罗氏公司配套试剂盒检测黄体生成素(LH)、FSH及E2水平(电化学发光法);复查阴道彩超,记录卵巢体积、子宫内膜厚度、双侧卵巢AFC(OVF)。
1.4统计学处理
采用SPSS 19.0统计软件分析。定量数据比较采用两独立样本u检验,定性数据比较采用χ2检验或fisher精确概率法。P< 0.05为差异有统计学意义。
2 结果
结果见表2至表4。
3 讨论
DOR可导致女性性激素缺乏及生育能力减弱[3]。在女性卵巢功能评价中,FSH值是评估卵巢反应性的最重要指标,可准确预测卵母细胞质量;OVF是成熟卵泡的前体,是公认的评价卵巢功能的重要预测指标[4]。目前对DOR尚无特效疗法,临床主要通过雌激素和孕激素结合的人工周期激素替代疗法来维持卵巢功能与女性第二性征。人工激素周期替代疗法通常以28~30 d为1个治疗周期,前21~23 d服用雌激素,后10 d服用孕激素,主要是通过口服外源性雌激素来降低血清中FSH水平,解除高高促性腺激素对卵泡促性腺激素受体的降调节作用,使卵巢中少数残存卵泡恢复对内源性FSH的敏感性,而引起卵泡发育和排卵[5]。人工周期疗法有迅速降低FSH水平,提高卵巢功能储备的优点,但长期服用外源性激素尤其是雌激素有诱发子宫内膜癌、乳腺癌、心血管疾病、糖尿病等的风险[6]。
表2 两组患者激素水平比较(±s)
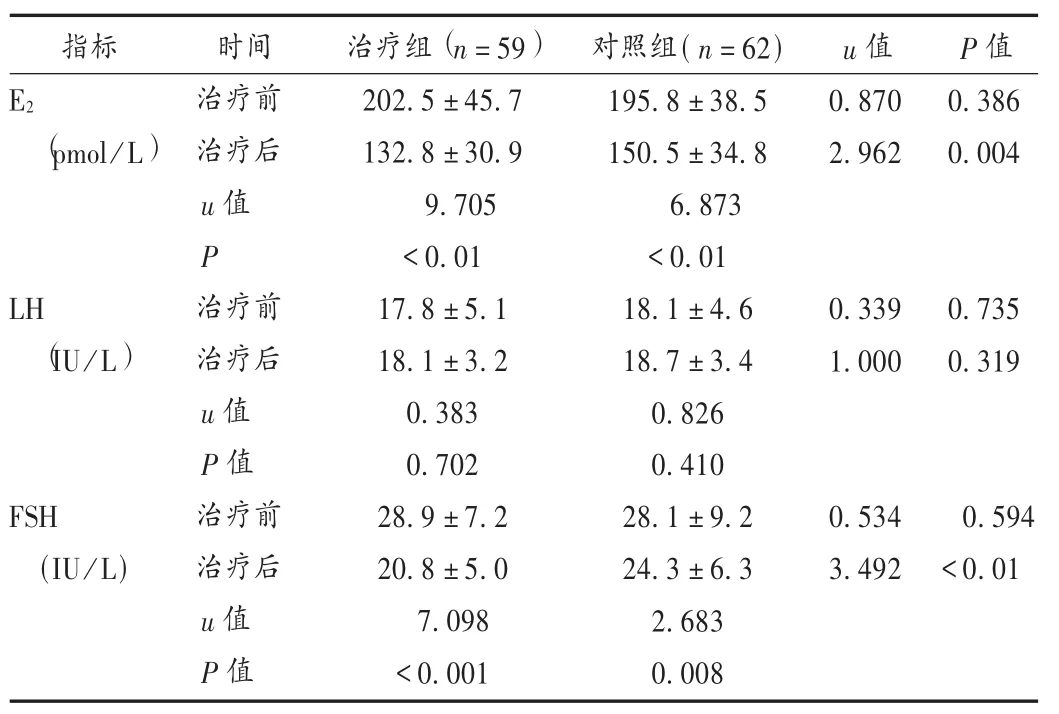
表2 两组患者激素水平比较(±s)
指标u值P值E2(pmol/L)0.870 2.962 0.386 0.004 LH(IU/L)0.339 1.000 0.735 0.319 FSH(IU/L)时间治疗前治疗后u值P治疗前治疗后u值P值治疗前治疗后u值P值治疗组(n=59)202.5±45.7 132.8±30.9 9.705 <0.01 17.8±5.1 18.1±3.2 0.383 0.702 28.9±7.2 20.8±5.0 7.098 <0.001对照组(n=62)195.8±38.5 150.5±34.8 6.873 <0.01 18.1±4.6 18.7±3.4 0.826 0.410 28.1±9.2 24.3±6.3 2.683 0.008 0.534 3.492 0.594 <0.01
表3 两组患者卵巢储备功能比较(±s)
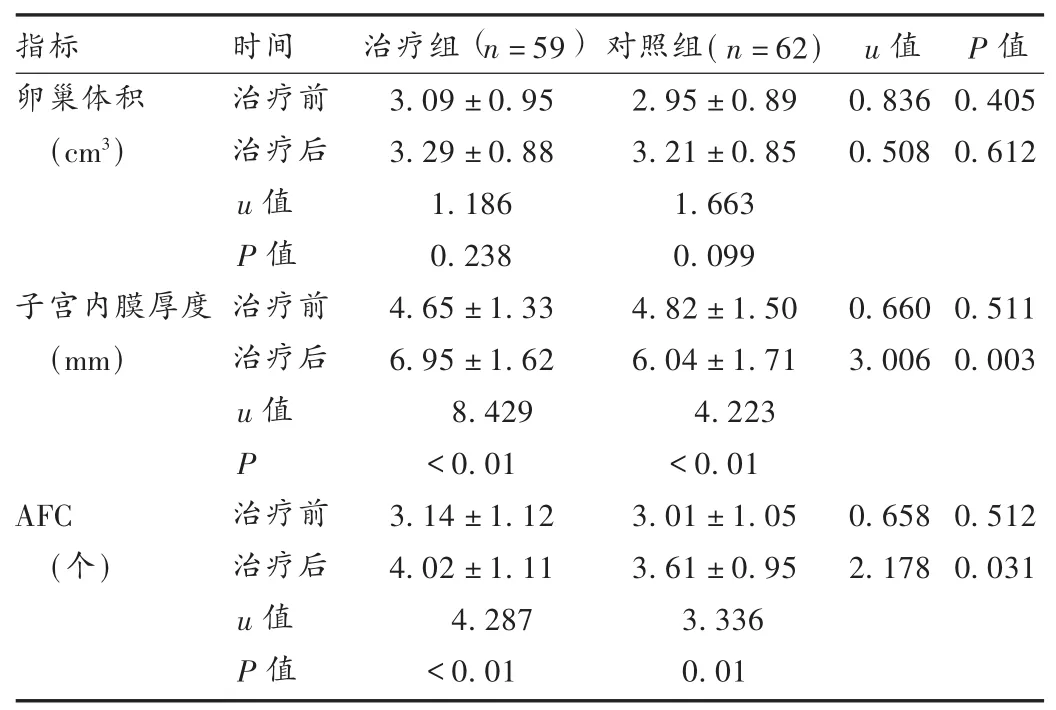
表3 两组患者卵巢储备功能比较(±s)
指标卵巢体积(cm3)u值P值0.405 0.612治疗组(n=59)3.09±0.95 3.29±0.88 1.186 0.238 4.65±1.33 6.95±1.62 8.429 <0.01 3.14±1.12 4.02±1.11 4.287 <0.01 0.660 3.006对照组(n=62)2.95±0.89 3.21±0.85 1.663 0.099 4.82±1.50 6.04±1.71 4.223 <0.01 3.01±1.05 3.61±0.95 3.336 0.01子宫内膜厚度(mm)0.511 0.003 0.836 0.508 AFC(个)时间治疗前治疗后u值P值治疗前治疗后u值P治疗前治疗后u值P值0.658 2.178 0.512 0.031
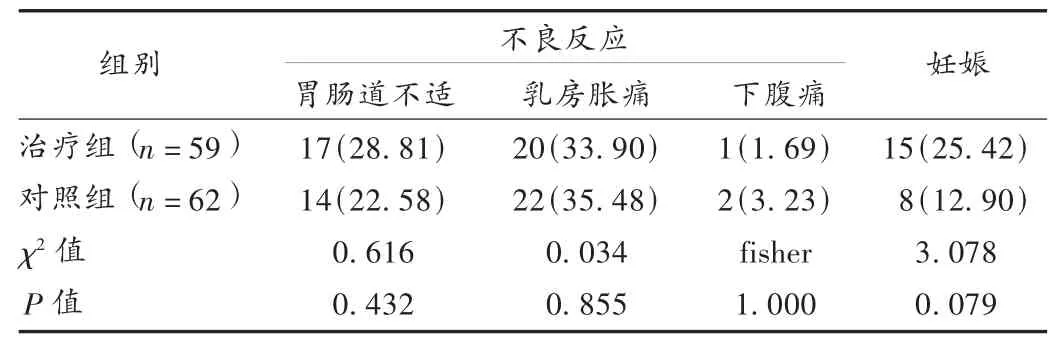
表4 两组患者药品不良反应发生情况与随访期内妊娠情况比较[例(%)]
Narkwichean等[7]的研究结果表明,雄激素可诱导颗粒细胞卵泡刺激素受体(FSHR)生成,促进卵泡募集。DHEA是由肾上腺、中枢神经系统、卵巢卵泡膜细胞分泌的一种具有雄激素活性的甾体物质,广泛分布于人体的组织器官中,是合成雄激素和雌激素的底物。DHEA在国内尚未上市,国外已有其对改善卵巢功能、提高妊娠率研究的报道,原因为DHEA异常低下则导致E2含量低下,DHEA能提高血液中胰岛素样生长因子(IGF-1)的浓度,可作为雌激素的前体激素[8];DHEA可作为雄激素受体(AR)的配体与FSH一起激卵泡分化生长,促使卵泡募集[9]。用DHEA能改善卵巢微环境,显著减少胚胎染色体非整倍体的数目和比例,提高妊娠成功率[10]。
本研究结果显示,治疗3个月后,治疗组E2及FSH水平显著低于对照组;阴道彩超下治疗组子宫内膜厚度、AFC均明显大于对照组;随访3个月内治疗组妊娠率高于对照组,表明DHEA能辅助改善人工周期疗法提高卵巢反应性与卵泡发育的功效。在药品不良反应方面,胃部不适、乳房胀痛、下腹痛等均为人工周期疗法的常见不良反应,未见文献报道的卵泡闭锁、痤疮甚至男性性征发育等严重不良反应[11]。Maninger等[12]的研究显示,每日服用剂量小于100 mg的DHEA,不良反应很少见。陈春慧等[13]报道,小剂量DHEA制剂配合中医补肾养血疗法治疗DOR的疗效与激素替代疗法相近,且能有效减少激素替代疗法的不良反应。潘裕[14]报道,每日口服75 mg DHEA治疗DOR不会导致肝功能、体重指数(BMI)变化及动物试验中提及的多囊卵巢综合征。
综上所述,DOR不孕症患者在人工周期疗法基础上联合口服DHEA能明显降低FSH水平,改善卵巢功能储备,有一定助孕功效;每日口服75 mg DHEA 3个月未见明显不良反应,安全性高。但本研究仅对患者进行了3个月的随访观察,关于DHEA对改善卵巢功能储备及受孕率的远期疗效有待于进一步观察探讨。
[1]李建娟,任春娥,张安清,等.补充DHEA对卵巢储备功能降低患者IVF-ET的影响[J].辽宁医学学院学报,2014,35(1):51-53.
[2]曹泽毅.中华妇产科学[M],第2版.北京:人民卫生出版社,2004:2 568-2 569.
[3]Welt CK.Primary ovarian insufficiency:amore accurate term for premature ovarian failure[J].Clin Endocrinol(Oxf),2008,68(4):499-509.
[4]安锦霞.雄激素在卵巢储备功能低下妇女中的研究进展[J].国际生殖健康/计划生育杂志,2013,32(1):42-44.
[5]韩连玉,叶亚智,祝佩芹.中西医结合治疗卵巢早衰58例疗效观察[J].中国全科医学,2008,11(4):343-345.
[6]Van Dooren MF,Bertoli-Avellab AM,Oldenburg RA.Premature ovarian failure and gene polymorphisms[J].Curr Opin Obstet Gynecol,2009,21(4):313-317.
[7]Narkwichean A,Maalouf W,Campbell BK,et al.Efficacy of dehydroepiandrosterone to improve ovarian response in women with diminished ovarian reserve:a meta-analysis[J].Reprod Biol Endocrinol,2013,11:44.
[8]Valery P,AliakseiM.A comparison of the onset time of complete blockade of the sciatic nerve in the application of ropivacaine and itsequal volumes mixture with lidocaine:a double-blind randomized study[J].Korean J Anesthesiol,2013,65(1):42-47.
[9]赵红翠,朱亮.脱氢表雄酮(DHEA)在辅助生殖技术中的研究进展[J].生殖与避孕,2012,32(2):118-120.
[10]Weissman A,Horowitz E,Ravhon A,et al.Dehydroepiandrosterone supplementation increases baseline follicular phase progesterone levels[J]. Gynecol Endocrinol,2011,27(12):1 014-1 017.
[11]Kasum M,SimuniV,VriH,etal.Follicular progesterone elevations with ovulation induction for IVF[J].Gynecol Endocrinol,2014,30(8):537-541.
[12]Maninger N,Wolkowitz OM,Reus VI,et al.Neurobiological and neuropsychiatric effects of dehydroepiandrosterone(DHEA)and DHEA sulfate(DHEAS)[J].FrontNeuroendocrinol,2009,30(1):65-91.
[13]陈春慧,李春霞,卢淑芳,等.小剂量激素配合补肾养血疗法对提高卵巢储备功能的效果观察[J].现代诊断与治疗,2013,24(16):3 634-3 635.
[14]潘裕.脱氢表雄酮补充治疗卵巢功能低下患者的临床研究[D].济南:山东大学,2014.
R969.4;R977.1+2
A
1006-4931(2015)24-0147-02
2015-08-13)
