紫杉醇联合铂类新辅助化疗治疗局部晚期宫颈癌的临床研究
2015-10-26邢艳吴玉梅
邢艳++++++吴玉梅


[摘要] 目的 研究紫杉醇联合铂类新辅助化疗治疗局部晚期宫颈癌的效果,评价紫杉醇联合铂类新辅助化疗的安全性。 方法 选取首都医科大学附属北京妇产医院2010年1月~2015年1月就诊的局部晚期宫颈癌患者144例为研究对象,根据治疗方式的不同将其分为对照组(n=74)和研究组(n=70)。其中对照组直接行根治性手术治疗,研究组给予紫杉醇联合铂类新辅助化疗联合根治性手术治疗。比较两组术后病理特征、术中出血、术后并发症及近期疗效情况,观察新辅助化疗的疗效及副作用。 结果 术前评估局部瘤灶变化,研究组患者完全缓解率达18.6%,部分缓解率达81.4%,术后病理完全反应率达10.0%。研究组术后深层间质浸润发生率(51.4%)明显少于对照组(74.3%),差异有高度统计学意义(P < 0.01),子宫旁浸润率(2.9%)、脉管间隙癌栓率(38.6%)及术后淋巴囊肿发生率(15.7%)均低于对照组(12.2%、44.6%、17.6%),但差异无统计学意义(P > 0.05)。研究组与对照组的近期复发率(2.9%比5.4%)及病死率(1.4%比2.7%)比较,差异均无统计学意义(P > 0.05)。研究组患者新辅助化疗期间,未出现严重不良事件,仅1例患者出现Ⅲ度骨髓抑制。 结论 紫杉醇联合铂类新辅助化疗治疗局部晚期宫颈癌联合手术较直接手术有更好的近期疗效,其安全性是肯定的。
[关键词] 新辅助化疗;局部晚期宫颈癌;近期疗效
[中图分类号] R737.33 [文献标识码] A [文章编号] 1673-7210(2015)10(b)-0017-06
Clinical research of Paclitaxel plus platinum neoadjuvant chemotherapy in the treatment of locally advanced cervical cancer
XING Yan WU Yumei
Department of Gynaecological Oncology, Beijing Obstetrics and Gynecology Hospital, Capital Medical University, Beijing 100006, China
[Abstract] Objective To study the curative effect of Paclitaxel plus platinum neoadjuvant chemotherapy in the treatment of locally advanced cervical cancer, and evaluate the safety of Paclitaxel plus platinum neoadjuvant chemotherapy. Methods 144 patients with locally advanced cervical cancer from January 2010 to January 2015 in Beijing Obstetrics and Gynecology Hospital, Capital Medical University were selected as study objects, and they were divided into two groups according to the different methods of treatment, 74 cases of the control group were accepted radical surgery directly, 70 cases of the experimental group accepted Paclitaxel plus platinum neoadjuvant chemotherapy combined radical surgery. The postoperative pathological characteristics, intraoperative bleeding, postoperative complications and the short-term curative effect were observed between the two groups; the side effects and curative effect of neoadjuvant chemotherapy were observed. Results Size of local tumor of patients in the experimental group was evaluated before operation, the overall complete response rate was 18.6%, the partial remission rate was 81.4%, postoperative pathological complete response rate was 10.0%. Postoperative deep stromal infiltration rate of the experimental group (51.4%) was significantly lower than that of the control group (74.3%), the difference was statistically significant (P < 0.01), parametial invasion rate and lymphovascular space invasion rate and incidence rate of lymphocele postoperation of the experimental group (2.9%, 38.6%, 15.7%) were lower than those of the control group(12.2%, 44.6%, 17.6%), but had no statistically significant difference (P > 0.05). The experimental group and the control group had nearly recurrence rate (2.9% vs 5.4%) and mortality (1.4% vs 2.7%) had no statistically significant difference (P > 0.05). During the period of neoadjuvant chemotherapy, no serious adverse events occurred in experimental group, only 1 case patients appeared Ⅲ-degree bone marrow suppression. Conclusion There is better short-term effects of Paclitaxel plus platinum neoadjuvant chemotherapy in the treatment of locally advanced cervical cancer, compared with direct operation, and has confirmed security.
[Key words] Neoadjuvant chemotherapy; Locally advanced cervical cancer; Short-term efficacy
局部晚期宫颈癌(locally advanced cervical cancer,LACC)的概念于20世纪90年代提出,其广义包括ⅠB2~Ⅳ期的子宫颈癌,狭义是指局部肿瘤直径>4 cm的早期子宫颈癌,即ⅠB2~ⅡA2期。有报道显示,ⅠB1期子宫颈癌5年生存率为80%~95%,ⅡA1期5年生存率为79.7%,而ⅠB2和ⅡA2期的5年生存率则降至50%~60%,估计超过35%的宫颈癌诊断时已达局部晚期,即ⅠB2~ⅡB期,5年总生存率约为60%[1],其中30%~50%的局部晚期宫颈癌患者最终均因为该肿瘤死亡[2]。可见局部晚期宫颈癌恶性程度高、远期生存率低。1982年,Frei[3]首先提出了新辅助化疗(neoadjuvant chemotherapy,NACT),即在恶性肿瘤局部实施手术或放疗前应用的化疗。目前新辅助化疗已广泛应用于其他肿瘤的治疗,如乳腺癌、骨肉瘤、胃肠道肿瘤、肺癌、头颈部肿瘤等,但在局部晚期宫颈癌中的应用仍处于探索阶段,因此本课题旨在为新辅助化疗治疗局部晚期宫颈癌提供循证医学证据。
1 资料与方法
1.1 一般资料
选取2010年1月~2015年1月就诊于首都医科大学附属北京妇产医院(以下简称“我院”)144例宫颈癌患者为研究对象,国际妇产科联合会(FIGO)分期为ⅠB2或ⅡA2期宫颈癌患者入组。纳入标准:经病理证实的初治宫颈癌患者,包括鳞状细胞癌、腺癌和腺鳞癌;根据治疗方案不同将其分为对照组(n=74)和研究组(n=70)。所有患者均同意进行该研究,并签署知情同意书。排除标准:伴有严重合并症不能耐受手术或化疗者;已有明确远处转移者;合并心血管、脑血管、肝、肾、造血系统等严重疾病,使生存期<5年者;有未控制的癫痫、中枢神经系统疾病或精神障碍史者,由研究者判断其临床严重性影响临床研究依从性者;有其他恶性疾病史者;曾接受细胞毒化疗、放疗或免疫治疗者。本课题为前瞻性研究,已通过我院医学伦理委员会审核通过。
1.2 研究方法
本课题采用前瞻性登记研究,符合入组条件的病例入组后充分向患者及家属交代病情,根据患者的病情、家属意愿及经济状况,酌情选取治疗方式。研究组给予紫杉醇联合铂类新辅助化疗联合宫颈癌根治性手术治疗,对照组直接行宫颈癌根治性手术。对照组在病理确诊为宫颈癌后,限期行广泛子宫切除术+双输卵管切除术+盆腔淋巴结切除术和/或腹主动脉旁淋巴结切除术和/或双卵巢切除。研究组在入组后予短周期、高剂量新辅助化疗,化疗方案为紫杉醇+顺铂方案(TP方案),给药剂量为:紫杉醇(紫素,北京协和药厂,批号:141101)按60 mg/m2计算,顺铂(齐鲁制药有限公司;批号:409030CF)按照60 mg/m2计算。每2个疗程间隔10~14 d,共1~3程。每次化疗完成1周后,采用妇科三合诊、CT/MRI检查评估化疗效果,化疗期间根据WHO抗癌药物毒副作用分级标准,评价化疗期间副作用。手术时机的选择:根据实体瘤疗效评价标准,局部瘤灶达到完全缓解或部分缓解即可手术,手术时间选择在末次化疗后10~14 d进行。手术范围:广泛子宫切除术+双输卵管切除术+盆腔淋巴结切除术和/或腹主动脉旁淋巴结切除术和/或双卵巢切除。若新辅助化疗期间疾病进展丧失手术机会,则及时行全程放疗,退出研究。近两年入组的每例患者治疗前均取肿瘤组织及静脉血1份放入“北京市宫颈癌临床数据库和样本资源库”。手术切除所有标本送病理科,若术后病理存在宫旁浸润、淋巴结转移、切缘阳性、脉管间隙浸润、深层间质浸润等复发高危因素,则补充放射治疗。
1.3 观察指标
1.3.1 围术期
术后病理特征的比较:两组手术切除标本均送至我院病理科,观察其术后病理特征的差异,如宫旁浸润、淋巴结转移、切缘阳性、脉管间隙浸润、深层间质浸润等,评价新辅助化疗疗效。术中出血量比较:术中出血量的计算采用体积法、面积法,评价新辅助化疗是否可以降低术后出血量。手术相关并发症的比较:严密记录手术相关并发症的发生,如周围脏器副损伤、术后伤口愈合不良、术后感染、术后尿潴留等,评价新辅助化疗安全性。
1.3.2 近期疗效
所有入组病例从治疗结束随访至2015年3月,记录其复发及死亡情况,进而比较研究组与对照组的无瘤生存率及病死率,评价新辅助化疗的近期疗效。 1.3.3 新辅助化疗的局部疗效
1.3.3.1 局部大体病灶缓解情况 采用“实体瘤疗效评价标准”评价新辅助化疗后局部瘤灶的变化[4],进而评价新辅助化疗的局部疗效:①完全缓解(CR):所有目标病灶消失;②部分缓解(PR):基线病灶长径总和缩小≥30%;③病情稳定(SD):基线病灶长径总和缩小,但未达PR或有所增加但未达疾病进展(PD);④PD:基线病灶长径总和≥20%或出现新病灶。
1.3.3.2 新辅助化疗后局部细胞学缓解情况 术后病理采用肿瘤退缩分级(tumor regression grade,TRG)[5]标准评价细胞水平局部病灶缓解情况。肿瘤退缩分级标准:0级(完全反应):肿瘤消失;1级(中度反应):残存孤立细胞或细胞团;2级(微小反应):纤维化组织中残留肿瘤组织;3级(弱反应):大量残留肿瘤细胞,治疗反应弱或无。
通过上述两种指标对新辅助化疗的疗效作出客观评价,进而比较不同给药途径局部病灶的疗效差异,为新辅助化疗选择更优的给药途径。
1.3.4 新辅助化疗期间化疗副作用
新辅助化疗期间每周查2次血常规,1次尿常规,每2周查1次肝肾功能,每次化疗后复查心电图,严密监测并记录化疗期间副作用,对照WHO抗癌药物毒副作用分级标准分度[6],进而评价新辅助化疗安全性。
1.3.5 新辅助化疗的安全性
详细记录新辅助化疗导致的重度不良反应(Ⅲ、Ⅳ度)及相关不良事件。
1.4 统计学方法
采用SPSS 18.0统计学软件进行数据分析,计量资料数据用均数±标准差(x±s)表示,两组间比较采用t检验;计数资料用率表示,组间比较采用χ2检验,以P < 0.05为差异有统计学意义。
2 结果
2.1 两组间的比较
2.1.1 一般资料的比较
两组间年龄、肿瘤分期、病理类型、分化程度、大体分型、手术方式比较,差异均无统计学意义(P > 0.05)。表1。
2.1.2 围术期观察指标
比较两组术后病理特征发现,研究组深层间质浸润病例数为36例,对照组55例,研究组术后深层间质浸润发生率(51.4%)明显少于对照组(74.3%),差异有高度统计学意义(P=0.006)。研究组脉管间隙浸润27例(38.6%),宫旁浸润2例(2.9%),与对照组[33例(44.6%)、9例(12.2%)]比较,差异无统计学意义(P > 0.05),但研究组有好转趋势。所有入组病例均无切缘阳性。
比较两组术中出血情况,对照组术中出血量为(671.59±442.26)mL,其中≤500 mL者31例(41.9%);研究组术中出血量为(554.86±286.66)mL,其中≤500 mL者36例(51.4%),虽然两组出血量≤500 mL者所占比例比较,差异无统计学意义(P > 0.05),但不难看出研究组出血量较对照组有减少趋势。
2.1.3 近期疗效
两组患者均从治疗结束随访至2015年3月,其中研究组中位随访时间为14.5个月,对照组中位随访时间为38.4个月。随访中,研究组2例复发病,复发率为2.9%(2/70),1例死亡,病死率为1.4%(1/70)。对照组4例复发,复发率为5.4%(4/74),2例死亡,病死率为2.7%(2/74)。两组复发率及病死率比较差异无统计学意义(P > 0.05)。
2.1.4 术后并发症
宫颈癌根治术后常见并发症为淋巴囊肿、周围脏器副损伤、术后伤口愈合不良、术后感染等。研究组术后淋巴囊肿发生率为15.7%(11/70),对照组淋巴囊肿发生率为17.6%(13/70),两组比较差异无统计学意义(P > 0.05)。对照组1例患者切口愈合,经每日清创换药后,伤口愈合良好。两组均无周围脏器副损伤及术后感染病例。
2.2 研究组新辅助化疗的疗效
2.2.1 研究组新辅助化疗前后宫颈局部瘤体的变化
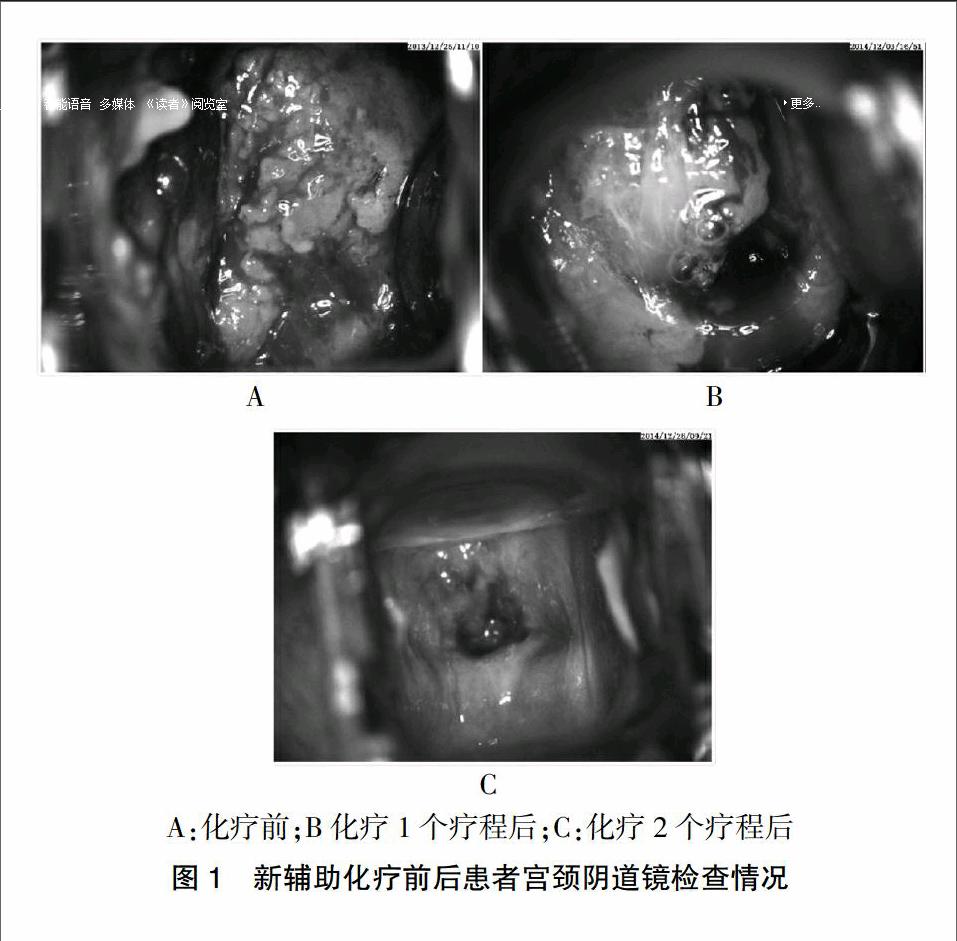
研究组入组病例均在完成新辅助化疗后采用“实体瘤评价标准”评估局部疗效,所有病例均达到完全或部分缓解,其中完全缓解的患者有13例,完全缓解率达18.6%,部分缓解的患者57例,部分缓解率达81.4%。图1为1例宫颈鳞状细胞癌ⅠB2期G2(外生型)患者阴道镜所示局部肿瘤变化,可见新辅助化疗前宫颈可见一直径5 cm外生菜花样肿物,经过1个疗程新辅助化疗后局部瘤灶较前明显缩小,经过2个疗程化疗后局部瘤灶消失,宫颈外口仅见一直径1 cm糜烂面。局部病灶达到完全缓解,为手术创造了良好的条件。
A:化疗前;B化疗1个疗程后;C:化疗2个疗程后
图1 新辅助化疗前后患者宫颈阴道镜检查情况
2.2.2 研究组术后病理缓解情况
根据“肿瘤退缩分级”评估新辅助化疗后术后病理情况,发现7例肿瘤病灶完全消失,即完全反应率为10.0%(7/70),8例仅残留少量癌团,即中度反应率为11.4%(8/70),微小反应及弱反应者55例,占78.6%(55/70)。
2.3 研究组新辅助化疗期间化疗药物毒副作用
新辅助化疗期间,采用WHO化疗药物毒副作用分度,评价化疗的安全性。研究发现:化疗期间主要发生了消化道副作用(恶性、呕吐)、骨髓抑制、脱发及肝功能损害,未发生其他化疗副作用。在所有入组的70例新辅助化疗联合手术的病例中,仅出现1例Ⅲ度骨髓抑制,经过对症治疗后好转,未影响下一步治疗方案。13例患者脱发较严重(Ⅲ度),化疗结束后逐渐缓解。见表2。
表2 新辅助化疗药物毒副作用评价[n(%),n=70]
3 讨论
目前,对于局部晚期宫颈癌的有效性一直存在争议,大部分学者认为局部晚期宫颈癌术前新辅助化疗的疗效是肯定的,He等[7]对62例ⅠB2~ⅡB期宫颈癌患者行紫杉醇联合顺铂新辅助化疗2~3个疗程,根据化疗后病灶大小、术中情况及术后病理评价其临床疗效。其总的有效率为90.32%,其中完全缓解率为30.65%,其结论认为术前新辅助化疗是有效的。本课题通过“实体瘤评价标准”评估新辅助化疗后局部瘤灶变化,发现紫杉醇联合铂类新辅助化疗后宫颈局部瘤灶可明显缩小,甚至癌灶完全消失,其完全缓解率达18.6%,部分缓解率达81.4%。这不仅为手术创造了良好的条件,对于妊娠期女性,通过新辅助化疗使局部肿瘤得到很好的控制,进而延长期孕龄。我国一项研究发现对于晚期妊娠的女性,新辅助化疗可使局部肿瘤得到控制,进而行剖宫产术分娩,是一项成功的个体化治疗方案[8]。对于有生育要求的早期宫颈癌女性,新辅助化疗联合宫颈扩大切除也是一项安全的治疗措施[9]。
根据“肿瘤退缩分级”评估新辅助化疗后术后病理情况,发现7例患者肿瘤病灶完全消失,即完全反应率为10%,8例仅残留少量癌团,即中度反应率为11.4%,这说明紫杉醇联合铂类新辅助化疗治疗局部晚期宫颈癌局部疗效是肯定的,新辅助化疗可明显缩小局部肿瘤体积,为局部晚期患者创造了手术机会,且新辅助化疗可有效杀灭肿瘤细胞,甚至达到术后病理的完全反应,癌灶完全消失,大大降低了术后补充治疗的概率。Katsumata等[10]发现术前新辅助化疗并不改善其总生存率,但可以降低患者术后补充放疗的概率,进而改善患者生存质量。这与本课题研究结果相符。且意大利一项多中心回顾性研究对333例ⅠB2~ⅡB期患者进行研究,发现术后病理的缓解情况是影响其无瘤生存期及总生存期的独立危险因素,术后病理未完全反应的患者的复发率是完全反应患者的2.757倍,病死率为其5.413倍[11],另有一项研究结果也支持此结论[12]。这说明紫杉醇联合铂类新辅助化疗不仅可以通过消瘤作用为手术创造良好的条件,若化疗效果明显,还可以显著改善其远期预后。
本课题通过分析患者术后病理特征发现,紫杉醇联合铂类新辅助化疗可有效降低宫颈癌深层间质浸润的发生,且对于宫旁浸润、脉管间隙浸润方面,较直接手术组虽无明显统计学差异,但仍有降低趋势。另有研究发现新辅助化疗可通过诱导细胞凋亡降低淋巴结转移率[13]。宫颈深层间质浸润、宫旁浸润、脉管间隙浸润及淋巴结转移,均为国内外公认的宫颈癌复发的高危因素,通过新辅助化疗可有效降低其发生率,进而减少术后补充放疗的可能。众所周知,放疗可造成放射性直肠炎、放射性膀胱炎、卵巢功能损害等多种副作用,部分副作用不完全可逆,对于年轻女性,严重影响其生活质量。若能通过新辅助化疗降低其术后补充治疗的概率,则可明显改善其生活质量。有学者研究发现新辅助化疗与同步放化疗疗效相似,但耐受性好、副作用少[14]。此外,本课题研究发现新辅助化疗可降低术中出血量,从而降低了输血的可能性,降低了输血相关并发症的发生率,对患者术后康复也有着积极作用。
对于恶性肿瘤患者,无瘤生存期(DFS)及总生存期(OS)才是观察疗效的重要指标,有大样本研究比较局部晚期宫颈癌新辅助化疗联合根治性手术与直接行根治术或全程放疗的长期生存率,476位ⅠB2~ⅡB期患者入组,三组的3年无瘤生存期分别为85.00%、77.44%及52.94%,5年生存期分别为88.67%、80.21% 及64.37%[15]。可见新辅助化疗明显改善了患者的远期生存率,但由于本课题随访时间尚短,无法对其OS及DFS做出回答,但通过总结目前的复发率及病死率,新辅助化疗联合根治性手术与直接行根治性手术,二者无明显差异(P > 0.05)。
关于紫杉醇联合铂类新辅助化疗的安全性,Moioli等[16]研究了数位ⅠB2~ⅡB期宫颈癌患者,均给予3个疗程TP方案经静脉新辅助化疗,结果提示100.0%患者脱发,35.7%乏力,14.3%恶心呕吐,7.1%紫杉醇过敏,7.1%中性粒细胞减少。本课题研究期间,未出现不良事件,且新辅助化疗副作用患者尚可耐受,仅静脉新辅助化疗出现1例Ⅲ度骨髓抑制的患者,经过积极对症治疗后好转,未影响其下一步治疗方案。宫颈癌根治术围术期并发症发生率最高为淋巴囊肿,新辅助化疗后其发生率为15.7%,与对照组比较,并无明显差异,且无伤口愈合不良、术后感染、周围脏器损伤、术后尿潴留等并发症出现,体现了新辅助化疗的安全性。本课题中采用的是紫杉醇联合顺铂短周期新辅助化疗,降低了化疗期间肿瘤进展的风险,有研究表明,化疗周期小于14 d的新辅助化疗较长周期新辅助化疗,其总生存期提高7%[17]。可见,在应用得当的情况下,新辅助化疗是一种较安全的治疗措施。
综上所述,紫杉醇联合铂类新辅助化疗治疗局部晚期宫颈癌的近期疗效是肯定的,能够有效缩小局部瘤灶大小,为手术创造了良好的条件。随着治疗观念的转变,生活质量越来越受到国内外学者的重视。传统的全程放疗副作用较重,且不完全可逆,严重影响患者生活质量。新辅助化疗联合根治性手术,对改善深层间质浸润,甚至脉管间隙癌栓、淋巴结转移、宫旁浸润也有作用,大大降低了术后补充放化疗的可能性,改善了患者生活质量[18-19]。随着腹腔镜的开展与发展,其也逐渐被应用到恶性肿瘤的治疗中,本课题中有24例患者进行了腹腔镜下宫颈癌根治术,比较不同手术方式对新辅助化疗疗效的比较,发现二者并无明显差异。Ghezzi等[20]对341例ⅠB2~ⅡB期宫颈癌患者进行新辅助化疗,化疗后行腹腔镜及开腹手术,发现二者术后并发症及围术期结局相同,但腹腔镜手术具有术中出血更少、术后转移率低、平均住院日短等特点,且发现腹腔镜下手术并不影响患者生存率。但由于课题研究仍处于初步阶段,病例数量少、随访时间短,不除外存在新辅助化疗远期并发症可能,且尚不能对DFS及OS做出回答,这也将是本课题进一步研究的重点。
随着社会化因素的改变,宫颈癌发病率有年轻化趋势,有学者研究了573例早期宫颈癌(ⅠA~ⅡA)患者,35岁以下年轻宫颈癌患者占24.1%[21]。提高宫颈癌患者的生存率并改善其生活质量势在必行。对于新辅助化疗的疗效,仍存在争议,有学者认为术前新辅助化疗较直接手术,未能明显改善其生存期[22],其有效性、安全性及规范化治疗方案的制订仍需探索,希望通过大量临床试验的验证,新辅助化疗的疗效能够得到验证,进一步指导局部晚期宫颈癌患者的临床治疗。
[参考文献]
[1] Lucas M,María GP,Nuria R,et al. Different strategies of treatment for uterine cervical carcinoma stageⅠB2-ⅡB [J]. World J Clin Oncol,2014,5(2):86-92.
[2] Legge F,Chiantera V,Macchia G,et al. Clinical outcome of recurrent locally advanced cervical cancer submitted to primary multimodality therapies [J]. Gynecol Oncol,2015, 138(1):83-88.
[3] Frei E. Clinical cancer research:an embattled specics [J]. Cancer,1982,50(10):1979-1992.
[4] 仇龙山,彭素蓉.巨块型Ⅰb、Ⅱa宫颈癌的术前处理方式探讨[J].实用癌症杂志,2009,24(6):632-634.
[5] Dworak O,Keilholz L,Hoffmann A. Pathological features of rectal cancer after preoperative radiochemotherapy [J]. Int J Colorectal Dis,1997,12(1):19-23.
