观叶福禄桐遗传多样性的ISSR分析
2015-10-25张国武刘学锋周兴华黄涛
张国武刘学锋周兴华黄涛
(1.国家林业局桉树研究开发中心,湛江 524022;2.余干县林业局,余干 335100;3.江西农业大学园林艺术学院,南昌 330045)
观叶福禄桐遗传多样性的ISSR分析
张国武1刘学锋1周兴华2黄涛3
(1.国家林业局桉树研究开发中心,湛江 524022;2.余干县林业局,余干 335100;3.江西农业大学园林艺术学院,南昌 330045)
利用ISSR分子标记对9个观叶福禄桐品种进行遗传多样性和亲缘关系分析,从100条引物中筛选出9条稳定、多态性高的引物用于PCR扩增,共获得70条带,其中多态性条带61条,多态百分率为87.14%。聚类结果显示,品种间相似性系数为0.346 9-0.816 3,聚类结果与品种间的地理来源紧密相关,从外观形态上比较,亲缘性较近的叶形和株型相似性较高;观叶福禄桐各品种间基因型差异较小,亲缘关系较近,遗传基础相对较窄。
ISSR;福禄桐;观叶植物;遗传相似性系数;聚类分析
ISSR(Inter-simple sequence repeat)由Zietkiewicz等[1]于1994年创建,因其具有分布广、多态性高、技术难度低、操作简单、重复性高、成本低等优点,是一种近年来应用较为广泛的分子遗传标记技术,它来源于植物基因组中丰富的简单序列重复(SSR),由2-4个随机的核苷酸锚定在微卫星序列的3'端或5'端,由此组成的单引物进行重复序列间DNA的PCR扩增[2],现已普遍应用于居群生物学的研究、品种鉴定和物种分类,并作为构建遗传图谱的工具[3]。
福禄桐(Polyscias),原产于太平洋诸岛,为五加科福禄桐属植物,常绿灌木或小乔木,株形柔和,古朴优雅,古色古香,叶片与茎干奇特优美,侧枝细长,枝繁叶茂,叶片形状多样,有圆叶、羽叶、条形叶、蕨叶等[4,5];叶色斑驳多彩,有绿、黄、银色等;植株多分枝,分枝皮孔显著,树型紧凑优美,生长速度快,耐整形修剪,性喜高温多湿,耐旱耐阴。不同规格的植株装饰客厅、卧室、书房、阳台等处,既时尚典雅,又清新自然,是近几年较为流行的高档室内观叶盆栽,适合庭院美化和室内盆栽。目前,国外的研究主要集中在观叶福禄桐的起源、化学成分及药理作用方面[6-8];国内则主要集中于研究观叶福禄桐的栽培、繁殖和观赏价值[9-11],而对其遗传多样性和品种间亲缘关系的研究国内外尚未报道,由此导致观叶福禄桐品种混杂、分类标准不统一、优良种质资源稀缺,制约了其快速良好的发展。因此,本研究在广泛调查和收集福禄桐品种资源的基础上,以国内常见的观叶福禄桐为试验材料,利用ISSR分子标记对品种间的亲缘关系和遗传相似性进行分析,旨在为福禄桐属植物的分类、亲缘关系鉴定提供依据,同时为今后福禄桐种源的选择、优良品种的引进和新品种培育奠定分子生物学研究基础。
1 材料与方法
1.1 材料
9个参试福禄桐品种由广东省湛江市国家级南方种苗基地所提供(参试品种详见表1),试验于国家林业局桉树研究开发中心实验室内完成。
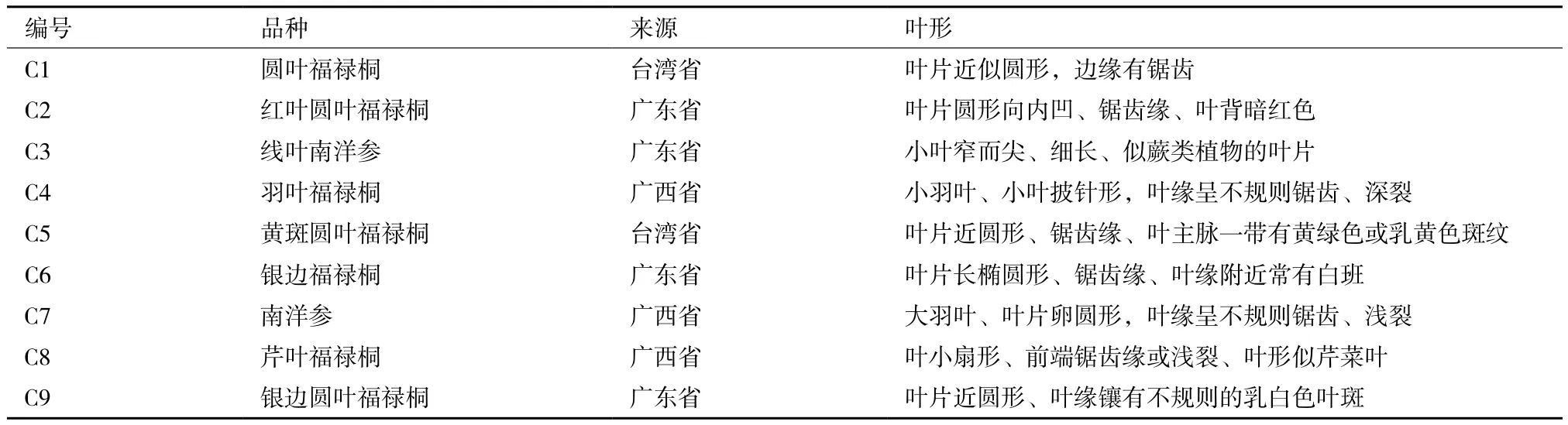
表1 福禄桐属植物9份材料
1.2 方法
1.2.1 福禄桐基因组DNA的提取与检测 试验样品均采集生长健壮、无病虫害危害植株的幼嫩叶片,利用改良的CTAB法[12-14]提取福禄桐叶片基因组DNA,用1×TAE电泳缓冲液,在1.5%琼脂糖(含EB终浓度为0.5 μg/mL)凝胶中电泳,条件为85 V,50 min;凝胶成像系统下(Bio-Rad)观察并记录,以初步检测基因组DNA的完整度和质量;通过核酸检测仪(Bio-Rad生产的Thermo Nano Drop 2000)检测其浓度及纯度。
1.2.2 PCR反应体系及条件 PCR扩增仪为美国Bio-Rad(伯乐公司)C-1000,反应体系:反应体系总体积为25 μL,DNA模板浓度为15 ng,Mg2+浓度为3.0 mmol/L,引物浓度0.6 μmol/L,Taq酶含量0.5 U,dNTP浓度为0.20 mmol/L,内含2.5 μL 10×PCR buffer。反应程序:94℃预变性4 min;94℃变性45 s,47℃退火50 s,72℃延伸1 min,循环38次;72℃延伸7 min;4℃保存。
1.2.3 引物筛选及PCR扩增 本研究的引物由铂尚生物技术(上海)公司合成,随机选择3个参试材料对100条引物进行筛选,从中选出差异性条带强、多态性高的引物用于后续的PCR扩增;利用筛选的引物对所有参试样品DNA进行PCR扩增,扩增结束后取PCR扩增产物和Loading buffer缓冲液比例为2∶1于1.5%琼脂糖(含EB终浓度为0.5 μg/mL)凝胶中电泳(85 V,1 h),然后在凝胶成像系统下观察并成像记录。
1.2.4 电泳图谱分析方法 对PCR扩增好的图谱带进行统计分析,每个电泳图扩增出的条带代表一个ISSR位点,有条带的记为“1”、无则记为“0”的方法记录每个引物PCR扩增的电泳谱带,且仅记录清晰、稳定、重复性好的扩增条带,并将“0”、“1”数据转换成Excel表格格式,再利用NTSYS-pc2.10软件做进一步分析;在NTSYS-pc2.10软件中,根据SM相似系数法求得9个福禄桐品种间遗传相似性矩阵,用UPGMA法对各品种进行聚类分析,构建聚类图;再将Dice遗传相似性矩阵进行Dcenter数据转化,求其特征量和特征向量,进行主坐标分析。
2 结果
2.1 基因组DNA提取的质量
采用改良的CTAB法提取9个福禄桐品种的基因组DNA,电泳检测结果如图1所示,核酸检测仪测定OD260/OD280比值在1.75-1.95之间,表明所提取叶片基因组DNA中蛋白质和RNA含量较少,纯度较高,符合后续的试验要求。

图1 九个福禄桐品种DNA质量
2.2 引物筛选多态性分析
随机选择3个试验样品对100个ISSR引物进行筛选,共筛选出9条清晰、稳定、多态性高的引物用于PCR扩增(表2);利用筛选出的9条多态性引物对9个不同品种的福禄桐进行PCR扩增,扩增结果见图2。通过对9张图谱的统计分析,PCR扩增共得到70条带,其中多态性条带61条,多态百分率为87.14%;其中引物U848扩增条带数最多,共产生11条,多态性条带9条,引物U823、U826多态性百分比达到100%,都扩增出7条带,引物U859扩增条带数最少为6条;各引物扩增条带为6-11,大小一般在200-3 000 bp之间。检测结果见表2。

表2 ISSR-PCR分析所用引物及扩增结果
2.3 品种间遗传相似性分析
利用NTsys-pc2.10软件得出各观叶福禄桐品种间的相似性系数。结果(表3)表明,9个观叶福禄桐品种间的遗传相似性系数范围在0.346 9-0.816 3,平均遗传相似性系数为0.598 4;其中C1(圆叶福禄桐)和C5(黄斑圆叶福禄桐)间的遗传相似性系数最大,达到0.816 3,其次C1(圆叶福禄桐)和C2(红叶圆叶福禄桐)遗传相似性系数也较高,达到0.795 9,表明它们之间的遗传差异小,亲缘性很近,而C2(红叶圆叶福禄桐)和C7(南洋参)相似性系数最小为0.346 9,表明其遗传差异性较大,亲缘关系最远。

表3 九个观叶福禄桐品种间的相似性系数
2.4 品种间聚类分析

图2 不同引物的PCR电泳图谱(编号C1-C9同表1)
根据遗传相似性系数矩阵采用UPGMA法对9个观叶福禄桐品种进行聚类分析(图3)。分析聚类图可知,在遗传相似性系数为0.52处,9个观叶福禄桐品种分为A、B两大类,A类有7个品种,C4(羽叶福禄桐)和C7(南洋参)归为B类,相似性系数达到0.76,这两品种间形态特征也极为相似,都为羽叶,只是叶片开裂的深浅程度不同而已,种质资源收集地也都来自广西,可见地域差异也影响着品种间的亲缘性,聚类结果显示C4(羽叶福禄桐)和C7(南洋参)亲缘性较近;A类种群在相似性系数0.57处,分支成A1和A2两亚类,A2亚类只有C3(线叶福禄桐)一个品种,而A1亚类在相似性系数为0.63处,又分支成A11和A12两组,A11组包括C1(圆叶福禄桐)、C5(黄斑圆叶福禄桐)、C2(红叶圆叶福禄桐)和C9(银边圆叶福禄桐),其叶形和叶脉极相似,叶色稍有差异,其中C1(圆叶福禄桐)和C5(黄斑圆叶福禄桐)亲缘性最近,相似性指数约为0.82;A12组有银边福禄桐和芹叶福禄桐。

图3 福禄桐品种资源ISSR聚类图
2.5 品种资源的主坐标分析
品种资源的主坐标分析和聚类分析虽然都能反应样品的聚类情况,但它们反应的信息含量却有所差异。从主坐标二维分布图(图4)可以得知,9个福禄桐品种有较明显的分布区域,C4和C7位于坐标图的左侧,C6和C8分布于坐标图的上方,C1、C2、C5和C9分布于坐标图的右下方。从整体上看品种资源的主坐标分析与聚类分析结果较符合。

图4 福禄桐品种资源主坐标分析二维图
3 讨论
ISSR是在SSR的基础上发展起来的一种新型的分子标记,目前,ISSR已广泛用于植物品种鉴定、遗传作图、遗传多样性及分子生态学研究[15,16]。本研究利用ISSR分子标记技术对9份观叶福禄桐种质资源材料进行遗传多样性分析,从100条引物中筛选出9条稳定、多态性高的引物用于PCR扩增,共获得70条带,其中多态性条带61条,多态百分率为87.14%,体现了ISSR分子标记较好的多态性;遗传多样性分析将9个福禄桐品种完全分开,揭示了不同福禄桐品种间的相互关系,是鉴定福禄桐种质资源亲缘关系的一条有效途径。
研究结果显示,9个观叶福禄桐品种间相似性系数为0.346 9-0.816 3,品种间具有较高遗传相似性;聚类分析显示:各品种间相似性系数为0.52时,其中羽叶福禄桐和南洋参聚为B组,其它的福禄桐品种聚为A组,各福禄桐属植物亲缘关系分化比较明显,植株的外部形态特征相似度与其亲缘关系远近大部分相对应,其中银边福禄桐与芹叶福禄桐亲缘关系近,两植物外形特征差异明显,其它福禄桐属植物归为同一类的外形特征都较为相似。进一步分析聚类图可知,福禄桐属植物遗传背景范围小,可推测出种源相对少,单一。聚类结果与品种间的地理来源紧密相关,从外观形态方面比较,亲缘性较近的叶形和株型存在一定的相似度,由于本研究表型性状调查采集的数据较少,聚类结果与表型性状间相关性并不明显,今后可在大量调查、采集福禄桐表型性状数据基础上,对其表型性状进行深入分析,通过与聚类分析结果相比较,找到能对福禄桐品种进行有效分类或鉴别的质量性状。
福禄桐原产于太平洋诸岛,由于气候和环境因素的限制,只在我国南部的部分沿海城市引种和栽培,栽培面积狭窄,人工驯化栽培时间较短暂,而且长期以来福禄桐的繁殖方式以扦插繁殖为主,因而差异性不大;又因国内各地方引种、栽培和育种只限于当地市场好、受欢迎的品种,地域性差异,育种目标单一,导致国内福禄桐各品种间基因交流少,基因多样性逐渐窄化,所以国内福禄桐各品种间亲缘关系较近,各品种间的遗传多样性并非那样丰富。在今后的驯化、栽培和育种工作中,加大引种、推广力度,促进不同产区、种间种质资源的交流,丰富其遗传多样性,加大对优良新品种的选育力度,促进观叶福禄桐生产的持续发展。
4 结论
本研究通过改良的CTAB法提取福禄桐属植物DNA,获得纯度高、质量好的基因组DNA,符合后续的试验标准;利用优化的反应体系对试验所设计的引物进行筛选,获得9条试验所需引物,分别对9个不同福禄桐属植物基因组DNA进行PCR扩增,共获得70条带,其中多态性条带61条,多态百分率为87.14%;然后分别对PCR图谱带进行聚类分析,结果表明:9个观叶福禄桐品种间相似性系数为0.346 9-0.816,各品种间相似性系数为0.52时,其中羽叶福禄桐和南洋参聚为B组,其它的福禄桐品种聚为A组,各福禄桐属植物亲缘关系分化比较明显;最后对9个福禄桐属植物进行主坐标分析,其结果与聚类分析基本保持一致。
[1]Zietkiewicz E, Rafalski A, Labuda D. Genome fingerprinting by simple sequence repeat(SSR)-anchored polymerase chain reaction amplification[J]. Genomics, 1999, 20:176-183.
[2]杨兆起.中药鉴别手册(第3册)[M].北京:科学出版社,1994:1.
[3]张国武, 钟文斌, 乌云塔娜, 等.油茶优良无性系[J].林业科学研究, 2007, 20(2):278-282.
[4]胡松华.南洋森与福禄桐观叶植物介绍[J].花卉, 2006, 9:32.
[5]胡一民.简约时尚的观叶植物—福禄桐[J].中国花卉盆景,2003, 3:24.
[6]Plunkett GM, Lowry PP II, Michele K. The phylogenetic status of Polyscias(Araliaceae)based on nuclear its sequence date[J]. Annals of the Missouri Botanical Garden, 2001, 30(1):213-230.
[7]Mitaine-Offer AC, Tapondjou LA, Lontsi D. Constituents isolated from Polyscias fulva[J]. Biochemical Syetematics and Ecology,2004, 32(6):607-610.
[8]Vo DH, Yamamura S, Ohtani K, et al. Oleanane saponins from Polyscias fruticosa[J]. Phytochemistry, 1998, 47(3):451-457.
[9]李克烈, 王荣香, 陈伟, 等.羽叶南洋参的组织培养[J].植物生理学通讯, 2007, 43(2):324.
[10]欧阳泉, 周俊辉, 陈水渐, 等.几种盆栽植物对甲醛的净化作用[J].北方园艺, 2012(22):57-60.
[11] 尹斌开, 龙相斌, 胡庆, 等.圆叶福禄桐组培快繁技术研究[J].现代农业科技, 2008(20):18-19.
[12] 邹喻苹, 葛颂, 王晓东.系统与进化植物学中的分子标记[M].北京:科学出版社, 2001.
[13] Dolye JJ, Dolye JL. A rapid DNA isolation procedure for small quantities of fresh leaf tissue[J]. Phytochem Bul, 1987, 9(1):11-15.
[14] 许永华, 张爱华, 金慧, 等.人参种源遗传关系的ISSR分析[J].中草药, 2010, 41(7):1164-1167.
[15]闫伟红, 徐柱, 李临杭, 等.冰草属植物ISSR遗传分析与评价[J].华北农学报, 2010, 25(增刊):60-64.
[16]苏亚蕊, 刘新浩, 李锁平.棉花种质资源多样性的ISSR聚类分析及主成分分析[J].河南大学学报:自然科学版, 2012,42(4):401-406.
(责任编辑 马鑫)
Studies on the Genetic Diversity of Polyscias by ISSR Marker
Zhang Guowu1Liu Xuefeng1Zhou Xinghua2Huang Tao3
(1.China Eucalypt Research Centre,Zhanjiang 524022;2. Yugan County Forestry Bureau,Yugan 335100;3. College of Landscape and Art,Jiangxi Agricultural University,Nanchang 330045)
In this study, nine species Polyscias leaves as experimental material, we analyzed the genetic diversity and relationship by ISSR markers, 9 stable and high polymorphism ISSR primers screened from 100 ISSR primers by optimized the system of PCR for Polyscias, a total of 70 bands were obtained by the polymorphic primers of 9 test specimens, including 61 polymorphic bands, the polymorphic percentage was 87.14%. The genetic similarity coefficients ranged from 0.346 9 to 0.816 3, suggesting that the substantial genetic divergence between some varieties. The clustering scheme showed that Polyscias had small differences of genetypes their genetic basis was comparatively narrow.
ISSR;Polyscias;foliage plants;genetic similarity coefficient;cluster analysis
10.13560/j.cnki.biotech.bull.1985.2015.01.017
2014-04-29
中国林科院院基金项目(CAFYBB2012005)
张国武,男,博士,高级工程师,研究方向:森林培育;E-mail:fyzgwu@163.com
黄涛,男,硕士研究生,研究方向:园林植物栽培与应用;E-mail:htaovs2010@163.com
