鹰嘴豆蛋白降解产物的抗氧化作用
2015-10-25陈晓飞孙玉飞冯菲王雪妍周伏忠
陈晓飞 孙玉飞 冯菲 王雪妍 周伏忠
(河南省科学院生物研究所有限责任公司 河南省微生物工程重点试验室,郑州 450008)
鹰嘴豆蛋白降解产物的抗氧化作用
陈晓飞 孙玉飞 冯菲 王雪妍 周伏忠
(河南省科学院生物研究所有限责任公司 河南省微生物工程重点试验室,郑州 450008)
旨在分析鹰嘴豆分离蛋白(CPI)及其不同分子量短肽的抗氧化活性。用碱性蛋白酶(Alcalase)处理CPI,得到其降解产物,该降解产物经超滤离心,得到分子量分别为<3 kD、3-5 kD、5-10 kD及>10 kD的短肽。结果表明,与其它大分子肽段相比,<3 kD的短肽具有较强的自由基清除活性;与谷胱甘肽(GSH)相比,CPI及其不同分子量短肽具有显著的金属离子螯合活性;CPI及其肽段具有一定的三价铁离子还原能力。上述结果表明,CPI及其肽段的显著抗氧化活性,使得其具有制备抗氧化功能食品和保健品的应用前景。
鹰嘴豆分离蛋白(CPI);短肽;谷胱甘肽(GSH);自由基;抗氧化作用
活性氧和自由基是人体新陈代谢过程的次生代谢产物,正常情况下总是处于不断产生和消除的动态平衡中,但如果因产生过多或清除过少,致使其含量过高,动态平衡被破坏,就会引起氧化应激反应,从而引发癌症、冠心病、动脉粥样硬化、糖尿病、神经系统失灵、免疫力降低、关节炎等100多种常见疾病[1]。有研究表明,一些生物活性物质具有清除活性氧和自由基的抗氧化功能,这与其它生理功能,如免疫调节、降血压、降胆固醇、抗肿瘤等都有一定的联系,可能是其它生理功能的基础[2]。目前有报道指出,通过补充抗氧化物质,如食用抗氧化功能食品或保健食品,防止活性氧和自由基对细胞和组织的损伤,是预防多种疾病的有效措施之一[3],而食用功能性抗氧化食品是一种既方便又有效的补充抗氧化剂的方法。因此,开发具有抗氧化功能的食品和保健食品对预防和治疗多种慢性疾病具有重要意义。
鹰嘴豆(Chickpea)学名Cicer arietinum L.,一年生或越年生草本植物,因其籽粒形状酷似鹰嘴而得名,又名鸡头豆、脑黑豆等,是野豌豆族鹰嘴豆属植物中的一个栽培品种,是世界第二大消费豆类,中国新疆是鹰嘴豆的主要产地之一[4,5]。鹰嘴豆富含人类所需的多种糖类、植物蛋白和氨基酸、纤维素、维生素及无机盐,具有预防高血压及动脉粥样硬化、降低胆固醇和血脂血糖,利尿、治疗失眠等作用[6-9]。李艳红等[10]的研究表明,用蛋白酶处理鹰嘴豆分离蛋白,在水解度为15%时,其酶解产物(鹰嘴豆短肽),具有显著的抗氧化功能,但他们并没有将短肽按照分子量不同分开,而有研究表明[11,12],经碱性蛋白酶降解后,可能因为不同分子量短肽的某些氨基酸含量不同,导致其抗氧化活性不同。因此,本研究将鹰嘴豆分离蛋白用蛋白酶水解后,测定不同分子量短肽的抗氧化功能,以期为鹰嘴豆短肽的开发利用提供试验依据。
1 材料与方法
1.1 材料
鹰嘴豆为市售商品;碱性蛋白酶(Alcalase)购自南宁庞博生物工程公司;DPPH、菲洛嗪和邻二氮为Sigma产品;谷胱甘肽购自Solarbio公司;其它试剂均为国产分析纯。
1.2 方法
鹰嘴豆分离蛋白(Chickpea protein isolates,简称CPI)的制备参考陈晓飞等[13]的方法。
1.2.1 鹰嘴豆短肽的制备 鹰嘴豆短肽的制备参考Comfort[3]的方法,将CPI溶于蒸馏水中(2%,W/W),55℃预热20 min,调pH8.5,加入碱性蛋白酶至[E]/[S]为4%,混匀后不断滴加2 mol/L NaOH,以维持pH8.5不变,反应持续4 h,沸水浴15 min,后用2 mol/L HCl调pH4.0,以确保彻底灭活蛋白酶,并凝结未被降解的蛋白。反应液冷却至室温后,7 000×g离心30 min,上清液依次过截留分子量(MWCO)为3 kD、5 kD和10 kD的超滤离心管,即3 kD超滤管中的截留物通过5 kD的超滤管,截留物再通过10 kD的超滤管,从而分别获得分子量为<3 kD、3-5 kD、5-10 kD和>10 kD的肽段。CPI和不同分子量肽段的蛋白浓度用Lowry法[14]测定,后将其用蒸馏水稀释至1 mg/mL,置于-20℃冰箱中备用。
1.2.2 CPI及其水解片段的DPPH自由基清除活性测定 参考Shimada[15]的方法略有修改,用96孔板测定CPI及其水解片段清除DPPH自由基的活性。具体方法为,100 μL样品或谷胱甘肽(GSH)(1 mg/mL)+100 μL DPPH(0.1 mmol/L,溶于甲醇),混匀,室温避光静置30 min,测定517 nm处的吸光度,此为As(Asample);Ac(Acontrol)为100 μL水+100 μL DPPH的吸光度;Ab(Ablank)为100 μL甲醇+100 μL样品的吸光度,用1 mg/mL GSH代替样品作为阳性对照(以下试验均用GSH作阳性对照)。样品对DPPH自由基清除率的计算公式为:DPPH自由基清除率(%)=[1(-As-Ab)/Ac]×100%。
1.2.3 CPI及其水解片段的羟基自由基(·OH)清除活性测定 采用1,10-邻二氮菲比色法[16]测定CPI及其水解片段清除·OH的活性,邻二氮杂菲(3 mmol/L)溶于0.1 mol/L pH7.4的磷酸钠盐缓冲液(PBS)中,FeSO4(3 mmol/L)和0.01%双氧水(H2O2)溶于蒸馏水中,取50 μL的样品或GSH,加入96孔板中,后加入50 μL邻二氮杂菲,混匀,再加入50 μL的FeSO4混匀,最后加入50 μL H2O2,混匀加盖,37℃保温60 min,测定反应液536 nm处的吸光度,此为样品组(A1),并测定空白组(A2不含样品和H2O2)和对照组(A0不含样品)。·OH清除能力的计算公式为:SR%=[(A1-A0)/(A2-A0)]×100%。
1.2.4 CPI及其水解片段的超氧阴离子(·O2-)清除活性测定 采用邻苯三酚自氧化法[17]测定CPI及其水解片段的超氧阴离子清除活性,取80 μL 1 mg/mL样品或GSH,与80 μL 50 mmol/L pH8.3的Tris-HCl缓冲液(含1 mmol/L EDTA)加入96孔板中,随后加入40 μL邻苯三酚(1.5 mmol/L,溶于10 mmol/L HCl中),室温静置30 min测定420 nm处的吸光度,此为样品组(A1);对照组(A0)中不含肽段或GSH,空白组(A2不含邻苯三酚),·O2-清除能力的计算公式为:SR%=(A0- A1+A2)/ A0×100%。
1.2.5 CPI及其水解片段Fe3+还原能力测定 CPI及其水解片段Fe3+还原能力测定参考Wu[18]的方法略有修改,取250 μL样品或GSH与250 μL 1%的铁氰化钾水溶液混匀(对照中不含样品),50℃保温20 min,随后加入250 μL 10% TCA水溶液,混匀,5 000×g离心10 min,取100 μL上清液+与20 μL 0.1% FeCl3水溶液+80 μL蒸馏水混匀,室温静置10min,测定700 nm处吸光度。
1.2.6 CPI及其水解片段金属离子螯合活性测定参考Comfort[3]的方法测定CPI及其水解片段的金属离子螯合活性,1 850 μL样品或GSH+50 μL 2 mmol/L FeCl2混匀,加入100 μL 5 mmol/L菲洛嗪溶液(溶于生理盐水中),充分混匀,25℃静置10 min,取200 μL于96孔板中,测其562 nm处的吸光度,此为样品组(As),对照(Ac)中不含样品,空白对照(Ab)中不含菲洛嗪,金属离子螯合活性计算公式为:螯合活性(%)=[1-(As-Ab)/Ac]×100%。
2 结果
2.1 CPI及其水解片段的DPPH自由基清除活性
DPPH是一种脂溶性自由基,在517 nm处有最大吸收值,该自由基在遇到质子供体如抗氧化物的时候会被清除,517 nm处的吸光度下降。CPI及其不同分子量肽段清除DPPH自由基的能力(图1)显示,与CPI及其肽段相比,GSH对DPPH自由基的清除能力最强(91%)。<3 kD和3-5 kD两种短肽之间,清除DPPH自由基的能力没有显著差异(P>0.05),但均高于5-10 kD和>10 kD的短肽,而CPI则几乎没有DPPH自由基清除活性。结果表明,小分子质量短肽对DPPH自由基的清除能力较大分子质量短肽强。
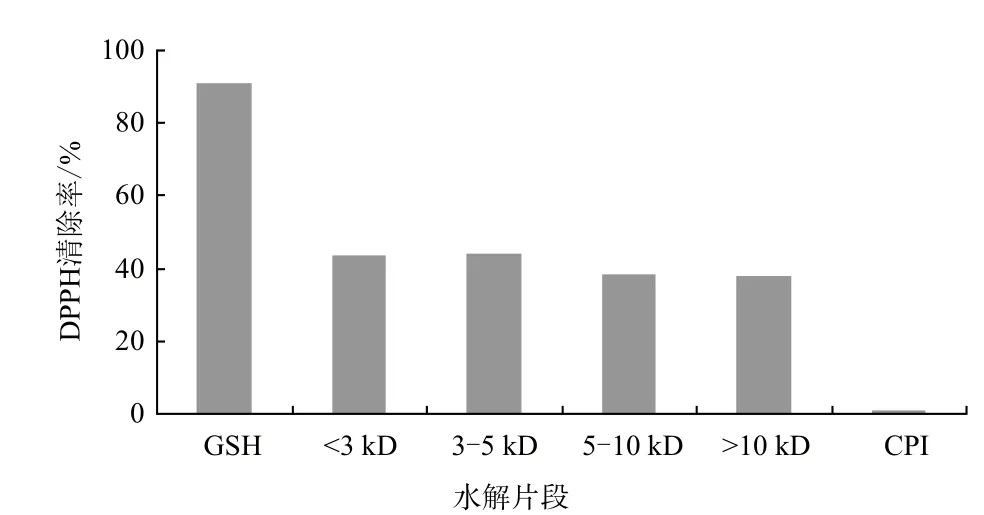
图1 CPI及其水解片段的DPPH自由基清除活性
2.2 CPI及其水解片段的羟基自由基(·OH)清除活性
·OH是氧自由基中最活跃的分子,在金属离子如铜离子和铁离子存在的时候,可以产生超氧离子和过氧化氢,并且可以严重破坏几乎所有可以接触到的生物大分子,如蛋白质、DNA、多不饱和脂肪酸、核酸等。CPI及其肽段清除·OH的能力(图2)显示,与GSH相比,CPI及其肽段清除·OH的能力要弱的多(P<0.05);而与<3 kD、3-5 kD、5-10 kD短肽及CPI相比,>10 kD的短肽具有最强的清除·OH的能力(20.08%)。

图2 CPI及其水解片段的·OH清除活性
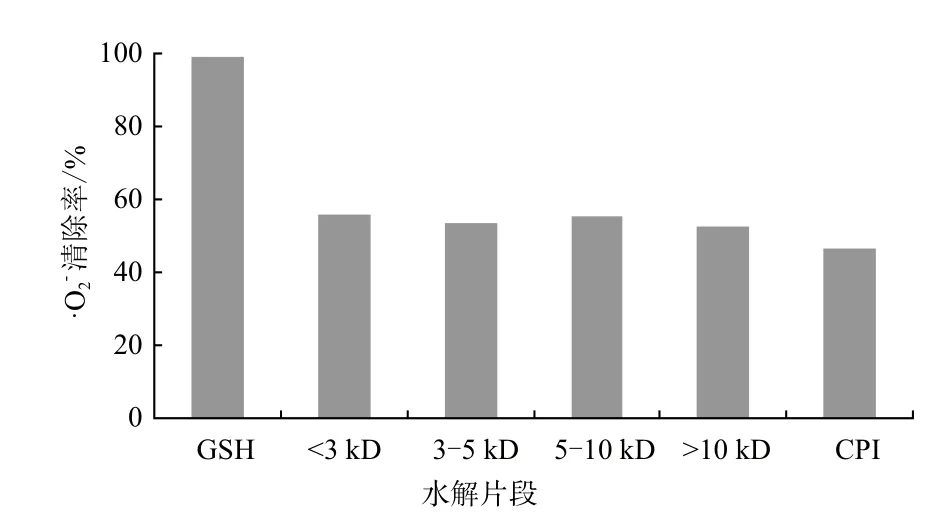
图3 CPI及其水解片段的·O2-清除活性
2.4 CPI及其水解片段的Fe3+还原能力
物质的还原能力,可以反映其潜在的抗氧化活性。本研究中,CPI及其水解片段的还原能力,通过将Fe3+还原为Fe2+,测700 nm处的吸光度来检测。图4显示,GSH的还原能力是CPI及其肽段还原能力的6倍以上。而与其不同分子量肽段相比,CPI的还原能力要低得多(P<0.05)。
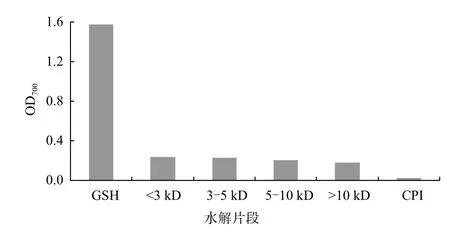
图4 CPI及其水解片段的Fe3+还原能力
2.5 CPI及其水解片段的金属离子螯合活性
过度状态的金属离子,如Fe2+能够催化活性氧的产生,进而引起脂肪的氧化反应,还可以催化Haber-Weiss反应,产生超氧离子和·OH,从而对组织产生严重的破坏,因此,抗氧化物对金属离子的螯合活性,可以抑制脂肪氧化。CPI及其水解片段对Fe2+的螯合能力(图5)表明,GSH没有金属离子螯合活性,CPI及肽段螯合活性非常强,且不同肽段相比,分子量越大,Fe2+螯合能力越强。
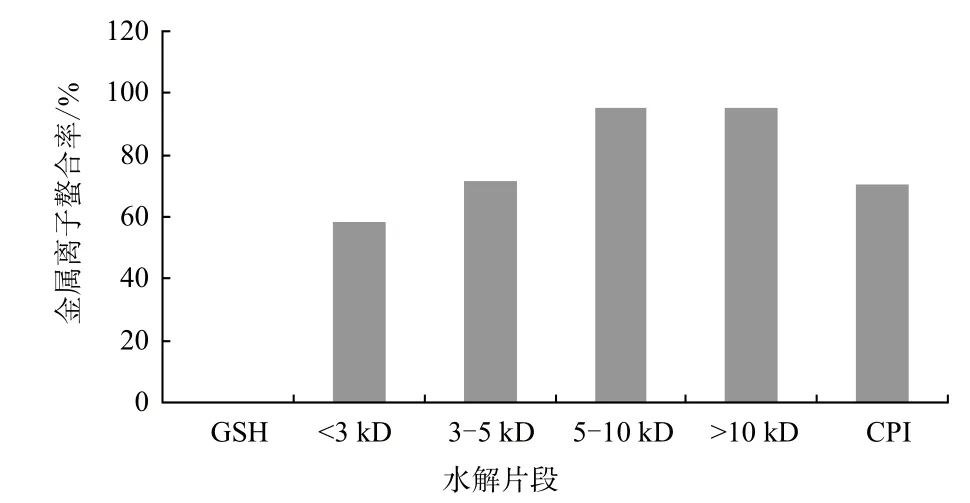
图5 CPI及其水解片段的金属离子螯合活性
3 讨论
物质清除DPPH自由基和还原Fe3+的活性,可以反映其潜在的抗氧化能力;而·OH能够引起脂肪的氧化,并严重破坏相邻的生物大分子,从而引起动脉粥样硬化、早衰、癌症等严重的疾病,而超氧阴离子自由基和过度状态的金属离子则可以加快脂肪的氧化反应,并产生·OH自由基,因此,清除·OH和超氧阴离子自由基及螯合金属离子在延迟脂肪氧化及预防疾病上非常重要,而且还可以减轻对依赖金属离子的食物脂肪氧化的破坏影响,从而起到食物防腐的作用。
本试验测定了CPI及其短肽的自由基清除、Fe3+还原及金属离子螯合等抗氧化活性。结果表明,鹰嘴豆短肽具有较强的清除DPPH、·OH和超氧阴离子自由基的能力,且这种自由基清除能力可能与短肽的分子量大小有关,这与之前Li[19]的报道及Girgih[16]关于非洲豆薯籽粒蛋白降解产物清除自由基的报道相似;试验结果还可以看出,CPI及其肽段具有较强的金属离子螯合能力,目前还未见CPI及其肽段相关方面的报道,这可能有效抑制脂肪氧化反应。因此,如果未来的研究证明这些短肽可以口服使用,将为人类预防血管中动脉粥样硬化斑块的形成提供一个新的有效途径,并可能进一步发展为抗心脑血管疾病发展的药物。总之,CPI及肽段在清除自由基和螯合金属离子上的作用表明,其具有发展为食源性抗氧化药剂的潜力,并可作为抗氧化(防腐剂)的自然资源,为食品保鲜。
4 结论
碱性蛋白酶水解CPI后,降解产物通过超滤离心得到不同分子量鹰嘴豆短肽(<3 kD、3-5 kD、5-10 kD及>10 kD),CPI及其短肽的抗氧化活性测定。结果表明,与其它大分子肽段相比,<3 kD的短肽具有较强的自由基清除活性(清除DPPH、·OH和超氧阴离子自由基的活性分别为43.6%、18.6%和55.7%);CPI及其不同分子量短肽具有较强的金属离子螯合活性(其中5-10 kD和>10 kD短肽活性最高,可达到95%以上)和一定的Fe3+还原能力。
[1]Zhu LJ, Chen J, Tang XY, et al. Reducing, radical scavenging,and chelation properties of in vitro digests of Alcalase-treated zein hydrolysate[J]. J Agric Food Chem, 2008, 56(8):2714-2721.
[2]Xiong YL, Decker EA. Alterations in muscle protein functionality by oxidative and antioxidative processes[J]. J Muscle Foods, 1995, 6(2):139-160.
[3]Ajibola CF, Fashakin JB, Fagbemi TN, et al. Effect of peptide size on antioxidant properties of african yam bean seed(Sphenostylisstenocarpa)protein hydrolysate fractions[J]. Int J Mol Sci, 2011,12(12):6685-6702.
[4]张玲, 王丽英, 夏作理.卡布里鹰嘴豆及豆芽微量元素含量分析[J].粮油食品科技, 2008, 16(3):39-41.
[5]马嫄, 杨瑞征, 孟晓, 等. 3种化学法提取鹰嘴豆水不溶性膳食纤维工艺的比较研究[J].粮油加工, 2009, 2:81-83.
[6]张涛, 江波, 沐万孟.酶法改性对鹰嘴豆分离蛋白功能性的影响[J].食品与发酵工业, 2007, 33(4):56-60.
[7]魏玲, 李学琴, 王莉, 等.反胶束体系萃取鹰嘴豆蛋白的工艺研究[J].中国粮油学报, 2007, 22(3):137-139.
[8]汪建红, 张婷, 张蔚佼, 等.鹰嘴豆多糖抗疲劳生物功效及其机制研究[J].食品工业, 2009, 5:1-3.
[9] 张涛, 江波, 沐万孟.鹰嘴豆分离蛋白分离纯化[J].食品科学,2008, 29(3):158-161.
[10]李艳红, 江波, 刘柱, 等.鹰嘴豆蛋白Alcalase水解工艺及其体外抗氧化活性的研究[J].浙江大学学报:农业与生命科学版, 2007, 33(4):392-399.
[11]Zhu KX, Zhou HM, Qian HF. Antioxidant and free radicalscavenging activities of wheat germ protein hydrolysates(WGPH)prepared with Alcalase[J]. Proc Biochem, 2006, 41:1296-1302.
[12]Rajapakse N, Mendis E, Byun HG, et al. Purification and in vitro antioxidative effects of giant squid muscle peptides on free radicalmediated oxidative systems[J]. J Nutr Biochem, 2005, 16:562-569.
[13]陈晓飞, 李锋, 周伏忠, 等.鹰嘴豆分离蛋白的酶解工艺研究[J].中国农学通报, 2013, 29(33):400-404.
[14] Markwell MA, Haas SM, Biebar LL, et al. A modification of the lowry procedure to simplify protein determination in membrane and in protein samples[J]. Anal Biochem, 1978, 87(1):206-210.
[15]Shimada K, Fujikawa K, Yahara K, et al. Antioxidative properties of xanthan on the autoxidation of soybean oil in cyclodextrin emulsion[J]. J Agric Food Chem, 1992, 40(6):945-948.
[16] Girgih AT, Udenigwe CC, Aluko RE. In vitro antioxidant properties of hemp seed(Cannabis sativa L.)protein hydrolysate fractions[J]. J Am Oil Chem Soc, 2011, 88(3):381-389.
[17] Pownall TL, Udenigwe CC, Aluko RE. Amino acid composition and antioxidant properties of pea seed(Pisum sativum L.)enzymatic protein hydrolysate fractions[J]. J Agric Food Chem, 2010, 58(8):4712-4718.
[18] Wu HC, Chen HM, Shiau CY. Free amino acids and peptides as related to antioxidant properties in protein hydrolysates of mackerel(Scomber austriasicus)[J]. Food Res Intl, 2003, 36:949-957.
[19] Li YH, Jiang B, Zhang T, et al. Antioxidant and free radicalscavenging activities of chickpea protein hydrolysate(CPH)[J]. Food Chem, 2008, 106:444-450.
(责任编辑 马鑫)
The Antioxidant Properties of Chickpea Protein Hydrolyzed Fractions
Chen Xiaofei Sun Yufei Feng Fei Wang Xueyan Zhou Fuzhong
(Institute of Biology Co.,Ltd.,Henan Academy of Sciences,Key Laboratory of Microbial Engineering of Henan Province,Zhengzhou 450008)
It was to assay the antioxidant activities of the Chickpea protein isolates(CPI)and its peptide fractions in vitro. CPI were hydrolyzed with alcalase, and the hydrolysates were further separated into peptide fractions of <3 kD, 3-5 kD, 5-10 kD and >10 kD, respectively,using membrane ultrafiltration. Results showed that, the <3 kD peptides exhibited better ferric reducing power and radicals scavenging activities when compared to peptide fractions of higher molecular weights. CPI and its peptide fractions had significant ability to chelate metal ions compared to glutathione(GSH), and also had some ferric reducing powers. The remarkable antioxidant properties indicate that CPI and its peptide fractions have the potential to be used in manufacturing antioxidant functional foods and healthy foods.
chickpea protein isolates(CPI);oligopeptide;glutathione(GSH);radicals;antioxidant properties
10.13560/j.cnki.biotech.bull.1985.2015.01.016
2014-08-11
河南省科技开放合作项目(142106000201),郑州市科技攻关计划项目(141PPTGG415)
陈晓飞,女,硕士研究生,助理研究员,研究方向:农业微生物技术;E-mail:chenfaye0318@163.com
周伏忠,男,硕士,研究员,研究方向:微生物工程与应用技术;E-mail:zdsyszfz001@163.com
