嗜麦芽窄食单胞菌在环保和农业生产上的应用
2015-10-25李昱龙韩正敏
李昱龙 韩正敏
(南京林业大学林学院,南京 210037)
嗜麦芽窄食单胞菌在环保和农业生产上的应用
李昱龙 韩正敏
(南京林业大学林学院,南京210037)
嗜麦芽窄食单胞菌广泛分布于大自然各种环境中,它的氧化代谢系统能够有效降解烷烃及多环芳香烃污染物并将其降解,同时该菌还具有吸附重金属的能力。嗜麦芽窄食单胞菌是典型的植物促生菌,能够分泌多种酶类、抗菌素和生长素等代谢产物,促进植物生长,防控真菌病害,抑制线虫生长。嗜麦芽窄食单胞菌的这些特性在环境污染治理、农林生产方面都有较大应用价值。通过综述嗜麦芽窄食单胞菌生物除污和植物促生的作用及机理,为嗜麦芽窄食单胞菌的进一步研究和应用提供参考依据。
嗜麦芽窄食单胞菌;环境修复;线虫防治;真菌防治;植物促生菌
嗜麦芽窄食单胞菌(Stenotrophomonas maltophilia)是革兰氏阴性菌,属于变形菌门,γ-β亚纲,窄食单胞菌属[1]。嗜麦芽窄食单胞菌在自然界中分布极广,科研人员已从植物根际、动物皮毛、昆虫体表、沼泽及深海分离到该菌[2-5]。嗜麦芽窄食单胞菌主要以植物内生菌及根际细菌的形式存在[6]。嗜麦芽窄食单胞菌同时具有生物除污、植物促生及生物防治等特性[5,7,8],并且也是人类的致病菌,能够引起较为严重的疾病,特别是在免疫缺陷病人之中有较高的死亡率[9],但引起人类疾病的和植物根际的嗜麦芽窄食单胞菌在生理和分子水平存在较高的种内分化[10]。本文将重点介绍嗜麦芽窄食单胞菌在环保及农业中的应用。
1 嗜麦芽窄食单胞菌概述
1.1 嗜麦芽窄食单胞菌一般特性
嗜麦芽窄食单胞菌是革兰氏阴性细菌,无芽孢,长约0.5-1.5 μm,可以依靠几根极鞭毛游动,有些菌株能够产生菌毛;单菌落光滑,能反光,具有整齐的边缘,白色、浅灰色或暗黄色[11]。嗜麦芽窄食单胞菌能利用硝酸盐,但一般不作为氮源,不能进行反硝化作用,最佳生长温度为25-30℃。嗜麦芽窄食单胞菌营养谱有限:145种有机化合物作为唯一碳源或能源的测试中,只有23种有机物能够使其生长[12]。
1961年,Hugh和Ryschenko[13]第一次发现该菌,并命名为嗜麦芽假单胞菌(Pseudomonas maltophila)。但假单胞菌属和黄单胞菌属有许多表型上的区别,如鞭毛类别、菌落颜色、胞外多糖、最适生长温度的不同等;1983年,Swing和De vos[14]将其改名为嗜麦芽黄单胞菌(Xanthomonas maltophilia);1993年,Palleroni和Bradbury根据一些特征区别(表1)又将其改名为嗜麦芽窄食单胞菌(S.maltophilia)[1]。

表1 嗜麦芽窄食单胞菌与其他菌属区别[15]
1.2 嗜麦芽窄食单胞菌国内外研究概况
嗜麦芽窄食单胞菌在环境保护、农林生产和临床医学等领域都有一定研究。根据这几类研究方向,完成了4株嗜麦芽窄食单胞菌全基因组测序(表2)。环境保护领域,嗜麦芽窄食单胞菌能够降解有害有机物及吸附有害金属离子。农林生产领域,嗜麦芽窄食单胞菌是典型的植物促生菌,能够帮助植物抵抗病害和胁迫环境。国内对嗜麦芽窄食单胞菌处理有害物质的种类、性质做了部分研究;国外对嗜麦芽窄食单胞菌分解有害物质的基因、相关蛋白作了进一步研究。国外对嗜麦芽窄食单胞菌防治植物真菌病害、植物促生机制以及抑制线虫生长有一定研究。
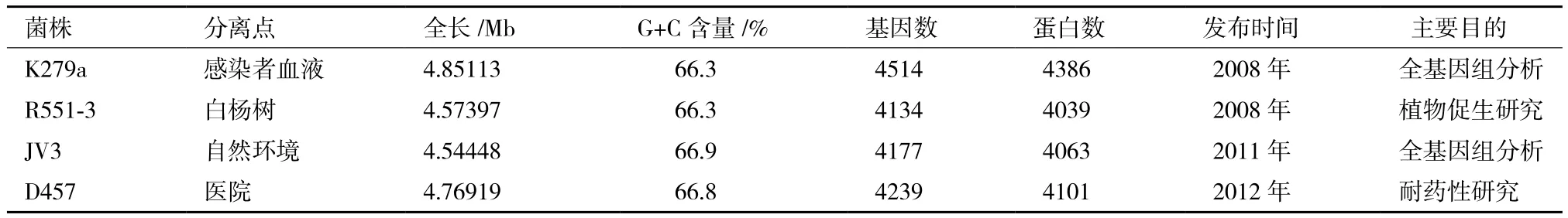
表2 嗜麦芽窄食单胞菌全基因组测序情况
嗜麦芽窄食单胞菌能定殖于人类体表、消化道、呼吸道及伤口。嗜麦芽窄食单胞菌是条件致病菌,免疫功能低下、肿瘤以及长期使用广谱抗生素和免疫抑制剂的人群容易感染该菌[16]。因其具有较强的抗生素耐受性,在各类感染者中难以治疗[17,18],因此嗜麦芽窄食单胞菌也是国内外临床医学研究的热点。
2 嗜麦芽窄食单胞菌在环境保护中的应用
有机及重金属污染普遍存在于人类生活环境中。石油污染物、多环芳香烃和化学农药等污染具有不易降解及可溶性的特点,能够长期存在于土壤中并污染地下水,难以得到较好的治理。现已在多种污染源,如油田、PAHs污染处、含有农药的害虫体表及各种重金属污染的水源等分离到嗜麦芽窄食单胞菌[19],这些嗜麦芽窄食单胞菌经实验证明能以碳循环的方式降解多种有机污染物,有效吸附并降低水体中重金属离子的浓度(表3)。因此嗜麦芽窄食单胞菌在修复农药、石油、化工及重金属等污染的土壤及水源都有较大应用潜力。
2.1 嗜麦芽窄食单胞菌对有害有机物降解作用
嗜麦芽窄食单胞菌可以有效地降解环境中的多环芳香烃(表3),有些菌株可把多种有机污染物作为主要碳源[19,20]。John等和Juhasz 等[21-23]发现嗜麦芽窄食单胞菌可以降解烷烃、苯、甲苯、乙苯、二甲苯、菲、六环并苯和苯并芘等有毒物质。Gür等[24]从亚洲蟑螂(Blattella asahinai)体表分离到的嗜麦芽窄食单胞菌SM OG2菌株可把α氯氰菊酯(杀虫剂)作为碳源。李兵等[25]从盘锦油田中分离的嗜麦芽窄食单胞菌 LHB16菌株能以石油烃作为唯一碳源并能将C15-C32的烷烃完全降解,嗜麦芽窄食单胞菌是微生物中能够降解多环芳香烃环数最多的细菌之一,可达6-7环[22]。
细菌降解有石油烃及PAHs的能力常与该菌是否含特定的氧化酶有关,且氧化酶活性直接影响细菌降解能力。嗜麦芽窄食单胞菌拥有多种不同的氧化酶活性,包括1,2-、2,3-、3,4-和9,10-多重双加氧酶活性[7,19],较高的超氧化物歧化酶及过氧化物酶活性,可以有效降低有毒有机物诱发的氧化损伤。这些可能是嗜麦芽窄食单胞菌具有较强降解烷烃及多环芳香烃能力的主要原因。

表3 已报道嗜麦芽窄食单胞菌能降解的物质
2.2 嗜麦芽窄食单胞菌对金属离子吸附作用
重金属污染不仅具有诱变、致癌等特性,还具有富集性,能通过食物链传递,最终对人体健康构成威胁。对于重金属污染的治理具有多种方法,生物吸附法具有效果好且成本较低等优点,具有较高的应用价值。
部分嗜麦芽窄食单胞菌菌株能耐受较高水平(0.1-50 mmol/L)的金属,包括镉(Cd)、铅(Pb)、钴(Co)、锌(Zn)、汞(Hg)、银(Ag)、铜(Cu)、金(Au)、亚硒酸盐(H2SeO3)及铀酰[29,30]。Holmes等[31]通过对同在污染源分离到的嗜麦芽窄食单胞菌O2菌株和肠杆菌属菌YSU(Enterobacter sp.)菌株进行耐受重金属MIC(Minimum inhibitory concentration)比较,发现嗜麦芽窄食单胞菌O2菌株对Hg(II)、Cd(II)、Zn(II)、Cu(II)、Au(III)、Cr(VI)、Ag(I)、As(III)和Se(IV)的耐受度普遍高于肠杆菌属菌YSU菌株。
嗜麦芽窄食单胞菌对于重金属污染的耐受可能包括以下几种路径:(1)外排泵,将胞内重金属排出胞外。对嗜麦芽窄食单胞菌K279a菌株的全基因组测序后发现该菌基因组中具有镉外排泵cad(Cadminm effux determinant)基因。(2)通过改变金属离子化学价将其转化为无毒害物质。嗜麦芽窄食单胞菌SeITE02菌株能在50 mmol/L亚硒酸盐中生长并将其转化为无毒的零价硒;嗜麦芽窄食单胞菌SM777菌株也能在25 mmol/L亚碲酸盐转化为零价碲[30,32]。(3)形成金属硫蛋白。嗜麦芽窄食单胞菌在应对镉离子时,细胞内半胱氨酸会有较大程度的增加。半胱氨酸作为一种含硫α-氨基酸可能参与重金属耐受,推测半胱氨酸可能参与Cd的配位隔离及硫化镉的形成,这与通常认为硫醇化合物能够为微生物抵抗重金属提供保护相符[33]。嗜麦芽窄食单胞菌在处理重金属污染时还涉及多种离子的交换,包括PO4
3-、K+、NH4+、Ca2+等,细胞膜表面疏水性逐渐降低通透性发生改变[34]。
嗜麦芽窄食单胞菌在降解有机化合物及吸附金属方面的能力已得到初步的验证。但对于该菌的除污研究的模式多在对单一污染物的降解或无毒化处理。在自然状态下,污染物的种类及浓度远比实验室复杂,对菌体除污能力具有多重影响。因此,在探索嗜麦芽窄食单胞菌生物修复机理的同时还应带入更为全面的污染物体系。细胞吸附金属时作为首先接触污染物的细胞表面成分如细胞膜、细胞壁和胞外多糖可能在吸附、富集金属离子可能起到首要作用,其次才是通过各种方式将多种金属离子进行无毒化处理。近来对嗜麦芽窄食单胞菌D457、K279a全基因组测序发现,该菌基因组内含有多种重金属耐受基因(表4),也为该菌在修复环境重金属污染的应用中提供重要依据。

表4 嗜麦芽窄食单胞菌K 279a、D457部分金属耐受基因[6,35]
3 嗜麦芽窄食单胞菌在农业中的应用
植物促生菌是一类有益于植物生长的根际微生物,这类微生物的促生作用的表现是生物固氮、诱导植物或本身适当分泌植物激素、提高土壤肥力以及抑制病原生长等有益于植物生长的作用。近年来,嗜麦芽窄食单胞菌的对农作物促生的潜力逐渐受到重视。现已从多种植物分离到该菌,如黄瓜、油菜、土豆、草莓、苜蓿、向日葵、玉米、水稻、小麦、柳树、杨树及多种野草[36-43]。嗜麦芽窄食单胞菌能通过多种机制与植物互作,能够较好地控制植物病害、促进植物生长、加强植物健康。嗜麦芽窄食单胞菌在农业上的应用可能有以下几点(图1):(1)生物固氮与分泌植物激素促进植株生长。(2)分泌抗菌素与多种酶防控病原微生物,降低植株感病率。(3)寄生线虫体表抑制线虫生长、降低线虫致病性,防治植物线虫病。(4)对有毒农药有较高耐受性,并可以将其分解,防止农药扩散污染低下水源。

图1 嗜麦芽窄食单胞菌在农林业上的应用
3.1 嗜麦芽窄食单胞菌分泌生长激素与固氮作用
从韩国忠北省农作物根际分离到的两株嗜麦芽窄食单胞菌PM-1菌株和PM-26菌株都具有产吲哚乙酸(IAA)及生物固氮的能力,以上两株菌在培养基上产生的IAA和固氮量分别都高于110 μg/mL及150 nmol/h·mg[44];从人参组织内分离到的嗜麦芽窄食单胞菌E-II-3菌株中也能检测到固氮酶基因nifH,但该菌并不具备产生植物生长素的能力[45]。嗜麦芽窄食单胞菌SSA菌株具有产生多种植物激素的能力,包括IAA、GA3(赤霉素)、t-zr(反式玉米素核苷)、ABA(脱落酸)[44]。然而,大量接种嗜麦芽窄食单胞菌e-p19菌株,产生过量IAA,结果抑制茎伸长,促进根和根毛的生长;因此只有在一定接种范围内才能够有植物促生效果,多于或者少于该范围都可能给植物生长带来负面效果[46]。
嗜麦芽窄食单胞菌能够帮助植物抵抗盐胁迫环境。嗜麦芽窄食单胞菌SSA菌株可以增加玉米幼苗对盐胁迫的耐受性[44],这可能与该菌在盐胁迫条件下产生一定的ABA有关。外施ABA能够引起植物体内ABA的增加,从而促进植物体内脯氨酸的生成[47,48]。脯氨酸分子量小,水溶性极强,是一种非常理想的渗透调节生理物质。脯氨酸积累并不局限于帮助植物抵抗盐胁迫环境,它还与植物抵抗干旱、低温、氧化等胁迫有关。因此,嗜麦芽窄食单胞菌合成的“外源”IAA也可能与帮助植物抵抗其他胁迫环境有关。
3.2 嗜麦芽窄食单胞菌对植物病害的防控作用
嗜麦芽窄食单胞菌的抗病潜能一直被人们所关注。目前已发现嗜麦芽窄食单胞菌对多种植物病原菌有抑制作用(表5)。该菌产生的初生新陈代谢产物如几丁质酶、蛋白酶、脂酶以及葡聚糖酶等和抗菌素类次生代谢产物Xanthobaccin及 Maltophilin都赋予该菌良好的生防能力。

表5 嗜麦芽窄食单胞菌防治的部分病害
嗜麦芽窄食单胞菌的生物防治功能酶的研究主要集中于几丁质酶。利用具有几丁质酶活性细菌能够有效防控植物病害,将细菌几丁质基因转入植物中也能提高植物对某些病原菌的抗病能力[49]。Ryan[50]报道嗜麦芽窄食单胞菌能用于植物真菌防控,如禾谷镰刀菌、棉花黄萎菌和终极腐霉等。Suma等与Swiontek等[51,52]发现嗜麦芽窄食单胞菌同时具有内/外切几丁质酶活性,对ChiA和ChiB基因的克隆发现,两者产物蛋白分子量分别是70.5 kD和41.6 kD,几丁质酶ChiA具有几丁质有内切活性,而几丁质酶ChiB同时具有内/外作用活性,这种双重几丁质分解活性在其他具有分解几丁质作用的生防菌中少有报道。仅将纯化的几丁质酶用于防治真菌病害,防治效果低于直接施用几丁质分解细菌[52];将嗜麦芽窄食单胞菌C5几丁质酶基因突变后,该菌株并没有完全丧失防控真菌的能力[53]。这些说明嗜麦芽窄食单胞菌的几丁质酶不是唯一抗真菌机制。其他报道的嗜麦芽窄食单胞菌防控真菌物质还有抗生素。Xanthobaccins及 Maltophilin是两种从嗜麦芽窄食单胞菌上提取到的抗生素。Maltopilin是大环内酰胺类抗生素,具有抗真菌活性,但对革兰氏阴性菌及革兰氏阳性菌无效。Xanthobaccin A、B、C同Maltophiln结构类似(图2),对真菌及卵菌有抗菌活性,但对细菌无效[54,55]。
嗜麦芽窄食单胞菌虽具有较强的生物防治能力。但是,自然界中有多种细菌,如芽孢杆菌BG-11菌株、吸水链霉菌、黏质沙雷氏菌、肠杆菌属NRG4菌株等都具有一定的真菌病害防控能力[52],混合使用各种抗病细菌也许能获得更好的防治效果。利用生物防控真菌病害对于减少或取代化学药品的施用,对创造环境友好型农业具有重要意义。

图2 Xanthobaccins A和M altophilin的结构
3.3 嗜麦芽窄食单胞菌对线虫病害的防控作用
自然界中植物寄生线虫种类多、数量大、寄主范围广,是一种全球性的植物病原,其危害程度仅仅低于真菌,常常造成较大农林业损失。而且线虫寄生植物后,会降低植物抵抗病原菌的能力或造成病菌侵染的伤口,使其他病原物更易侵染植物,诱发更多植物病害。
嗜麦芽窄食单胞菌是线虫的寄生菌,能够抑制线虫生长。线虫体表主要由蛋白、少量酯类及碳水化合物组成;线虫卵壳由一层几丁质及胶原类似蛋白组成,再被一层脂蛋白包裹[61-63]。这些都为细菌定殖提供了营养物质,同时也成为了防治线虫的热点。具有胞外蛋白酶、酯酶,以及几丁质酶的细菌也被作为研究防控植物寄生线虫的对象。Fegan等[64]发现嗜麦芽窄食单胞菌能在含有爪哇根结线虫(Meloidogyne javanica)卵的土壤中快速复苏;嗜麦芽窄食单胞菌的菌悬液能够分解辐射灭菌的线虫卵;在培养基里及土壤里嗜麦芽窄食单胞菌都能抑制马铃薯金线虫(Globodera rostochiensis)卵的孵化[65]。利用纯化的几丁质酶处理土豆内分离的胞囊线虫和马铃薯金线虫卵能有效抑制虫卵孵化,孵化率只有未用几丁质酶处理的30%[65]。Insunza等[66]从3 200株细菌中分离到能够抑制线虫的嗜麦芽窄食单胞菌ST58,与其他细菌相比,嗜麦芽窄食单胞菌ST58在土豆中抑制线虫活性最高,将该菌接种到含有毛刺线虫(Trichodorus spp.)的土豆上10周后,毛刺线虫总量降低了3/4。南京林业大学曾腓力等[67]从美国松材线虫(Bursaphelenchus xylophilus)体表分离得到一株嗜麦芽窄食单胞菌Smal-007,证明了这株菌在松材线虫防治上有一定潜力;刘侃诚[68]同时证明了这株细菌具有替代能力强,致病性弱等特点;孙惊天[69]通过室内外试验,进一步证明了该株细菌在林间能有效降低松树的枯死率。
4 结语
嗜麦芽窄食单胞菌在环境保护、植物促生以及植物病害防治都表现出较强的能力。国内对嗜麦芽窄食单胞菌生物除污已有一定的研究,但对于该菌生物防治的研究非常有限。在有机污染源常能分离到该菌,它还能以一些有机污染物为唯一碳源,说明该菌对某些有机污染源具有较强的应用潜能。嗜麦芽窄食单胞菌对苯及苯的衍生物的降解途径已经基本清楚,能够为该菌应用提供理论依据,但环境污染一般是复合污染,现在的研究多数只限于嗜麦芽窄食单胞菌对单一污染物的处理,因此该菌在复合污染下的表现更有研究和应用价值。农业应用方面,将嗜麦芽窄食单胞菌应用于植物促生与生物防治也有一定效果。然而,自然条件下各种客观因素较多,植物促生与植物病害往往是促生菌、寄主、病原以及生长环境等多方面互作的结果。现在对嗜麦芽窄食单胞菌的促生及生防作用的研究往往只表现在一两个方面,并没有对该菌在生防过程中对病原体、寄主以及其他根际微生物之间的相互作用做过全面的研究;嗜麦芽窄食单胞菌各种抗菌机理之间的协同作用以及该菌与其他抗病微生物的协同作用可能也是未来研究的重点。在田间和林间施用嗜麦芽窄食单胞菌可能同时具有植物促生与生物除污的复合功能,因此嗜麦芽窄食单胞菌有望将生物防治和生物除污有机结合并提升到新的高度。
[1] Moore ER, Krüger AS, Hauben L, et al. 16S rRNA gene sequence analyses and inter-and intrageneric relationships of Xanthomonas species and Stenotrophomonas ma ltophilia[J]. FEMS Microbiology Letters, 1997, 151(2):145-153.
[2] Denton M, Kerr KG. Microbiological and clinical aspects of infection associated with Stenotrophomonas maltophilia[J]. Clinical Microbiology Reviews, 1998, 11(1):57-80.
[3] Romanenko LA, Uchino M, Tanaka N, et al. Occurrence and antagonistic potential of Stenotrophomonas strains isolated from deep-sea invertebrates[J]. Arch Microbiol, 2008, 189(4):337-344.
[4] Berg G, Marten P, Ballin G. Stenotrophomonas maltophilia in the rhizosphere of oilseed rape—occurrence, characterization and interaction with phytopathogenic fungi[J]. Microbiological Research, 1996, 151(1):19-27.
[5] Minkwitz A, Berg G. Comparison of antifungal activities and 16S ribosomal DNA sequences of clinical and environmental isolates of Stenotrophomonas maltophilia[J]. J Clin Microbiol, 2001, 39(1):139-145.
[6] Brooke JS. Stenotrophomonas maltophilia:an emerging global opportunistic pathogen[J]. Clin Microbiol Rev, 2012, 25(1):2-41.
[7] Park M, Kim C, Yang J, et al. Isolation and characterization of diazotrophic growth promoting bacteria from rhizosphere of agricultural crops of Korea[J]. Microbiol Res, 2005, 160(2):127-133.
[8] Binks PR, Nicklin S, Bruce NC. Degradation of hexahydro-1, 3,5-trinitro-1, 3, 5-triazine(RDX)by Stenotrophomonas maltophilia PB1[J]. Applied and Environmental Microbiology, 1995, 61(4):1318-1322.
[9] Elvers K, Leem ing K, Lappin-Scott H. Binary culture biofilmformation by Stenotrophomonas maltophilia and Fusarium oxysporum[J]. Journal of Industrial Microbiology and Biotechnology, 2001,26(3):178-183.
[10] Turrientes MC, Baquero MR, Sánchez MB, et al. Polymorphic mutation frequencies of clinical and environmental Stenotrophomonas maltophilia populations[J]. Applied and Environmental Microbiology, 2010, 76(6):1746-1758.
[11] Fuerst J, Hayward A. Surface appendages similar to fimbriae(pili)on Pseudomonas species[J]. Journal of General Microbiology,1969, 58(2):227-237.
[12] Ikemoto S, Suzuki K, Kaneko T, et al. Characterization of strains of Pseudomonas maltophilia which do not require methionine[J]. International Journal of Systematic Bacteriology, 1980, 30(2):437-447.
[13] Hugh R, Ryschenkow E. Pseudomonas maltophilia, an Alcaligeneslike species[J]. Journal of General Microbiology, 1961, 26(1):123-132.
[14] Swings J, De Vos P, den Mooter MV, et al. Transfer of Pseudomonas maltophilia hugh 1981 to the genus Xanthomonas as Xanthomonas maltophilia(Hugh 1981)comb. nov[J]. International Journal of Systematic Bacteriology, 1983, 33(2):409-413.
[15] Palleroni NJ, Bradbury JF. Stenotrophomonas, a new bacterial genus for Xanthomonas maltophilia(Hugh 1980)Swings et al. 1983[J]. International Journal of Systematic Bacteriology, 1993,43(3):606-609.
[16] 胡田雨, 曲俊彦, 谢轶, 等. 嗜麦芽窄食单胞菌感染的危险因素及耐药性分析[J]. 中国感染与化疗杂志, 2014, 14(2):112-115.
[17] 宁立芬, 马红玲, 汪玉珍. 2011-2012 年铜绿假单胞菌对抗菌药物耐药性分析[J]. 中华医院感染学杂志, 2014, 24(5):1134-1135.
[18] 焦江琴, 李捷, 陈双双. 嗜麦芽窄食单胞菌鉴定及对抗生素的敏感性分析[J]. 医学综述, 2014, 20(3):553-554.
[19] Gao S, Seo JS, Wang J, et al. Multiple degradation pathways of phenanthrene by Stenotrophomonas ma ltophilia C6[J]. International Biodeterioration & Biodegradation, 2013, 79(Complete):98-104.
[20] 章俭, 夏春谷. 芳香烃双加氧酶的结构与功能研究[J]. 化学进展, 2004, 16(1):116-122.
[21] John R, Essien J, Akpan S, et al. Polycyclic aromatic hydrocarbondegrading bacteria from aviation fuel spill site at Ibeno,Nigeria[J]. Bulletin of Environmental Contamination and Toxicology, 2012, 88(6):1014-1019.
[22] Juhasz AL, Stanley GA, Britz ML. Microbial degradation and detoxification of high molecular weight polycyclic aromatic hydrocarbons by Stenotrophomonas maltophilia strain VUN 10,003[J]. Letters in Applied Microbiology, 2000, 30(5):396-401.
[23] Juhasz AL, Stanley G, Britz M. Metabolite repression inhibits degradation of benzo[a]pyrene and dibenz[a, h]anthracene by Stenotrophomonas maltophilia VUN 10, 003[J]. Journal of Industrial Microbiology and Biotechnology, 2002, 28(2):88-96.
[24] Gür Ö, Özdal M, A lgur ÖF. Biodegradation of the synthetic pyrethroid insecticide α-cypermethrin by Stenotrophomonas maltophilia OG2[J]. Turkish Journal of Biology, 2014, 38:684-689.
[25] 李兵, 张庆芳, 窦少华, 等. 低温石油烃降解菌 LHB16 的筛选及降解特性[J]. 大连大学学报, 2010(6):72-74.
[26] Lu Z, Sang L, Li Z, et al. Catalase and superoxide dismutase activities in a Stenotrophomonas maltophilia WZ2 resistant to herbicide pollution[J]. Ecotoxicol Environ Saf, 2009, 72(1):136-143.
[27] Urszula G, Izabela G, Danuta W, et al. Isolation and characterization of a novel strain of Stenotrophomonas maltophilia possessing various dioxygenases for monocyclic hydrocarbon degradation[J]. Brazilian Journal of Microbiology, 2009, 40(2):285-291.
[28] Lee EY, Jun YS, Cho KS, et al. Degradation Characteristics of Toluene, Benzene, Ethylbenzene, and Xylene by Stenotrophomonas maltophilia T3-c[J]. Journal of the Air & Waste Management Association, 2002, 52(4):400-406.
[29] Benson SB, Osborne TR, Revis NW. Reduction of trace elements to the elemental form by m icroorganisms:United States,4728427[P]1988. 1. 3.
[30] Pages D, Rose J, Conrod S, et al. Heavy metal tolerance in Stenotrophomonas maltophilia[J]. PLoS One, 2008, 3(2):e1539.
[31] Holmes A, Vinayak A, Benton C, et al. Comparison of two multimetal resistant bacterial strains:Enterobacter sp. YSU and Stenotrophomonas maltophilia ORO2[J]. Current Microbiology,2009, 59(5):526-531.
[32] Antonioli P, Lampis S, Chesini I, et al. Stenotrophomonas ma ltophilia SeITE02, a new bacterial strain suitab le for bioremediation of selenite-con tam inated environmental matrices[J]. Appl Environ Microbiol, 2007, 73(21):6854-6863.
[33] Fauchon M, Lagniel G, Aude JC, et al. Sulfur sparing in the yeast proteome in response to sulfur demand[J]. Molecular Cell, 2002,9(4):713-723.
[34] 陈烁娜, 尹华, 叶锦韶, 等. 嗜麦芽窄食单胞菌处理苯并[a]芘-铜复合污染过程中细胞表面特性的变化[J]. 化工学报,2012, 63(5):1592-1598.
[35] Crossman LC, Gould VC, Dow JM, et al. The complete genome,comparative and functional analysis of Stenotrophomonas maltophilia reveals an organism heavily shielded by drug resistance determinants[J]. Genome Biology, 2008, 9(4):R74.
[36] Mahaffee W, K loepper J. Temporal changes in the bacterial communities of soil, rhizosphere, and endorhiza associated with field-grown cucumber(Cucum is sativus L.)[J]. Microbial Ecology, 1997, 34(3):210-223.
[37] Berg G, Roskot N, Steidle A, et al. Plant-dependent genotypic and phenotypic diversity of antagonistic rhizobacteria isolated from different Verticillium host plants[J]. Applied and environmental Microbiology, 2002, 68(7):3328-3338.
[38] Schwieger F, Tebbe CC. Effect of field inoculation with Sinorhizobium meliloti L33 on the composition of bacterial communities in rhizospheres of a target plant(Medicago sativa)and a non-target plant(Chenopodium album)—linking of 16S rRNA gene-based single-strand conformation polymorphism community profiles to the diversity of cultivated bacteria[J]. Applied and Environmental Microbiology, 2000, 66(8):3556-3565.
[39] Chelius MK, Triplett EW. Immunolocalization of dinitrogenase reductase produced by Klebsiella pneumoniae in association with Zea mays L.[J]. Applied and Environmental Microbiology, 2000,66(2):783-787.
[40] Mehnaz S, Mirza MS, Haurat J, et al. Isolation and 16S rRNA sequence analysis of the beneficial bacteria from the rhizosphere of rice[J]. Canadian Journal of Microbiology, 2001, 47(2):110-117.
[41] Germida J, Siciliano S. Taxonomic diversity of bacteria associated with the roots of modern, recent and ancient wheat cultivars[J]. Biology and Fertility of Soils, 2001, 33(5):410-415.
[42] Sturz A, Matheson B, Arsenault W, et al. Weeds as a source of plant growth promoting rhizobacteria in agricultural soils[J]. Canadian Journal of Microbiology, 2001, 47(11):1013-1024.
[43] Taghavi S, Garafola C, Monchy S, et al. Mechanisms underlying the beneficial effects of endophytic bacteria on growth and development of poplar[J]. Applied and Environmental Microbiology, 2009,75:748-757.
[44] Naz I, Bano A. Assessment of phyohormones producing capacity of stenotrophomonas maltophilia SSA and its interaction with zea maysl[J]. Pakistan Journal of Botany, 2012, 44(1):465-469.
[45] Vendan RT, Yu YJ, Lee SH, et al. Diversity of endophytic bacteria in ginseng and their potential for plant growth promotion[J]. The Journal of Microbiology, 2010, 48(5):559-565.
[46] Suckstorff I, Berg G. Evidence for dose-dependent effects on plant growth by Stenotrophomonas strains from different origins[J]. Journal of Applied Microbiology, 2003, 95(4):656-663.
[47] 许祥明, 叶和春. 脯氨酸代谢与植物抗渗透胁迫的研究进展[J]. 植物学通报, 2000, 17(6):536-542.
[48] 王丽媛, 丁国华, 黎莉. 脯氨酸代谢的研究进展[J]. 哈尔滨师范大学自然科学学报, 2010(2):84-89.
[49] Lund P, Lee RY, Dunsmuir P. Bacterial chitinase is modified and secreted in transgenic tobacco[J]. Plant Physiology, 1989, 91(1):130-135.
[50] Ryan RP, Monchy S, Cardinale M, et al. The versatility and adaptation of bacteria from the genus Stenotrophomonas[J]. Nat Rev Microbiol, 2009, 7(7):514-525.
[51] Suma K, Podile AR. Chitinase A from Stenotrophomonas maltophilia shows transglycosylation and antifungal activities[J]. Bioresour Technol, 2013, 133:213-220.
[52] Swiontek Brzezinska M, Jankiewicz U, Burkowska A, et al. Chitinolytic microorganisms and their possible application in environmental protection[J]. Curr Microbiol, 2014, 68(1):71-81.
[53] Kobayashi DY, Reedy RM, Bick J, et al. Characterization of a chitinase gene from Stenotrophomonas maltophilia strain 34S1 and its involvement in biological control[J]. Applied and Environmental Microbiology, 2002, 68(3):1047-1054.
[54] Nakayama T, Homma Y, Hashidoko Y, et al. Possible role of xanthobaccins produced by Stenotrophomonas sp. strain SB-K88 insuppression of sugar beet damping-off disease[J]. Applied and Environmental Microbiology, 1999, 65(10):4334-4339.
[55] Jakobi M, Winkelmann G, Kaiser D, et al. Maltophilin:a new antifungal compound produced by Stenotrophomonas maltophilia R3089[J]. The Journal of Antibiotics, 1996, 49(11):1101-1104.
[56] Dunne C, Moënne-Loccoz Y, de Bruijn FJ, et al. Overproduction of an inducible extracellular serine protease improves biological control of Pythium ultimum by Stenotrophomonas maltophilia strain W81[J]. Microbiology, 2000, 146(8):2069-2078.
[57] Kobayashi DY, Guglielmoni M, Clarke BB. Isolation of the chitinolytic bacteria xanthomonas maltophilia and serratia marcescens as biological control agents for summer patch disease of turfgrass[J]. Soil Biology and Biochemistry, 1995, 27(11):1479-1487.
[58] Dal Bello G, Monaco C, Simon M. Biological control of seedling blight of wheat caused by Fusarium graminearum with beneficial rhizosphere microorganisms[J]. World Journal of Microbiology and Biotechnology, 2002, 18(7):627-636.
[59] Messiha NAS, van Diepeningen AD, Farag NS, et al. Stenotrophomonas maltophilia:a new potential biocontrol agent of Ralstonia solanacearum, causal agent of potato brown rot[J]. European Journal of Plant Pathology, 2007, 118(3):211-225.
[60] Zhang Z, Yuen G, Sarath G, et al. Chitinases from the plant disease biocontrol agent, Stenotrophomonas maltophilia C3[J]. Phytopathology, 2001, 91(2):204-211.
[61] Bird AF, Bird J. The structure of nematodes[M]. Burlington: Academic Press, 1991.
[62] Mcclure MA, Bird A. The tylenchid(Nematoda)egg shell:formation of the egg shell in Meloidogyne javanica[J]. Parasitology, 1976, 72(1):29-39.
[63] Perry RN, W right DJ. The physiology and biochemistry of freeliving and plant-parasitic nematodes[M]. CAB International,1998.
[64] Fegan N. The interaction between chitinolytic bacteria and nematode eggs[D]. Queensland:The University of Queensland,1993:199.
[65] Cronin D, Moënne-Loccoz Y, Dunne C, et al. Inhibition of egg hatch of the potato cyst nematode Globodera rostochiensis by chitinaseproducing bacteria[J]. European Journal of Plant Pathology,1997, 103(5):433-440.
[66] Insunza V, Alström S, Eriksson K. Root bacteria from nematicidal plants and their biocontrol potential against trichodorid nematodes in potato[J]. Plant and Soil, 2002, 241(2):271-278.
[67] 曾腓力, 贲爱玲, 郑敬荣, 等. 美国松材线虫体表携带优势细菌的鉴定及致病性[J]. 浙江农林大学学报, 2012, 29(5):696-702.
[68] 刘侃陈. 松树萎蔫病生防细菌的研究[D]. 南京:南京林业大学, 2013.
[69] 孙景天. 美国菌株Smal-007对松树萎蔫病生防作用研究[D].南京:南京林业大学, 2014.
(责任编辑 狄艳红)
The Applicatioin of Stenotrophomonas maltophilia in Environmental Remediation and Agriculture
Li Yulong Han Zhengmin
(College of Forestry,Nanjing Forestry University,Nanjing210037)
Stenotrophomonas maltophilia is a gram-negative bacterium and widely distributed in nature. It has multiple dioxygenase that can biodegrade alkane and polycyclic aromatic hydrocarbons (PAHs), and also adsorb heavy metals. S. maltophilia is a kind of typical plant growth-promoting rhizobacteria. It can secrete various hydrolytic enzymes and secondary metabolites that enhance plant growth, prevent and control fungal diseases along with nematode. Owing to the above features, S. maltophilia possesses the significant application values in environmental remediation, agriculture and forestry. The mechanisms of bioremediation and plant growth-promoting of S. maltophilia are summarized, which is expected to provide a reference for further studies and application of S. maltophilia.
Stenotrophomonas maltophilia; environmental remediation; nematode control; fungus control; plant growth-promoting bacteria
10.13560/j.cnki.biotech.bull.1985.2015.08.006
2014-11-06
国家自然科学基金项目(30872026,31170600),林业公益性行业科研专项(20120450)
李昱龙,男,硕士,研究方向:微生物学;E-mail:lyjlylo@163.com
韩正敏,男,博士,研究方向:森林微生物;E-mail:zmhan@njfu.edu.cn
