植物表皮蜡质参与干旱胁迫的反应机制
2015-10-25韦百阳徐小静
韦百阳 徐小静
(中央民族大学生命与环境科学学院,北京 100081)
植物表皮蜡质参与干旱胁迫的反应机制
韦百阳 徐小静
(中央民族大学生命与环境科学学院,北京100081)
植物表皮是植物与外部环境直接接触的部位,包括具有立体网状结构的角质和填充其间并覆盖其上的蜡质。植物在适应外界环境的过程中,表皮蜡质形成了特殊的结构和复杂的化学组成。植物表皮蜡质最重要的功能是参与阻止植物非气孔性失水,提高植物对水分的利用效率,以实现对干旱环境的适应。干旱环境会导致植物表皮蜡质代谢的变化,这种变化最终通过调控基因表达来实现。目前已经发现了多个蜡质代谢相关基因参与了植物对干旱环境的适应,部分基因已经成功克隆并且用于改良农作物的抗旱性。但这些基因参与干旱响应的分子机制及其与ABA的关系并不很清楚。就植物适应水分胁迫而发生的包括蜡质组成和含量在内的代谢变化,以及该过程中所涉及的主要基因及其分子生物学研究进行综述。探讨表皮蜡质在植物适应干旱中的重要作用及其分子机制,可为农作物的抗旱育种提供新型的分子标记和重要靶基因,最终服务于农业生产实践。
植物表皮;水分胁迫;蜡质代谢;分子生物学
植物表皮蜡质是指覆盖在植物外表面的一类不溶于水而溶解于有机溶剂(氯仿、正己烷等)的脂类物质的总称,它与位于表皮细胞外具有致密网状结构的角质层共同组成了植物的表皮,构成了植物自我防护的最后一道屏障[1]。植物表皮控制着非气孔性失水,在植物抵御干旱环境过程中发挥重要作用[2,3]。目前对于植物表皮蜡质参与抵御干旱的机制研究很多,但对于一些关键化学组分的寻找,以及蜡质代谢关键基因的克隆及功能研究仍然有待深入。本文就近年来国内外对表皮蜡质在植物应对干旱逆境中的功能的研究,从生物学特性、化学组成、生理生态及分子生物学的角度阐述植物表皮蜡质参与干旱逆境胁迫反应的机制。
1 表皮蜡质的生物学特性
植物表皮蜡质多具有独特的三维结构,可分为外蜡质层和内蜡质层[1],外蜡质层是覆盖角质层外面的只有蜡质成分的结构,而内蜡质层是指填充在角质层网状结构内的蜡质层。表皮蜡质中的外蜡质层主要由可溶性的超长链脂肪酸(Very long chain fatty acids,VLCFAs)、烷烃、一级醇、二级醇、脂肪醛、酮类和酯类组成。而内蜡质层为无定型态,用电子显微镜不易观察到,除了主要含有VLCFAs及其衍生物外,还包括萜类和其它微量的次级代谢物,如固醇和类黄酮类物质[4]。植物表皮蜡质主要在植物表皮细胞中合成,然后被分泌到表皮细胞外,自发地形成柱状、棒状、管状、垂直板状、树枝状及伞状等多种形态的蜡质晶体[5]。Barthlott等[6]利用扫描电子显微镜观察了13 000多种植物的表皮蜡质的形态结构并进行了系统分类和命名发现,片状和管状是所有蜡质晶体结构中最主要的类型。蜡质的组成和形态结构与植物的种类及器官类型有关,还与植物的生长时期有关[7]。此外,环境的改变也会造成蜡质形态结构的改变,如光照、温度、湿度等。苘麻在干旱和低温的影响下,其叶表皮蜡质组分和形态也会发生改变[8]。生长在苯污染的水中的芦苇表皮蜡质晶体结构会发生改变[4]。
植物表皮在植物中最重要的功能是阻止植物组织内水分的非气孔性散失,有利于水分的保持[2]。此外,它还具有保护植物免受病虫害侵袭[9,10]、降低紫外线伤害[11]、维持植物表面清洁与植物表面防水[12]等功能,在植物抵御环境胁迫中具有非常重要的作用。
2 表皮蜡质与植物抗旱性的研究
2.1 表皮蜡质对于植物蒸腾作用的控制
植物蒸腾作用包括气孔蒸腾和角质蒸腾两个方面,其中表皮蜡质对植物角质蒸腾的控制最为直接。角质蒸腾主要受叶片表面理化特性的影响,如蜡质的厚度、蜡质的超微结构、角质单体的结构等,这些都会影响水分的通透和运输,使角质蒸腾受到影响[13,14]。郭彦军等[15]对不同品种紫花苜蓿的研究发现干旱胁迫时,不同品种气体交换参数与蜡质含量变化规律一致,说明叶表皮蜡质参与了控制水分散失的过程。气孔蒸腾由气孔导度控制,表皮蜡质可能也参与这个过程。张志飞等[16]对高羊茅的研究发现干旱胁迫下高羊茅的综合抗旱性指标与水分利用效率的相关性极显著,叶片表皮蜡质含量与水分利用效率存在显著正相关,这可能是高羊茅蜡质含量通过对气孔导度的调节来减少气孔蒸腾,从而提高水分利用效率。植物严重缺水时,气孔关闭,气孔导度下降,这时植物的角质蒸腾将成为植物失水的主要方面。在耐旱性植物中,角质膜和蜡质构成的植物表皮可以减少角质蒸腾中的非气孔性失水,能够在干旱情况下保证体内含有足够的水分[2,3,17]。
角质膜上蜡质分子的结构和排列是决定渗透性的主要因素[12],这涉及到蜡质组分脂肪酸链的末端、极性功能基团以及一些脂肪簇组分等[18]。水分运输的动力学研究表明,水分子作为一个小的、非离子性的、极性分子不仅能够在极性通道(专供离子和小的极性分子)里扩散,还能在亲脂性通道(专供亲脂性的非电解质)里扩散[19-21]。植物表面蜡质晶体的大小和位置对于决定水分扩散途径起非常重要的作用[22]。Mamrutha等[3]测定290个桑葚品种的表皮蜡质,探讨表皮蜡质与叶片持水量的关系,结果发现不同品种之间叶片持水量变化很大,而且与叶片蜡质含量、蜡质晶体大小和密度之间存在明显相关性。
2.2 表皮蜡质含量与抗旱性的关系
研究表明,表皮蜡质层在植物抗旱途径中起着重要的作用。Premchandra等[23]发现表皮蜡质可以作为植物表皮细胞内水分或溶解物向外扩散的屏障,所以一般认为表皮蜡质的含量和厚度会影响植物的水分蒸腾。Burow等[24]从辐射诱变的高粱KFS2012突变体中发现蜡质含量降低,叶片渗透性增大,水分散失加快,植株抗旱能力随之下降。Park等[25]用扫描电镜观察水稻WDL突变体叶表面,发现蜡质晶体形状不规则,有断裂现象和凝结现象,进一步分析发现该突变体角质蒸腾速率比野生型高2-3倍,抗旱能力较弱。Yang等[26]通过扫描电镜发现转CaMV35S∷BnLAS拟南芥叶表面覆盖有较多的蜡质,表皮蜡质层厚度增加,与对照相比,过表达植株含有更多的叶绿素,失水率降低,对抗旱能力更强。Broun等[27]在转蜡质相关基因WIN1的拟南芥和转WXP1的紫花苜蓿的研究中分别发现,蜡质含量增加可有效提高植物的抗旱性。
许多植物的蜡质缺失突变体(如拟南芥的cer突变体)都表现出了对环境中水分含量的敏感性,但目前对蜡质防止水分散失的详细机制还不很清楚。表皮蜡质对于植物的蒸腾起着至关重要的作用,但表皮蜡质的屏障保护作用不仅仅取决于它的厚度。Oliveira等[28]对巴西卡廷加群落植被和热带高草草原植被的抗旱性进行研究发现,前者的保水能力强于后者。对它们的蜡质组分分析后发现,卡廷加群落植被叶片角质层蜡质的主要成分是极性较低的三萜醇和C27-C33烷烃类物质,而热带高草草原植被的蜡质含有大量的极性较高的棕榈酮和熊果酸。推测不同的蜡质成分对植物水分蒸腾的影响是不同的,低极性物质能更有效的防止水分散失。Weng等[29]发现拟南芥lacs1 lacs2双缺失突变体叶表皮C29烷烃严重缺失。叶绿素浸提实验显示lacs1 lacs2双缺失突变体角质渗透率是野生型的4倍,其失水率也比野生型快,对干旱更为敏感。说明蜡质组分中烷类物质可能主要起着限制水分散失的作用。Seo等[30]研究发现拟南芥活化myb96-1D突变体叶表面显著增加的蜡质含量中以醛类和烷烃类物质增加最为明显,而拟南芥缺失突变体myb96-1蜡质总量则明显减少。另发现与对照组相比,myb96-1D叶绿素浸提率和角质蒸腾较慢,而myb96-1叶绿素浸提率和角质蒸腾较快,表明角质层蜡质中醛类和烷烃类物质的增加提高了拟南芥的抗旱能力。Bourdenx等[31]研究发现在转CaMV35S∷CER1拟南芥植株中烷烃类的含量大幅增加,而其在CER1突变体中的含量则大幅减少。转CaMV35S∷CER1拟南芥植株角质层通透性比野生型和突变体的低,对干旱有更强的耐受力,这表明蜡质中烷烃类成分可能在拟南芥抗旱中发挥着重要作用。Xu等[32]的研究结果发现两种生态型的盐芥表皮脂类的厚度无明显差别,但表皮渗透性和耐旱性方面存在着明显的差异,主要原因可能在两种生态型盐芥在表皮脂类中的C24和C26酸含量上存在着明显差异。Vogg等[33]的研究结果显示,去除番茄外层蜡质对表皮水分的散失影响较小,而内表层蜡质脂肪族化合物比野生型低50%的突变体其表层水分散失比野生型高出4倍。由此认为限制角质蒸腾的因子可能是内表层蜡质的脂肪族化合物,而外表层蜡质则扮演着次要角色。
2.3 表皮蜡质与干旱胁迫相关的代谢基因
许多蜡质代谢相关基因的鉴定是通过筛选拟南芥的EMS突变体获得,普通植株表皮覆盖有一层粉白的蜡质,突变体的表面则变为亮绿色,通过观察表型获得了21种突变体,称为CER1-21(Eceriferum)[34]。CER1编码醛脱羰酶,导致蜡质成分中脂肪烃、二级醇、酮的含量急剧下降而醛的含量上升[35]。CER2主要在器官的表皮细胞中表达,它是酰基转移酶大家族中的一员,蜡质成分的变化表明它阻断C26[36]。CER3编码的蛋白与泛素连接酶有一定的同源性,CER3突变体中一级醇、一级烃的链长急剧上升,说明它不能从延伸复合体中释放出来,CER3能在所有组织中表达[37]。CER6基因编码一个在茎中和花粉中合成长链脂肪酸所需的延伸缩合酶,CER6基因参与了比C24长的脂肪酸延伸途径[38]。拟南芥中80%的蜡质组分由脱羰基途径产生。参与催化这条途径包含4个酶依次参与的酶促反应,包括β-酮脂酰-CoA 合酶(3-ketoacyl-CoA synthase,KCS)、β-酮脂酰-CoA 还原酶(β-ketoacyl-CoA reductase,KCR)、β-羟 脂 酰 -CoA 脱 水 酶(β-hydroxacyl-CoA dehydratase,HCD)和反式烯脂酰-CoA 还 原 酶(trans-2,3-enoyl-CoA reductase,ECR)[39]。KCS在蜡质合成的脱羧和酰基还原中起作用,第一个被分离的KCS基因是用转座子标签法从拟南芥突变体中克隆到的种子特异性基因FAE1[40]。拟南芥KCS基因家族有21个基因成员,根据氨基酸序列同源性可划分为FAE1、KCS1、FDH、CER6四个亚组[41]。第一个被分离的KCR基因是从玉米突变体glossy8中获得的,GLOSSY8在所有发育阶段与组织器官中均有表达[42]。
干旱胁迫引起植物表皮蜡质的变化主要是通过改变蜡质合成相关基因的表达来实现的。目前,已从拟南芥、水稻、苜蓿等多种植物中克隆出与抗旱相关的蜡质代谢基因,见表1[43]。
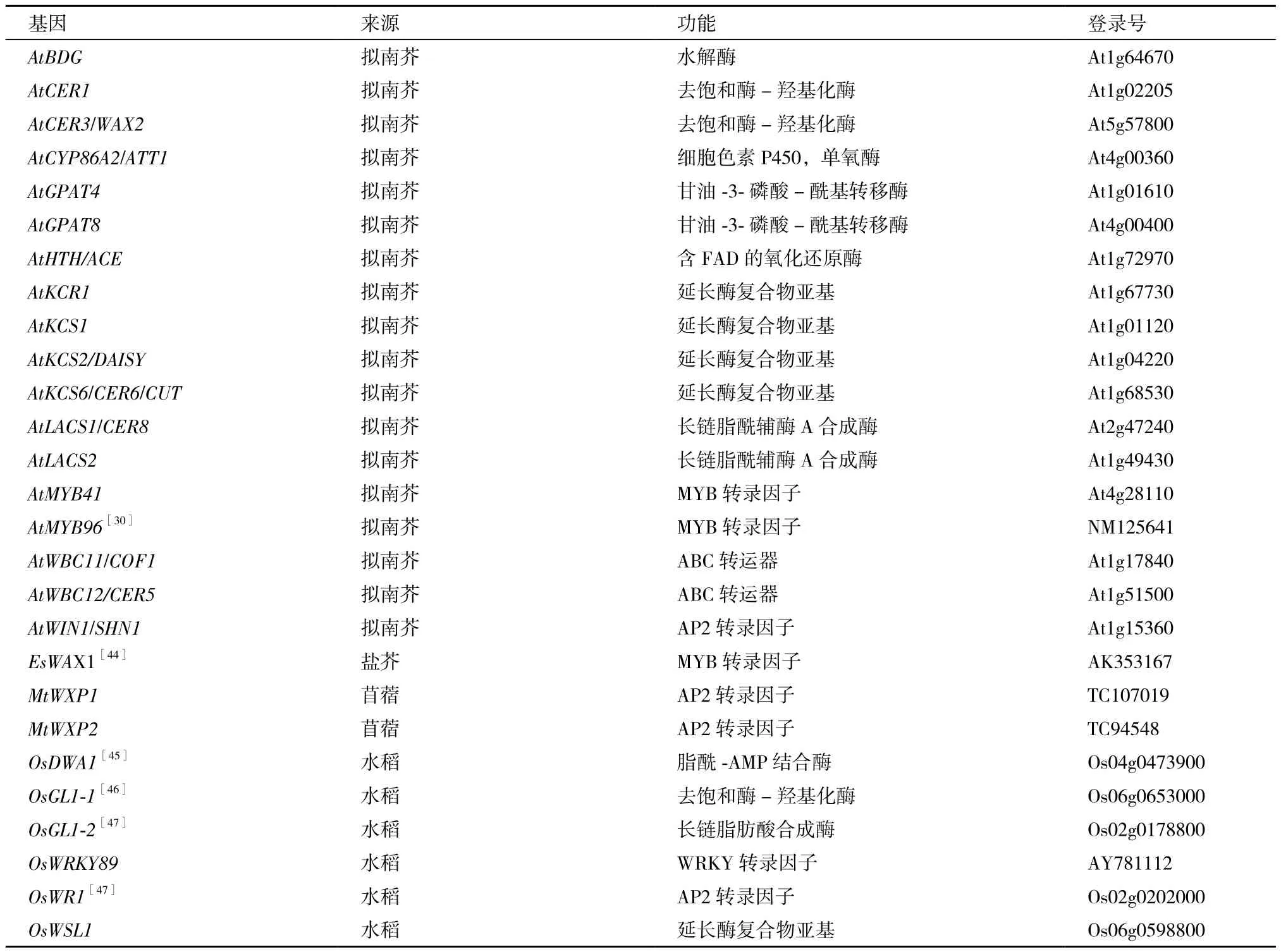
表1 与植物抗旱相关的蜡质代谢基因
2.4 ABA诱导表皮蜡质代谢相关基因的表达
干旱胁迫下,植物会产生包括气孔关闭、积累表皮蜡质和植物激素脱落酸(abscisic acid,ABA)等在内的一系列反应,这些反过来又会进一步提高植物的抗旱性。其中蜡质的代谢变化是植物响应干旱环境,进行自我调节的一种重要机制,这个过程中有诸多基因参与,这些基因与ABA的关系密切。缺水会诱导植物产生ABA,接着气孔会发生关闭并诱导非生物胁迫相关基因的表达[48]。ABA的合成受干旱的诱导,但许多蜡质有关基因受ABA诱导,却并不受干旱胁迫的诱导[49]。CER6参与长链(大于24C)脂肪酸的延伸,合成烃和醛,增加蜡质的合成,受离子胁迫(PEG)、盐和ABA强烈诱导,在有些情况下,CER6甚至比人们熟悉的RD29A基因表达更强烈[50]。来自蒺藜苜蓿的WXP1编码AP2/EREBP类型的转录因子,受冷害和ABA的强烈诱导,相比之下,受脱水诱导较弱[51]。而同为编码AP2/EREBP类型的转录因子WIN,在ABA和干旱胁迫下,表达量却下降。在紫苜蓿中过量表达WXP1,蜡质有关基因的表达与拟南芥中的同源基因存在变化,CER2和LCR同源基因表达上升,而WAX2和CER1表达下降;相反,在拟南芥中过量表达WIN1导致CER1、CER2和KCS1的积累[27]。在拟南芥中过量表达WIN1和在紫苜蓿中过量表达WXP1均造成叶片蜡质含量的增加,拟南芥叶片渗透性增加,而紫苜蓿叶片渗透性降低。与拟南芥不同的是,紫苜蓿的蜡质中醇类占优势,在这些植物中可能存在不同的蜡质合成途径。Rowland 等[52]报道蜡质相关的25个基因中受ABA诱导的达10个,而受离子和盐胁迫诱导的分别为6个和4个,所有受离子或盐胁迫诱导的基因均受ABA的诱导。筛选基因表达数据库发现有几个角质相关基因能够受ABA的诱导,但仅有极少数得到实验证实[43]。Kosma等[53]报道ABA能够诱导蜡质和角质有关基因的表达,包括ACC1、CER1、CER2、CER5、CER6、CER60、CYP86A2(ATT1)、KCS1和LACS2,其中受ABA诱导上调水平最高的为CER1。来自盐芥的EsWAX1基因受干旱和ABA的快速诱导,EsWAX1的表达会诱导CER1、KCS2、KCR1等基因的表达,导致蜡质的积累。拟南芥转入EsWAX1后,在RD29A启动子的驱动下EsWAX1的过表达植株中,叶正面表皮蜡质晶体的密度明显加大,抗旱性明显增强[44]。水稻干旱胁迫24 h后,DWA1基因表达急剧上调(24倍),ABA的处理下也明显上调。水稻dwa1突变体中,蜡质代谢转向脱羧基方向从而积累大量的烷烃,在长时间干旱胁迫下,叶表皮和蜡质产生明显缺陷,垂直片状晶体明显减少,有些区域甚至看不到晶体,叶片的失水速率和叶绿素透过率明显提高[45]。近年来,随着蜡质代谢相关基因的不断被分离,对它们的功能及其与ABA的关系也在深入研究之中,相信不久的将来蜡质代谢的分子机制将会逐步清晰。
3 表皮蜡质与盐胁迫所致的生理干旱的研究
盐胁迫可造成植物发生生理性干旱,这是由于高浓度的盐分降低了土壤水势,使植物吸水困难,甚至使体内水分外渗。一般植物在土壤含盐量达0.2%-0.25%时,吸水困难,高于0.4%时就外渗脱水。这种危害与土壤缺乏有效水分一样,是一种旱害,所以一般受盐分影响的植物都表现出植株矮小,叶小而蒸腾弱等干旱的症状。由于盐碱土的低渗透或植物表面的长期存在的盐雾,使得盐生植物适应了缺水的环境。许多海滨盐沼植物,如马兰草、黑松和盐芥等都积累了厚厚的蜡质层。这种加厚的蜡质层不仅对生长在盐碱地中的植物的水分缺失提供一个地上屏障,还可能会击退盐水的水滴[43]。
蜡质层可能会阻止有毒钠离子渗透到叶片中,适应了阻止盐离子进入叶片的植物的蜡质层可能具有独特的极性扩散途径[43]。高盐环境生长的碱蓬的蜡质层亚显微结构和蜡晶体形态发生了显著改变[43]。Waisely[54]认为盐胁迫下不仅可使表皮细胞壁增厚,而且可以诱导角质层增厚。邓彦斌等[55]对藜科植物叶片盐生结构的研究发现,在盐胁迫环境中生长的植物叶表皮蜡质化程度高。周波[56]研究发现,罗布麻能在干旱、盐碱环境中大量生存,是与其表皮细胞外被有大量的蜡质层密切相关。这种厚厚的蜡质层有利于植物减少水分蒸腾,从而适应其生长环境中含有大量盐分而造成的生理干旱。但Ristic等[57]的研究结果表明仅凭蜡质含量并不能权衡植物耐盐能力,还需考虑蜡质的晶体及其化学组成等生化性质。韦存虚等[58]利用扫描电镜和X射线电子探针对星星草的叶表皮及其与生境高盐的关系进行研究发现,表皮细胞外存在丰富的蜡质纹饰和蜡质颗粒,这些蜡质包含盐离子,具有泌盐的功能。这些特征表明星星草受外界生态因素的影响,而演化出具有泌盐功能的蜡质层来适应所生长的高盐生境。这与章英才[59]的观点一致,即认为在盐渍环境下蜡质层是否增厚要看盐生植物是否具有特殊的泌盐结构,即如果盐生植物叶表皮分化出特殊的泌盐结构——盐腺或盐毛,则其角质层无明显的增厚。
4 结语
表皮蜡质与植物对干旱环境的适应性之间存在密切联系,适应性研究的主要内容包括形态适应、生理和代谢适应[60],近年来这些方面的研究已经取得了很大进展。随着电镜技术和分析检测技术的发展,对蜡质形态结构和组成的研究已经取得了很大进展,并且在包括番茄[17,61]、辣椒[62]等在内的更多植物上进行了深入研究。在植物适应干旱环境过程中的一些关键代谢组分已经逐步被揭示,如拟南芥中的烷烃[53]、盐芥中的酸[32]等。植物能够适应干旱环境的本质是环境对基因表达的调控作用,其导致基因和蛋白质的差异表达和代谢水平的变化。虽然目前已经获得了一系列蜡质代谢相关基因,对这些基因的详细功能及表达调控方式仍然需要进一步研究,尤其是对蜡质代谢的关键基因开展深入研究,包括它们参与蜡质代谢调控中的具体作用及调控方式。ABA如何参与表皮蜡质的代谢调控也将是未来的一个重要研究方向。对参与蜡质代谢的酶和转运器等蛋白质方面的研究相对比较薄弱,尤其是转运器的详细功能有待揭示。对蜡质参与植物抗旱的机制研究具有重要意义,与抗旱相关的表皮蜡质中有效化学组分的获得,有望筛选到新型的抗旱相关的分子标记,用于植物遗传育种;候选基因的获得对于植物抗旱基因工程的发展具有重要作用,并具有生产和应用上的价值。总体来讲,植物表皮蜡质的研究是一个古老而又年青的领域,很多方面需要去深入探讨,我们相信对这个领域的研究也将会更好地为人类服务。
[1]Samuels L, Kunst L, Jetter R. Sealing plant surfaces:Cuticular wax formation by epidermal cells[J]. Annual Review of Plant Biology,2008, 59:683-707.
[2]Goodwin SM, Jenks MA. Plant cuticle function as a barrier to water loss[M]// Jenks M, Hasegawa PM, eds. Plant Abiotic Stress. Oxford:Blackwell Publishing, 2005.
[3]Mam rutha HM, Mogili T, Lakshmi KJ, et al. Leaf cuticular wax amount and crystal morphology regulate post-harvest water loss in mulberry(Morus species)[J]. Plant Physiology and Biochemistry,2010, 48:690-696.
[4]Macherius A, Kuschk P, Haertig C, et al. Composition changes in the cuticular surface lipids of the helophytes Phragmites australis and Juncus effuses as result of pollutant exposure[J]. Environmental Science and Pollution Research, 2011, 18(5):727-733.
[5]Kunst L, Samuels AL. Biosynthesis and secretion of plant cuticular wax[J]. Progress in Lipid Research, 2003, 42:51-80.
[6]Barthlott W, Neinhuis C, Cutler D, et al. Classification and terminology of plant epicuticular waxes[J]. Botanical Journal of the Linnean Society, 1998, 126:237-260.
[7]Post-Beittenmiller D. Biochemistry and molecular biology of wax production plants[J]. Annual Review of Plant Physiology and Plant Molecular Biology, 1996, 147:405-430.
[8]Valenti HH, Pitty A, Owen M. Environmental effects on vel-vetleaf(Abutilon theophrasti)epicuticular wax deposition and herbicide absorption[J]. Weed Sci, 2011, 59(1):14-21.
[9]Hansjakob A, Bischof S, Bringmann G, et al. Very-long-chain aldehydes promote in vitro prepenetration processes of Blumeria graminis in a dose-and chain length-dependent manner[J]. New Phytology, 2010, 188(4):1039-1054.
[10]Castillo L, Díaz M, González-Coloma A, et al. Clytostoma callistegioides(Bignoniaceae)wax extract with activity on aphid settling[J]. Phytochemistry, 2010, 71(17-18):2052-2057.
[11]Barnes JD, Percy KE, Paul ND, et al. The influence of UV-B radiation on the physicochemical nature of tobacco(Nicotiana tabacum L. )leaf surfaces[J]. Journal of Experimental Botany,1996, 47(1):99-109.
[12]Shepherd T, Griffithsd W. The effects of stress on plant cuticular waxes[J]. New Phytology, 2006, 171:469-499.
[13]Schreiber L, Riederer M. Ecophysiology of cuticular transpiration:comparative investigation of cuticular water permeability of plant species from different habitats[J]. Oecologia, 1996, 107:426-432.
[14]Chen G, Komatsuda T, Ma JF, et al. An ATP-binding cassette subfamily G full transporter is essential for the retention of leaf water in both wild barley and rice[J]. Proceedings of the National Academy of Sciences USA, 2011, 108:12354-12359.
[15]郭彦军, 韩龙, 唐华, 等. 水热胁迫对紫花苜蓿叶表皮蜡质组分及生理指标的影响[J]. 作物学报, 2011, 37(5):911-917.
[16]张志飞, 饶力群, 胡晓敏, 等. 高羊茅叶片表皮蜡质含量与其抗旱性的关系[J]. 西北植物学报, 2007, 27(7):1417-1421.
[17]Kosma DK, Parsons UP, Isaacson T, et al. Fruit cuticle lipid composition during development in tomato ripening mutants[J]. Physiologia Plantarum, 2010, 139:107-117.
[18]Jenks MA. Critical issues with the plant cuticle’s function in drought tolerance[M]//Biochemical and molecular responses of plants to the environment. KeralaInd:Research Signposts, 2002.
[19]Niederl S, Kirsch T, Riederer M, et al. Co-permeability of3H-labeled water and14C-labeld organic acids across isolated plant cuticles:investigating cuticular paths of diffusion and predictingcuticular transpiration[J]. Plant Physiology, 1998, 116:117-123.
[20]Schreiber L. Polar paths of diffusion across plant cuticles:New evidence for an old hypothesis[J]. Annals of Botany, 2005, 95:1069-1073.
[21]Schreiber L, Elshatshat S, Koch K, et al. AgCl precipitates in isolated cuticular membranes reduce rates of cuticular transpiration[J]. Planta, 2006, 223:283-290.
[22]Burghardt M, Riederer M. Cuticular transpiration[M]//Riederer M, Müller C, eds. Biology of the plant cuticle. Oxford:Blackwell Publishing, 2002.
[23]Premachandra GS, Saneoka H, Fujita K, et al. Leaf water relations,osmotic adjustment, cell membrane stability, epicuticular wax load and growth as affected by increasing water deficits in Sorghum[J]. Journal of Experimental Botany, 43(12):1569-1576.
[24]Burow GB, Franks CD, Xin Z. Genetic and physiological analysis of an irradiated bloom less mutant(epicuticular wax mutant)of sorghum[J]. Crop Science, 2008, 48(1):41-48.
[25]Park JJ, Jin P, Yoon J, et al. Mutation in Wilted Dwarf and Lethal 1(WDL1)causes abnormal cuticle formation and rapid water loss in rice[J]. Plant Molecular Biology, 2010, 74(1-2):91-103.
[26]Yang M, Yang QY, Fu TD, et al. Overexpression of the Brassica napus BnLAS gene in Arabidopsis affects plant development and increases drought tolerance[J]. Plant Cell Report, 2011, 30(3):373-388.
[27]Broun P, Poindexter P, Osborne E, et al. WIN1, a transcriptional activator of epidermal wax accumulation in Arabidopsis[J]. Proceedings of the National Academy of Sciences USA, 2004, 101:4706-4711.
[28]Oliveira AF, Meirelles ST, Salatino A. Epicuticular waxes from caatinga and cerrado species and their efficiency against water loss[J]. Anais da Academia Brasileira de Ciencias, 2003, 75(4):431-439.
[29]Weng H, Molina I, Shockey J, et al. Organ fusion and defective cuticle function in a lacs1 lacs2 double mutant of Arabidopsis[J]. Planta, 2010, 231(5):1089-1100.
[30]Seo PJ, Lee SB, Suh MC, et al. The MYB96 transcription factor regulates cuticular wax biosynthesis under drought conditions in Arabidopsis[J]. Plant Cell, 2011, 23(3):1138-1152.
[31]Bourdenx B, Bernard A, Domergue F, et al. Overexpression of Arabidopsis ECERIFERUM1 promotes wax Very-Long-Chain alkane biosynthesis and influences plant response to biotic and abiotic stresses[J]. Plant Physiology, 2011, 156(1):29-45.
[32]Xu X, Feng J, Lü S, et al. Leaf cuticular lipids on the Shandong and Yukon ecotypes of saltwater cress, Eutrema salsugineum,and their response to water deficiency and impact on cuticle permeability[J]. Physiologia Plantarum, 2014, 151(4):446-458.
[33]Vogg G, Fischer S, Leide J, et al. Tomato fruit cuticular waxes and their effects on transpiration barrier properties:functional characterization of amutant deficient in a very-long-chain fatty acidβ-ketoacyl-CoA synthase[J]. Journal of Experimental Botany, 2004, 55(401):1401-1410.
[34]Koornneef M, Hanhart CJ, Thiel F. A genetic and phenotypic description of eceriferum(cer)mutants in Arabidopsis thaliana[J]. Journal of Heredity, 1989, 80:118-122.
[35] Aarts MG, Keijzer CJ, Stiekema WJ, et al. Molecular characterization of the CER1 gene of Arabidopsis involved in epicuticular wax biosynthesis and pollen fertility[J]. Plant Cell, 1995, 7:2115-2127.
[36]Xia YJ, Nicolau BJ, Schnable PS. Cloning and characterization of CER2, an Arabidopsis gene that affects cuticu lar wax accumulation[J]. Plant Cell, 1996, 8:1291-1304.
[37]Hannoufa A, Negruk V, Eisner G, et al. The CER3 gene of Arabidopsis thaliana is expressed in leaves, stems, roots, flowers and apical meristems[J]. Plant Journal, 1996, 10(3):459-467.
[38]Fiebig A, Mayfield JA, Miley NL, et al. Alterations in CER6, a gene identical to CUT1, differentially affect long-chain lipid content on the surface of pollen and stems[J]. Plant Cell, 2000, 12:2001-2008.
[39]Kunst L, Samuels L. Plant cuticles shine:advances in wax biosynthesis and export[J]. Current Opinin of Plant Biololy,2009, 12:721-727.
[40]James DW Jr, Lim E, Keller J, et al. Directed tagging of the Arabidopsis FATTY ACID ELONGATION1(FAE1)gene with the maize transposon activator[J]. Plant Cell, 1995, 7(3):309-319.
[41]Paul S, Gable K, Beaudoin F, et al. Members of the ArabidopsisFAE1-like 3-ketoacyl-coA synthase gene family substitute for the elop proteins of Saccharomyces cerevisiae[J]. Jounal of Biological Chemistry, 2006, 281(14):9018-9029.
[42]Xu X, Dietrich CR, Lessire R, et al. The endoplasmic reticulumassociated maize GL8 protein is a component of the acyl-coenzyme A elongase ivolved in the production of cuticular waxes[J]. Plant Physiology, 2002, 128(3):924-934.
[43]Kosma DK, Jenks MA. Eco-physiological and molecular-genetic determinants of plant cuticle function in drought and salt stress tolerance[M]//Jenks MA, Hasegawa PM, Jain sm, eds, Advances in molecular breeding toward drought and salt tolerant crops. The Dordrecht:Netherlands Springer, 2007.
[44]Zhu L, Guo JS, Zhu J, et al. Enhanced expression of EsWAX1 improves d rought tolerance with increased accumu lation of cuticular wax and ascorbic acid in transgenic Arabidopsis[J]. Plant Physiology and Biochemistry, 2014, 75:24-35.
[45]Zhu XY, Xiong LZ. Putative megaenzyme DWA1 plays essential roles in drought resistance by regulating stress-induced wax deposition in rice[J]. Proceedings of the National Academy of Sciences USA, 2013, 29:17790-17795.
[46]Qin BX, Tang D, Huang J, et al. Rice OsGL1-1 is involved in leaf cuticular wax and cuticle membrane[J]. Molecular Plant, 2011,4(6):985-995.
[47]Wang Y, Wan L, Zhang L, et al. An ethylene response factor OsWR1 responsive to drought stress transcriptionally activates wax synthesis related genes and increases wax production in rice[J]. Plant Molecular Biology, 2012, 78(3):275-288.
[48]Shinozaki K, Yamaguchi-Shinozaki K. Gene networks involved in d rought stress response and tolerance[J]. Journal of Experimental Botany, 2007, 58:221-227.
[49]Zhu JK. Salt and drought stress signal transduction in plants[J]. Annual Review of Plant Biology, 2002, 53:247-273.
[50]Hooker TS, Millar AA, Kunst L, et al. Significance of the expression of the CER6 condensing enzyme for cuticular wax production in Arabidopsis[J]. Plant Physiology, 2002, 129:1568-1580.
[51]Zhang JY, Broeckling CD, Bancaflor EB, et al. Overexpression of WXP1, a putative Medicago truncatula AP2 domain-containing transcription factor gene, increases cuticular wax accumulation and enhances drought tolerance in transgenic alfalfa(Medicago sativa)[J]. Plant Journal, 2005, 42:689-707.
[52]Rowland O, Zheng H, Hepworth SR, et al. CER4 encodes an alcoholforming fatty acyl-Coenzyme A reductase involved in cuticular wax production in Arabidopsis[J]. Plant Physiology,2006, 142:866-877.
[53]Kosma DK, Bourdenx B, Bernard A, et al. The impact of water deficiency on leaf cuticle lipids of Arabidopsis[J]. Plant Physiology, 2009, 151(4):1918-1929.
[54] Waisely. Biology of halophytes[M]. New York:Academic Press, 1972:127.
[55]邓彦斌, 姜彦成, 刘健. 新疆10种藜科植物叶片和同化枝的旱生和盐生结构的研究[J]. 植物生态学报, 1998, 22(2):164-170.
[56]周波. 罗布麻解剖结构的研究[J]. 贵州工业大学学报,2005, 34(6):97-99.
[57]Ristic Z, Jenks MA. Leaf cuticle and water loss in maize lines differing in dehyd ration avoidance[J]. Journal of Plant Physiology, 2002, 159:645-651.
[58]韦存虚, 王建波, 陈义芳, 等. 盐生植物星星草叶表皮具有泌盐功能的蜡质层[J]. 生态学报, 2004, 24(11):2451-2456.
[59]章英才. 不同盐浓度环境中几种植物叶的比较解剖研究[J].安徽农业科学, 2006, 34(21):5374-5473.
[60] 祖元刚. 喜树高温和干旱逆境生态适应的分子机理[M]. 北京:科学出版社, 2010.
[61]Kimbara J, Yoshida M, Ito H, et al. Inhibition of CUTIN DEFICIENT 2 causes defects in cuticle function and structure and metabolite changes in tomato fruit[J]. Plant Cell Physiology,2013, 54(9):1535-1548.
[62]Parsons EP, Popopvsky S, Lohrey GT, et al. Fruit cuticle lipid composition and water loss in a diverse collection of pepper(Capsicum)[J]. Physiologia Plantarum, 2013, 149(2):160-174.
(责任编辑 狄艳红)
Response M echanism of Plant Cuticular W ax Involving in Drought Stress Response
Wei Baiyang Xu Xiaojing
(College of Life and Environmental Sciences,Minzu University of China,Beijing100081)
The plant cuticle, which connects with the external environment directly, is composed of an intermeshed cutin polyester membrane overlaid with free waxes. Plant cuticle forms specific structure and complex chemical composition in the long-term process of adaptation to outer environment. The most important function of cuticular wax is recognized as involving in blocking water loss through nonstomatal transpiration, thus improving the use efficiency of water in plant, and finally adapting to the drought environment. Drought stress can lead to metabolic changes in cuticular wax, which is eventually conducted through the regulation of gene expression. Recently, many wax metabolism-related genes involving in plant adaptation to drought stress have been discovered. Some genes have been cloned and used to improve the drought tolerance of crops. However, it is still not clear that the molecular mechanisms of these genes involve in drought tolerance as well as the relationship with ABA. Here, we review the changes of metabolism, including the composition and content of wax while plants adapting to water deficit conditions, and the main genes involved and their molecular biology. Understanding the role and molecular mechanism of cuticular wax in the adaptation of plants to drought may provide new molecular markers and important target genes for breeding the drought tolerance of agricultural crops, i.e., better service for agricultural practices.
plant cuticular;water deficit;wax metabolism; molecular biology
10.13560/j.cnki.biotech.bull.1985.2015.08.001
2014-12-02
国家自然科学基金项目(31470392),中央民族大学一流大学一流学科建设项目(YLDX01013)
韦百阳,男,硕士研究生,研究方向:植物次生代谢与调控;E-mail:weibaiyang777777@163.com
徐小静,女,副教授,硕士生导师,研究方向:植物次生代谢与调控;E-mail:xuxiaojing@muc.edu.cn
