新型脱氮菌Rhizobium radiobacter的分离鉴定及其硝化特征分析
2015-10-24罗小溪高建忠陈再忠于永亮
罗小溪 高建忠 陈再忠 于永亮
(上海海洋大学水产与生命学院,上海 201306)
新型脱氮菌Rhizobium radiobacter的分离鉴定及其硝化特征分析
罗小溪 高建忠 陈再忠 于永亮
(上海海洋大学水产与生命学院,上海201306)
旨在从污水处理厂中分离和鉴定具有硝化能力的脱氮菌。采用富集培养、平板划线分离菌株,命名为N312,并通过形态观察、16S rDNA基因序列分析及Biolog鉴定,利用正交试验法对该菌株的培养基配方进行优化。结果表明,分离获得具有硝化能力的自养脱氮菌,初步鉴定属于放射型根瘤菌(Rhizobium radiobacter),为革兰氏阴性杆菌,菌落圆形,乳白色,6 d内亚硝酸盐去除率达到100%,通过正交试验初步得到最佳培养基配方为NaNO21.5 g,Na2CO31.5 g,MgSO4·7H2O 0.25 g,FeSO4·7H2O 0.2 g,KH2PO40.5 g。菌株N312是一株具有研究价值的自养脱氮菌。
脱氮菌;16S rDNA;Biolog;正交试验;硝化速率
亚硝酸盐是氮循环的一部分,也是氨转化为硝酸盐过程中的中间产物[1]。在水产养殖的过程中,亚硝酸盐是养殖水体中的主要污染之一,它对养殖对象有一定的毒害作用。水体中亚硝酸盐超过一定浓度会导致鱼类缺氧甚至窒息死亡[2,3]。可见,亚硝酸盐已成为严重影响水质的因素之一。因此,去除水体中的亚硝酸盐对水质调控具有重要的意义。
生物脱氮是目前水处理领域中关注和研究的热点[4]。传统方法中,一般是使用硝化细菌进行脱氮,但是硝化细菌生长缓慢,培养困难,而且价格高[5],因此,亟待开发新的、高效的脱氮菌。根瘤菌的发现并证实其与豆科植物的共生有固氮作用已有上百年的历史[6],但其脱氮作用目前鲜有相关报道。关于应用根瘤菌的脱氮是对传统理论的丰富和突破。
本研究以某污水处理厂的活性污泥为分离源,通过富集和分离纯化等步骤,分离到一株具有去除亚硝态氮能力的细菌,命名为菌株N312。根据其形态、16S rDNA基因序列和Biolog鉴定系统,探讨该菌株的分类学地位,旨在为水族箱和养殖水体亚硝态氮处理的实际应用提供有效菌源。
1 材料与方法
1.1.1 试验材料 供试水样采自2014年4月上海市某污水处理厂的污水。试验于上海海洋大学观赏水族实验室进行,菌株N312从污水中筛选分离得到。
1.1.2 试验试剂 UNIQ-10柱式细菌基因组DNA抽提试剂盒、PCR Master Mix(2×)、PCR 引物、胶回收试剂盒购于生工生物工程(上海)股份有限公司,其他试剂(分析纯)购于国药集团化学试剂有限公司。
1.1.3 富集培养基[7]NaNO21.0 g,Na2CO31.0 g,MgSO4·7H2O 0. 5 g,FeSO4·7H2O 0.4 g,蒸馏水1 L定容,KH2PO40.5 g单独灭菌。
1.1.4 分离培养基 NaNO20.5 g,Na2CO30.5 g,MgSO4·7H2O 0.015 g,MnSO4·H2O 0.005 g,K2HPO40.5 g,NaH2PO40.5 g,蒸馏水 1 L定容,固体培养基加琼脂粉2%。
1.1.5 自配废水组成 NaNO21.0 g,Na2CO31.0 g,MgSO4·7H2O 0.5 g,FeSO4·7H2O 0.4 g,蒸馏水1 L定容,KH2PO40.5 g单独灭菌。
1.2 方法
其二为串通招投标。在药品、设备的采购过程中,参与招标的药企或设备供应商在利益的驱动下,暗行串通抬价之事侵占国有资产,加剧医疗保险基金流失。
1.2.1 菌株的富集 取10 mL污泥样品加到经灭菌(1×105Pa、30 min)处理分装有100 mL上述富集培养基的250 mL锥形瓶中,28℃、150 r/min摇床中振荡培养,富集培养5 d,设计对照组,做2个平行。每隔24 h定期检测NH4+-N和NO2
--N含量。当检测亚硝酸氮含量接近0时,添加20 mL富集培养基。每处理重复3次。
1.2.2 菌株的分离纯化 取NO2--N减少快的富集培养液,采用平板划线进行分离培养,28℃恒温、黑暗培养,观察有乳白色菌落后,挑取单菌落至分离平板,重复划线分离3次,得到纯培养。将此单菌接种到上述富集培养基中,28℃、150 r/min摇床中振荡培养,每隔24 h检测培养基上清液的NH4+-N和NO2
--N。
1.2.3 水质检测方法[8]的测定采用N-(1-萘基)-乙二胺分光光度法,的测定采用纳氏试剂分光光度法。
1.2.4 16S rDNA的PCR扩增、克隆与测序 参考黄毅[9]的方法,采用UNIQ-10柱式细菌基因组DNA抽提试剂盒提取细菌总DNA。通用引物,正向引物27F为5'-AGAGTTTGATCCTGGCTCAG-3',反向引物1492R为5'-GGTTACCTTGTTACGACTT-3'。
PCR反应体系(50 μL):PCR Master Mix(2×)25 μL,引物27F(0.2 μmol/L)1 μL,引物1492R(0.2 μmol/L)1 μL,模板DNA 1 μL,ddH2O 22 μL。
PCR 反应条件:94℃预变性5 min;94℃变性30 s,55℃退火30 s,72℃延伸90 s,循环30次;72℃终延伸10 min。PCR扩增产物经1.5%琼脂糖凝胶电泳检测后,采用胶回收试剂盒(San Prep Column DNA Gel Extraction Kit,Sangon Biotech)进行回收。纯化后的目的片段连接到pMD18-T载体,转化到大肠杆菌TOP10菌株中。经过蓝白斑筛选,培养菌液,利用M13通用引物进行PCR 扩增检测,取阳性克隆送生工生物工程(上海)股份有限公司。
1.2.5 系统发育分析 测序结果在GenBank核酸数据库中进行检索[10],选取同源性最高的序列并通过MEGA5.0软件进行比对和系统发育分析,构建进化树。
1.2.6 Biolog鉴定 挑取单个纯化菌种接种到Biolog专用接种液IF-A中,制成一定细胞浓度的菌悬液,用Turbidimeter进行校准,使细胞浓度在92%-96%范围内,然后用移液枪将菌悬液按每孔100 μL转接GenIII微孔板的96个孔内,做好标记然后放到33℃恒温生化培养箱培养4-6 h和16-24 h时在读数仪上读取菌株的代谢指纹特征,在Biolog数据库中进行相似性比对,查找最接近的结果。
1.2.7 培养基正交优化试验 为了研究菌株N312营养因子需要的影响,设计L9(33)培养基正交试验,3个关键因素分别为氮源、碳源和无机盐。其中,氮源(NaNO2)取0.5、1.0和1.5 g,碳源(Na2CO3)取0.5、1.0和1.5 g,无机盐(MgSO4·7H2O)取0.25、0.5和0.75 g。以硝化速率为依据,检验培养菌株N312的最佳培养基。
2 结果
2.1 形态观察结果
由图1可知,菌株N312在分离培养基上的菌落为乳白色,表面光滑,不透明,边缘整齐。革兰氏染色得到菌株N312形态(图2),为革兰氏阴性,油镜下观察为短杆状,单个排列。
图1 菌株N312筛选验证图

图2 细菌的革兰氏染色结果(1 000×)
2.2 硝化速率结果
2.3 菌株PCR扩增、克隆与测序结果
克隆后,利用M13通用引物进行PCR 扩增,经琼脂糖凝胶电泳检测,约在1 800 bp处有一明亮的条带(图4)。测序结果经在GenBank核酸数据库中进行检索,菌株N312与Rhizobium sp.同源性最高,GenBank数据库登录号为KM047639。从中选取同源性最高的4株菌株的16S rDNA基因序列进行比对并构建系统发育树。结果(图5)显示,N312与Rhizobium radiobacter GCIZ(AM157353)在同一分支上,一致性达到100%。
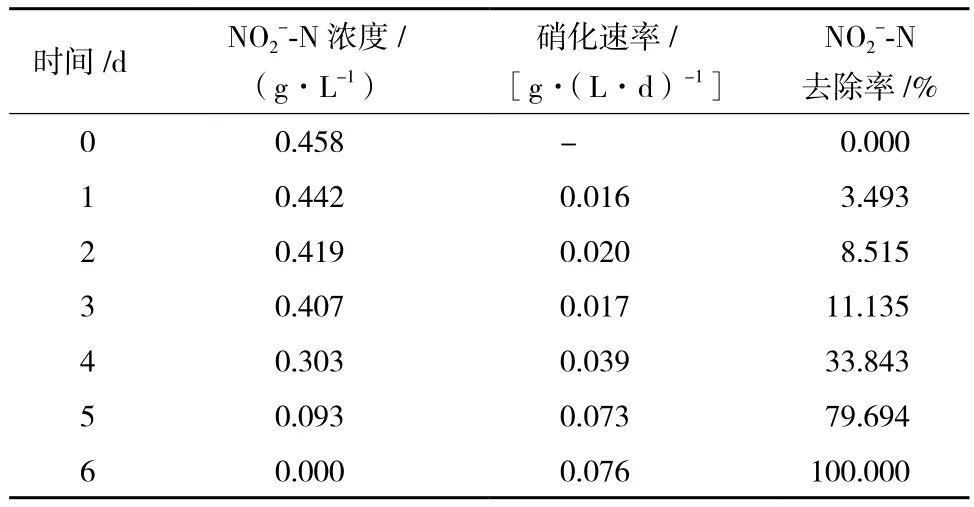
表1 自配废水中菌株N312的硝化作用结果
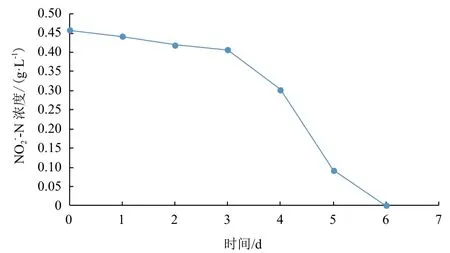
图3 菌株N312的NO2
--N降解曲线
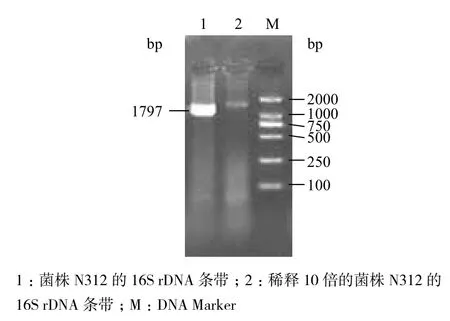
图4 菌株N312的 16S rDNA基因电泳图
2.4 Biolog全自动微生物鉴系统结果
Biolog GenIII 微孔板可以对微生物进行94种表型测试,其中包括:71种碳源利用测试(图6-图7,1-9列)以及23种化学敏感性测试(图6-图7,10-12列)。微生物在测试板上所显示出的“表型指纹”被用来在种的水平上鉴定该微生物,结果显示3个重要参数:可能性(PROB)、相似性(SIM)和位距(DIST)。培养4-6 h,ID 框中显示“No ID Yet”,表示结果不能匹配得很好。如图6所示,培养6 h,该菌株只与F11孔中的四唑紫发生阳性反应。培养16-24 h后,鉴定结果显示为绿色状态栏(Species ID),可知,菌株N312得到匹配好的结果(图7)。鉴定结果表明,菌株N312最具可能性为Rhizobium radiobacter,PROB值为≥0.5、SIM 值为0.535和DIST 值为6.922,是较为可信的鉴定结果。
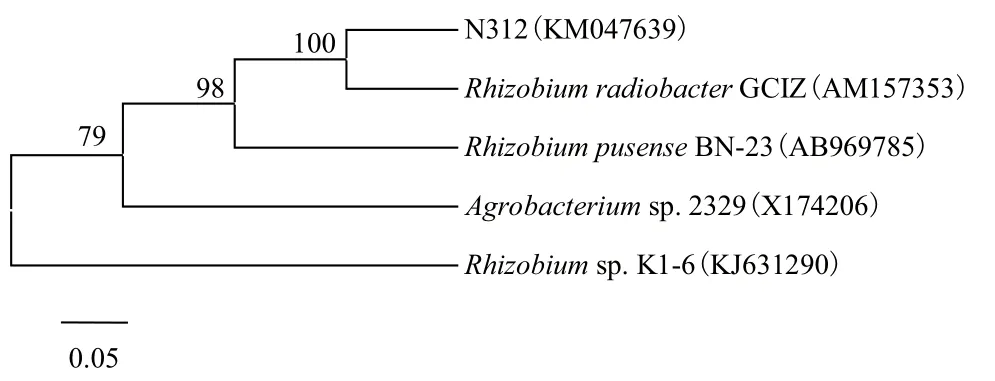
图5 菌株N312基于16S rDNA基因系统发育树
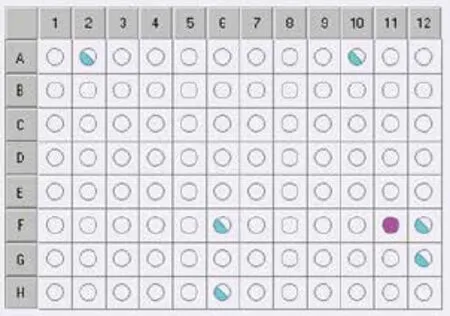
图6 菌株N312的Biolog代谢指纹特征图
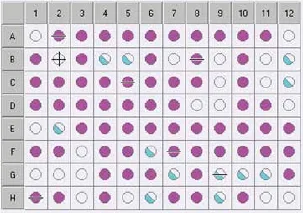
图7 菌株N312的Biolog代谢指纹特征图
2.5 培养基配方优化结果
通过L9(33)培养基正交试验,结果(表2)表明,不同的培养基对菌株N312的硝化速率有显著影响。表现最强的是7号培养基,硝化速率达到197.142 mg/L,硝化速率最弱的是2号培养基,仅有26.094 mg/L。由极差R值的大小可以判断,影响菌株N312硝化速率的3种因素的强弱顺序:NaNO2>MgSO4·7H2O >Na2CO3。由下表2可得知,培养基配方组合最佳培养基为NaNO21.5 g,Na2CO31.5 g,MgSO4·7H2O 0.25 g。
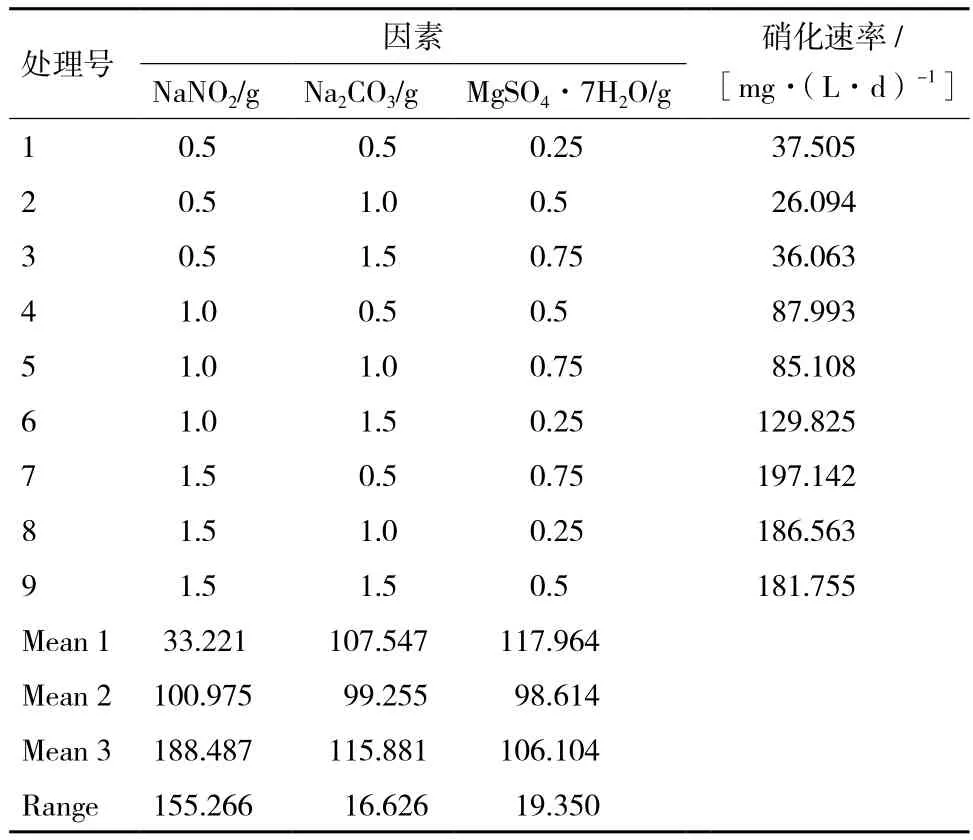
表2 培养基配方正交优化结果
3 讨论
目前,集约化、高密度和高产出的水产养殖模式的转变,带来一系列严重的问题:大量水产动物粪便、残饵、分泌物的累积,造成水体中含氮污染物的累积,导致水产动物的病害甚至死亡,提高了养殖成本,减少了收益[12,13]。亚硝酸盐是养殖水体中的主要污染之一,传统的生物脱氮是在好氧条件下,采用硝化细菌将亚硝态氮氧化为硝态氮[14,15]。已有报道利用硝化细菌[16]、地衣芽孢杆菌[17]、不动杆菌[18]、Pseudomona sputida[19]、假单胞菌[20]、反硝化细菌[21]等细菌进行生物脱氮,尽管这些细菌能够脱氮,但是在其产物和脱氮能力上存在差异。从已有研究来看,大部分脱氮细菌是异养细菌和去除氨氮作用,自养的硝化细菌却存在生长缓慢,培养困难,价格高等缺陷。本研究报道的Rhizobium radiobacter菌株N312为首次报道的具有自养硝化作用的新型脱氮菌,并且在好氧条件下具有较强的亚硝酸盐脱除能力,为水族箱和养殖水体亚硝态氮处理的实际应用提供有效菌源。
本试验以NaNO2为唯一氮源,以Na2CO3为唯一碳源,培养2 d,NO2--N浓度不断减少,这与魏巍等[22]发现的好氧反硝化细菌Rhizobium sp.生长规律相一致,培养过程未出现氨氮及硝态氮的累积,表明菌株N312具有硝化能力。利用细菌16S rDNA基因序列的保守性,进行PCR扩增并TA克隆,通过16S rDNA序列分析只能鉴定到属的水平,而Biolog全自动微生物鉴定系统却能鉴定到种水平,并具有准确、快捷、简便等优点[23],进一步保证了鉴定结果的可信度。N312在培养4-6 h和16-24 h的读数不一致,是由于菌株的生长状况不同造成的[24],该菌株在接种后期利用微孔中单一碳源代谢表现活性较强。总体来看,16S rDNA基因序列分析与Biolog鉴定结果一致。
本研究报道的Rhizobium radiobacter菌株N312的自养型硝化微生物,在6 d内亚硝酸盐去除率达到100%。魏巍等[22]却认为根瘤菌Rhizobium sp.具有异养硝化作用,氨氮去除率达到58.17%,同时还能实现同步硝化反硝化。刘钰莹等[25]通过贝洛氏法对氨氮进行测定,发现中华根瘤菌NP1(Sinorhizobium sp. NP1)具有去除氨氮能力。本文研究的菌株N312具有自养硝化作用,能去除亚硝酸盐。首次通过培养基配方的优化得到菌株N312最佳培养基:NaNO21.5 g,Na2CO31.5 g,Mg2SO4·7H2O 0.25 g,为未来对该菌种制剂的研制提供理论依据。
因此,本研究筛选得到的放射型根瘤菌是自养脱氮菌,具有去除亚硝酸盐功能,该功能在国内外未见报道,为新生物制剂的研发提供新的菌源。下一步将对其作用机理进行深入研究,为水族箱和养殖水体中亚硝态氮处理的实际应用提供理论依据,为水体营养化,污水处理施用的可行性研究提供理论及试验支持。
4 结论
本研究从污水处理厂的活性污泥中分离筛选出一株具有硝化能力的脱氮菌,通过富集培养、平板划线分离菌株,命名为N312,并进行形态观察,经16S rDNA基因序列分析和Biolog鉴定得到该菌株属于放射型根瘤菌(Rhizobium radiobacter),为革兰氏阴性杆菌,菌落圆形,乳白色。菌株N312在自配废水条件下,6 d亚硝酸盐去除率达到100%。利用正交试验法对该菌株的培养基配方进行优化得到最佳培养基配方为NaNO21.5 g,Na2CO31.5 g,MgSO4·7H2O 0.25 g,FeSO4·7H2O 0.2 g,KH2PO40.5 g。研究表明菌株N312在水质处理中具有良好的应用前景,是一株具有研究价值的自养脱氮菌。
[1] 陈薇, 刘清术, 许丽娟, 等. 两株以亚硝态氮为氮源的异养硝化细菌的分离及鉴定[J]. 生命科学研究, 2012, 16(6):489-495.
[2]Soucek DJ, Dickinson A. Acute toxicity of nitrate and nitrite to sensitive freshwater insects, mollusks, and a crustacean[J]. Archives of Environmental Contamination and Toxicology, 2012, 62(2):233-242.
[3] Frances J, Allan GL, Nowak BF. The effects of nitrite on the short-term growth of silver perch(Bidyanus bidyanus)[J]. Aquaculture, 1998, 163(1):63-72.
[4] 余润兰, 苗雷. 异养硝化细菌 Alcaligenes sp. S3 除氮特性及动力学[J]. 环境工程学报, 2012, 6(3):869-872.
[5] 罗小溪, 高建忠, 陈再忠. 硝化细菌富集培养及应用研究进展[J]. 水产科技情报, 2013, 40(6):320-323.
[6] 韩华君, 张磊, 张琴, 等. 土壤中根瘤菌定殖研究进展[J]. 土壤, 2008, 40(2):174-180.
[7] 陈绍铭, 郑福寿. 水生微生物学实验法[M]. 北京:海洋出版社, 1990.
[8] 国家环境保护总局. 水和废水监测分析方法[M]. 第4版. 北京:中国环境科学出版社, 2002:258-282.
[9] 黄毅. 硝化细菌对淡水水族箱水质和异养细菌类群变化的影响[D]. 上海:上海海洋大学, 2013.
[10] Altschul SF, Madden TL, Schäffer AA, et al. Gapped BLAST and PSI-BLAST:a new generation of protein database search programs[J]. Nucleic Acids Research, 1997, 25(17):3389-3402.
[11] Shishehchian F, Yusoff F, Shariff M. The effects of commercial bacterial products on macrobenthos community in shrimp culture ponds[J]. Aquaculture International, 2001, 9(5):429-436.
[12] 雷霁霖. 中国海水养殖大产业架构的战略思考[J]. 中国水产科学, 2010, 17(3):600-609.
[13] Bitra A, Hussain B, Tanwar AS, et al. Identification of function and mechanistic insights of guanine deaminase from Nitrosomonas europaea:role of the C-terminal loop in catalysis[J]. Biochemistry,2013, 52(20):3512-3522.
[14] Sayavedra-Soto L, Hommes N, Alzerreca J, et al. Transcription of the amoC, amoA and amoB genes in Nitrosomonas europaea and Nitrosospira sp. NpAV[J]. FEMS Microbiology Letters, 1998,167(1):81-88.
[15] 南晓梅, 宋新山, 赵晓祥. 硝化细菌包埋固定化条件的研究[J]. 应用化工, 2014, 43(2):200-202.
[16] 曾庆武, 梁运祥, 葛向阳. 反硝化细菌的分离筛选及其反硝化特性的初步研究[J]. 华中农业大学学报, 2008, 27(5):616-620.
[17] 王景峰, 金敏, 谌志强, 等. 1株好氧脱氮菌的筛选与脱氮特性研究[J]. 环境科学, 2011, 32(8):2409-2413.
[18] Kim M, Jeong SY, Yoon SJ, et al. Aerobic denitrification of Pseudomonas putida AD-21 at different C/N ratios[J]. Journal of Bioscience and Bioengineering, 2008, 106(5):498-502.
[19] 韩丽华, 张绍璐. 好氧脱氮菌群的筛选驯化及 PCR-DGGE 分析[J]. 东北林业大学学报, 2011, 39(8):90-93.
[20] 邢国伟, 李彦芹, 李凤超, 等. 一株反硝化细菌与光合细菌对养殖海水的净化效果[J]. 生物技术通报, 2014(3):151-154.
[21] 魏巍, 黄廷林, 苏俊峰, 等. 1株贫营养好氧反硝化菌的分离鉴定及其脱氮特性[J]. 生态环境学报, 2010, 19(9):2166-2171.
[22] 杜昕波, 赵耘, 李伟杰, 等. 利用BIOLOG系统对不同种类细菌鉴定的研究[J]. 中国兽药杂志, 2008, 42(9):31-33.
[23] 张朝正, 郭兰珍. 利用16S rDNA序列分析和Biolog快速鉴定方法鉴定产脂肪酶菌株[J]. 河北工业大学学报, 2009, 38(5):52-55.
[24] 刘钰莹, 邱枫, 宋琴, 等. 中华根瘤菌NP1氨单加氧酶基因的克隆与功能鉴定[J]. 中国生物化学与分子生物学报, 2010,26(8):768-775.
(责任编辑 马鑫)
Isolation and Identification of Novel Denitrifier Strain Rhizobium radiobacter and Its Nitrifying Characterisation
Luo Xiaoxi Gao Jianzhong Chen Zaizhong Yu Yongliang
(College of Fisheries and Life Science,Shanghai Ocean University,Shanghai201306)
In order to screen and identify new strain with nitrification, a denitrifier was isolated from sewage treatment plant. The strain named N312 isolated by enrichment and plate culture was identified based on its morphology characteristics, 16S rDNA gene sequence analysis and Biolog. The conditions of medium composition were optimized by orthogonal experiment. The autotrophic denitrifier strain N312 was isolated and identified as Rhizobium radiobacter, which was rod, Gram-negative, colony round and white. The results indicated that the nitrite removal efficiency by the strain could reach 100% after 6 days. The best medium was NaNO21.5 g, Na2CO31.5 g, Mg2SO4·7H2O 0.25 g, FeSO4·7H2O 0.2 g,KH2PO40.5 g. Strain N312 is a new autotrophic denitrifier with a highly research value.
denitrifier;16S rDNA;Biolog;orthogonal experiment;nitrification rate
10.13560/j.cnki.biotech.bull.1985.2015.05.026
2014-09-05
上海高校知识服务平台上海海洋大学水产动物遗传育种中心项目(ZF1206)
罗小溪,女,硕士研究生,研究方向:水产微生物,微生物制剂研究与应用;E-mail:446039386@qq.com
高建忠,男,副教授,研究方向:水产动物医学,微生物制剂研究与应用;E-mail:jzhgao@shou.edu.cn
