Bacillus amyloliquefaciens C1菌株γ-PGA合成基因pgsBCAE的克隆与表达
2015-10-24王世锋何剑陈怡露郑涛沈其荣雍晓雨
王世锋何剑陈怡露郑涛沈其荣雍晓雨
(1.南京工业大学生物与制药工程学院,南京 211816;2. 南京工业大学 生物能源研究所,南京 211816;3.南京农业大学资源与环境科学学院,南京 210095)
Bacillus amyloliquefaciens C1菌株γ-PGA合成基因pgsBCAE的克隆与表达
王世锋1,2何剑1,2陈怡露1郑涛1,2沈其荣3雍晓雨1,2
(1.南京工业大学生物与制药工程学院,南京211816;2. 南京工业大学 生物能源研究所,南京211816;3.南京农业大学资源与环境科学学院,南京210095)
γ-PGA是微生物合成的一种新型高分子生物可降解材料,基因工程菌株的构建对于其合成机理及开发生产具有较高的研究价值。利用Self-Formed Adaptor PCR(SEFA-PCR)方法扩增出菌株B. amyloliqueficiens C1的γ-PGA合成酶基因簇pgsBCAE,将其克隆到表达载体pET29a(+)中并转化至表达宿主E.coli BL21(DE3)。结果表明,转化所得的工程菌株在IPTG诱导下通过摇瓶发酵生产0.14 g/L的γ-PGA。Mn2+和Zn2+能够显著促进重组子E.coli BL21(pET29α-pgsBCAE)发酵合成γ-PGA的产量,并且这种促进作用随着Mn2+和Zn2+浓度的提高而越加显著。Mg2+在低浓度(1 mmol/L)下也促进重组子合成γ-PGA,之后随着Mg2+浓度的升高,这种促进作用逐渐减弱,当Mg2+浓度达到4 mmol/L时,反而抑制重组子γ-PGA的合成。菌株B. amyloliqueficiens C1基因组内含有完整的γ-PGA合成酶基因簇pgsBCAE,该基因簇能够在表达宿主E. coli BL21中被诱导表达并合成γ-PGA,且其γ-PGA的合成受金属离子的影响。
γ-多聚谷氨酸;合成基因;SEFA-PCR;异源表达;金属离子
γ-多聚谷氨酸(poly-γ-glutamic acid,γ-PGA)是微生物利用D-和/或L-谷氨酸通过α-氨基与γ-羧基之间形成γ-酰胺键聚合而成的一种阴离子型高分子聚合物,具有水溶性、可生物降解、可食用等特点,对人体和环境安全。其分子内含有大量游离羧基,对养分具有较大的亲和力,同时又具有较强的保湿和吸水性,近年来在食品工业、化妆品生产、制药业、污水处理和农业等方面具有广泛的应用[1]。
Green等[2]发现B. anthracis的γ-PGA合成基因存在于质粒pXO2上;而Candela等[3]发现capB、capC、capA和capE是影响γ-PGA合成最主要的4个基因。Ashiuchi等[4,5]报道了在B. subtilis IFO 3336中有3个基因参与了γ-PGA的合成,分别为pgsB、pgsC和pgsA。Candela等[3]于2005年在该3个基因下游发现了一小段开放阅读框,命名为pgsE。该段序列与capE同源性很高,所以pgsE极有可能也参与γ-PGA的合成。B. amyloliqueficiens C1是本实验室自行从菜园土中筛选的一株高产γ-PGA的菌株,其摇瓶发酵产量能够达到18.4 g/L,相对分子质量为1.8×103kD,且PCR结果显示该菌株拥有γ-PGA合成所需的相关基因pgsABC。B. licheniformis[6]和B. subtilis natto[7]等菌株常被用来生产γ-PGA,但野生菌株的遗传不稳定性可能会导致γ-PGA合成能力的降低甚至丧失,γ-PGA的降解,以及在某些生长状态下产生大量的胞外多糖类副产物。与传统的诱变育种相比,新兴的基因工程手段有望成为γ-PGA 高产菌的有效改造方式。马婕等[8]将B. subtilis 168模式菌株的γ-PGA合成基因ywsC、ywtA和ywtB连接到pTrcHisA载体后转化至宿主菌E. coli BL21(DE3),其γ-PGA产量最高可达0.134 g/L。Ashiuchi等[4]将pgsBCA基因通过融合表达的手段克隆到pTrc99A质粒中,并将此质粒转化E.coli JM109中,获得的阳性克隆中能够得到0.024 g/L的γ-PGA。Jiang等[9]将B. subtilis subsp. chungkookjang中的pgsBCA基因分别克隆到以Ptrc和PHCE为启动子的质粒中,得到重组质粒pMpgsBCA和pCOpgs,然后将这两个质粒分别转入E. coli BL21(DE3)、W3110及FMJ123中,结果转入了pMpgsBCA的E. coli BL21(DE3)合成了最高产量的γ-PGA,为0.061 g/L。
本研究以B. amyloliquefaciens C1基因组的 DNA为模板,扩增出γ-PGA合成基因pgsBCAE后,将其克隆入表达载体 pET29a(+)中,该载体转化E.coli BL21(DE3)后发酵,并设法提高重组菌中γ-PGA的产量,旨在为以B. amyloliquefaciens C1为基础构建高产γ-PGA 的工程菌提供研究基础。
1 材料与方法
1.1 材料
1.1.1 菌株与质粒 本研究所用菌株和质粒见表1。

表1 菌株和质粒
1.1.2 培养基与试剂 LB培养基(g/L):蛋白胨10,酵母膏5,NaCl 10,pH7.0;液体发酵培养基:柠檬酸13.5,谷氨酸10,NH4Cl 6.8,甘油75,K2HPO41,pH7.2分别加入:(1)0、0.1、0.2和0.4 mmol/L的ZnCl2;(2)0、0.1、0.2和0.4 mmol/L的FeCl3;(3)0、1、2和4 mmol/L的MgSO4;(4)0、0.2、0.4和0.8 mmol/L的MnSO4;Taq酶、LA Taq酶、PrimeSTAR HS DNA Polymerase、限制性内切酶、GCbuffer、T4 DNA连接酶等分子试剂均购自TaKaRa公司;抗生素均购自上海生物工程有限公司。
1.1.3 抗生素 氨苄青霉素(Amp)浓度为100 μg/mL,卡那霉素(Kan)浓度为50 μg/mL。
1.2 方法
1.2.1 基因组 DNA和质粒 DNA 的提取 采用Axy-Prep细菌基因组DNA小量试剂盒提取目标菌株基因组DNA,采用AxyPrep Plasmid Miniprep Kit试剂盒提取质粒,具体方法参见说明书。
1.2.2 pgsBCAE基因的SEFA-PCR扩增
1.2.2.1 PCR 扩增引物 本研究所用引物见表2。

表2 引物序列
1.2.2.2 pgsB基因的PCR扩增 利用引物pgsB-S和pgsB-AS(表2),以菌株 C1 的总 DNA 为模板扩增 pgsB 基因片段。PCR 反应条件为:94℃ 5 min;94℃ 45 s,52℃ 45 s,72℃ 90 s,32个循环;72℃,10 min;10℃,10 min。
1.2.2.3 SEFA-PCR法扩增pgsBCAE的全长基因 根据已获得的pgsB基因序列设计SEFA-PCR引物(表2),上游引物为5SP1、5SP2和5SP3,下游引物为3SP1、3SP2和3SP3,然后利用SEFA-PCR法[9]获得pgsB基因的上下游序列,测序后对上下游片段进行拼接,在NCBI网站中进行序列比对,并用Omiga软件进行序列分析。SEFA-PCR扩增体系和反应条件如下:
(1)SEFA-PCR-1:只加SP3作为引物。
SEFA-PCR-1体系(30 μL):2×GC Buffer 15 μL;dNTP 5 μL;模板DNA 3 μL;SP3(5SP3或3SP3)1 μL;LA-Taq 0.5 μL;ddH2O 5.5 μL。
SEFA-PCR-1反应程序:94℃ 3 min;94℃ 30 s;35℃ 3 min;0.2℃/s直到72℃;72℃ 5 min。
(2)SEFA-PCR-2:保持SEFA-PCR-1最后一步72℃,加3 μL SP1(5SP1 or 3SP1)。
SEFA-PCR-2反应程序:94℃ 3 min;94℃ 30 s;56℃ 5 min;72℃ 5 min;Go to 2 step 25 cycles;94℃30 s;56℃ 5 min;72℃ 5 min;Go to 6 step 1 cycle;94℃ 30 s;50℃ 30 s;72℃ 5 min;Go to 6 step 10 cycles;72℃ 6 min;10℃ forever;End。
(3)SEFA-PCR-3:以SEFA-PCR-2的产物(稀释10倍)为模板,只加 SP2 作为引物。
SEFA-PCR-3体 系(30 μL):2×GC Buffer 15 μL;dNTP 4 μL;模板DNA 2 μL;SP3(5SP3或3SP3)1 μL;LA-Taq 0.5 μL;ddH2O 7.5 μL。
SEFA-PCR-3反应程序:94℃ 3 min;94℃ 30 s;56℃ 5 min;72℃ 5 min;Go to 2 step 30 cycles;72℃10 min;10℃ forever;End。
1.2.3 重组表达载体的构建
1.2.3.1 pgsBCAE 基因的 PCR 扩增 根据SEFAPCR测序结果最终拼接的pgsBCAE全长基因设计引物,并在正向和反向引物前分别加入Kpn I酶切位点和BamH I酶切位点(表2)。PCR扩增产物经纯化、酶连、转化、阳性转化子验证、质粒提取、序列测定,最终获得含有质粒pMD-pgsBCAE的阳性转化子,并提取质粒pMD-pgsBCAE。
PCR反应体系(50 μL):5×Prime STAR Buffer(Mg2+plus)10 μL;dNTP 4 μL;pgsBCAE-F 1 μL;pgsBCAE-R 1 μL;DNA 1 μL;PrimeSTAR HS DNA Polymerase 0.5 μL;ddH2O 32.5 μL。
PCR反应条件为:98℃ 2 min;98℃ 10 s;52℃15 s;72℃ 3.5 min;Go to 2 step 30 cycles;72℃ 10 min;10℃ forever;End。
1.2.3.2 DNA的酶切反应 Kpn I酶切反应于37℃过夜进行,BamH I酶切反应于30℃过夜进行。检测型酶切反应结束后加10%(V/V)电泳上样缓冲液中止酶切反应,并进行琼脂糖电泳检测,制备型酶切反应结束后切胶回收。
(1)制备型酶切反应体系(100 μL):10 × Buffer 10 μL;质粒DNA 70 μL;限制性内切酶5 μL;ddH2O 15 μL。
(2)检测型酶切反应体系(10 μL):10 × Buffer 1 μL;质粒DNA 7 μL;限制性内切酶1 μL;ddH2O 1 μL。
1.2.3.3 目的基因片段的获得 参照制备型酶切体系,用Kpn I和BamH I进行分步酶切,电泳检查酶切效果。对已完全酶切的产物进行切胶回收,溶解于50 μL ddH2O中,核酸定量仪检测DNA浓度,立即酶连或于-20℃保存备用。
1.2.3.4 表达载体pET29a的制备 参照制备型酶切体系,用Kpn I和BamH I进行分步酶切,电泳检查酶切效果。对已完全酶切的产物进行切胶回收,溶解于50 μL ddH2O中,核酸定量仪检测DNA浓度,立即酶连或于-20℃保存备用。
1.2.3.5 pgsBCAE重组表达载体的构建 将B. amyloliquefaciens C1菌株合成γ-PGA完整的基因簇pgs-BC-AE克隆到表达载体pET29a(+)中,转化至表达宿主载体E. coli BL21感受态细胞中,在T7 lacZ启动子的控制下,进行异源表达,以此构建γ-PGA合成基因工程菌株。重组表达载体设计路线如图1所示。

图1 重组表达载体pET29a(+)-pgsBCAE构建技术路线
1.2.3.6 酶连、转化 酶连反应于16℃过夜进行,酶连产物转化E.coli DH5α感受态,挑取验证阳性转化子后,提取质粒送去测序。将经测序验证正确的重组质粒再转化至E.coli BL21感受态细胞,挑取验证阳性转化子后,最终获得含有pET29-pgsBCAE重组表达载体的转化子。
1.2.4 pgsBCAE的诱导表达 挑取E. coli BL21菌落,接入3 mL含卡那霉素(50 μg/mL)的LB培养液,37℃培养过夜。取500 μL过夜培养物接入50 mL含卡那霉素(50 μg/mL)的液体发酵培养液,37℃振荡培养 2 h以上,至对数中期(OD600=0.5)。吸取1 mL 未经诱导的培养物至微量离心管中,置于4℃冰箱待用。在剩余培养物中加入IPTG 至终浓度1 mmol/L,30℃、180 r/min继续通气培养。
1.2.5 金属离子对pET29-pgsBCAE转化子合成γ-PGA的影响 配制0.01 mol/L的ZnCl2、0.02 mol/L MnCl2、0.1 mol/L MgCl2,分别加入γ-PGA液体发酵培养基中,分别使得:Zn2+浓度为0、0.1、0.2和0.4 mmol/L;Mn2+浓度为0、0.2、0.4和0.8 mmol/L;Mg2+浓度为0、1.0、2.0和4.0 mmol/L。检测不同金属离子及其浓度对pET-pgsBCAE转化子合成γ-PGA的影响。
1.2.6 γ-PGA的提取纯化 发酵液15 000×g离心20 min后,取上清,加入4倍体积的预冷无水乙醇,静置过夜,12 000×g离心,沉淀用去离子水溶解后,去离子水透析过夜(透析袋截留分子量9 kD),冷冻干燥得到固体初提物。初提物用去离子水溶解,12 000×g离心,上清加20 mg/mL蛋白酶K,去离子水透析过夜,再按上述方法离心,取上清冷冻干燥,得到γ-PGA固体纯化样品,-70℃保存。
1.2.7 γ-PGA的水解 取纯化的γ-PGA样品0.2 g放入水解管中,加入10 mL 6 mol/L的HCl,抽真空,维持1 min后封口,110℃水解12-24 h,冷却后过滤,再用旋转式蒸发仪除去盐酸浓缩,洗提3次,最后定容到10 mL。
1.2.8 γ-PGA的水解产物氨基酸分析 采用Biochrom 30专用自动氨基酸分析系统测定所得水解产物中游离谷氨酸含量,上样量为20 μL。
2 结果
2.1 pgsB基因的PCR扩增
用常规PCR方法扩增出pgsB基因片段,测序结果(图2)显示其长度为1 182 bp。经NCBI数据库比对发现该序列与B. amyloliquefaciens LL3菌株的pgsB基因(登录号HM034756.1)同源性达到100%,同时申请NCBI登录号(HQ599194.1)。

图2 pgsB基因的PCR扩增产物电泳图
2.2 pgsB基因片段上、下游序列的SEFA-PCR扩增

图3 pgsB基因片段上游(A)、下游(B)序列的SEFAPCR扩增图
扩增结果如图3所示。对上、下游扩增片段(图3-A3、B3泳道)进行切胶回收并纯化后,酶连到克隆载体pMD19-T上并转化E. coli DH5α感受态,挑选阳性转化子送测序,结果显示,利用SEFA-PCR扩增出的pgsB基因上游片段为3 295 bp,下游片段为2 484 bp。
2.3 上、下游序列的拼接与分析
利用DNAMan软件对pgsB基因上下游序列进行拼接,并用OMIGA软件进行ORF(open reading frame)分析。结果(图4)表明,获得了γ-PGA完整的合成基因,共4个ORF,分别为pgsB、pgsC、pgsA和pgsE,并在pgsB上游发现750 bp的非编码区域,可能是其调控序列。完整的pgsBCAE基因序列为2 995 bp,与模式菌株B. amyloliquefaciens FZB42(登录号CPOOO560.1)、B. amyloliquefaciens DSM7(登录号FN597644.1)的γ-PGA合成酶基因同源性达到了100 %。
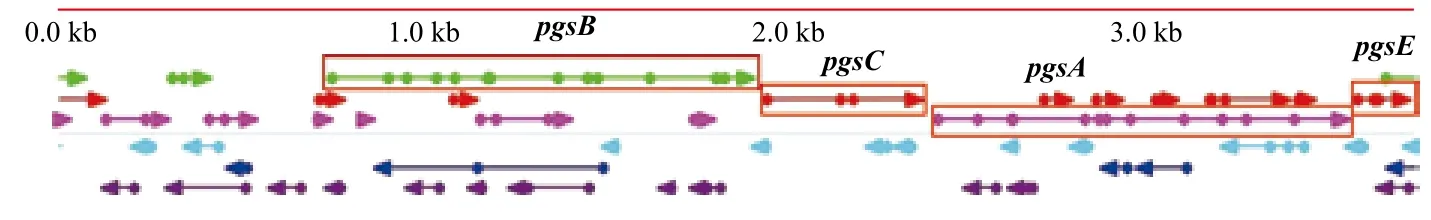
图4 pgsBCAE基因序列的ORF分析
2.4 pgsBCAE基因簇中各基因的验证
按照SEFA-PCR扩增出的pgsBCAE序列分别设计PCR扩增pgsBCAE完整基因簇及单个基因pgsB、pgsC、pgsA、pgsE的引物,并以菌株B. amyloliquefaciens C1基因组DNA为模板进行PCR扩增,结果(图5)显示,能够扩增出pgsBCAE以及pgsB、pgsC、pgsA、pgsE四个基因。

图5 SEFA-PCR结果的验证
2.5 pgsBCAE重组表达载体的构建
以菌株B. amyloliquefaciens C1的基因组DNA为模板,利用PrimeSTAR HS DNA聚合酶扩增pgsBCAE基因,并利用引物在其两端分别引入Kpn I和BamH I酶切位点。将PCR产物经末端加A尾后酶连入pMD19-T vector,经转化后获得pMD19-pgsBCAE。用Kpn I和BamH I分步单酶切pMD19-pgsBCAE及pET29a(+)。回收双酶切后的 pgsBCAE片段(3 kb左右)与pET29a(+)载体(5.5 kb左右),将获得的两片段通过T4连接酶催化反应进行连接,连接产物转化E.coli TOP10菌株,转化后的菌株发酵并提取质粒,筛选阳性克隆。将所得重组质粒测序验证,并将测序结果正确的重组质粒转化进E. coli BL21感受态中,获得含有重组表达载体pET29-pgsBCAE的基因工程菌株。各步骤的电泳检测图谱见图6。
2.6 重组子γ-PGA产量分析
对重组子γ-PGA合成基因pgsBCAE进行IPTG诱导表达,并提取其发酵液中γ-PGA。由图7可知,重组子E. coli BL21(pET29a-pgsBCAE)在γ-PGA发酵培养基中经IPTG诱导培养48 h后能够合成0.14 g/L的γ-PGA。说明在IPTG诱导下,重组子中γ-PGA合成基因能够高效表达。
2.7 金属离子对重组子γ-PGA产量的影响
Zn2+、Mg2+和Mn2+对重组子E. coli BL21(pET-29a-pgsBCAE)发酵合成γ-PGA的产量有显著影响(图8)。Zn2+浓度为0.1 mmol/L时就能够促进重组子E. coli BL21(pET29a-pgsBCAE)γ-PGA的合成,此时γ-PGA的产量为0.27 g/L,随着Zn2+浓度的提高,其对E. coli BL21(pET29a-pgsBCAE)γ-PGA的合成促进效果越显著,并且在Zn2+浓度为0.4 mmol/L达到最大,此时γ-PGA的产量达到0.66 g/L,相较于CK提高了370%。Mn2+显示出与Zn2+类似的促进效果,并且在Mn2+浓度为0.8 mmol/L时,γ-PGA的产量达到0.53 g/L,相较于CK提高了280%。与Zn2+和Mn2+不同,Mg2+在低浓度(1 mmol/L)条件下对重组子合成γ-PGA的促进作用达到最大(0.49 g/L),之后随着Mg2+浓度的升高,这种促进作用逐渐减弱,当Mg2+浓度达到4 mmol/L时,反而抑制重组子γ-PGA的合成。此时γ-PGA的产量仅为0.08 g/L,相较于CK下降了42.8%。

图6 pET29a-pgsBCAE重组质粒构建电泳检测图谱
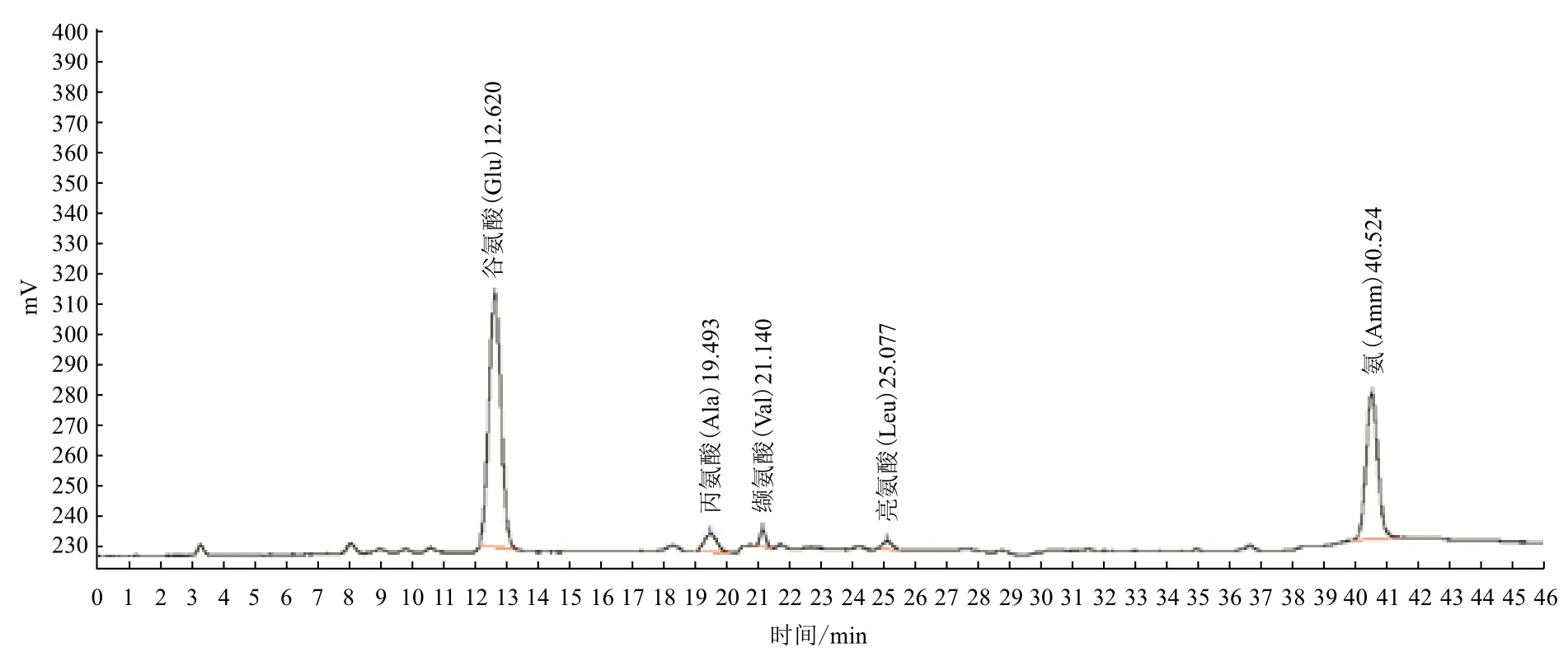
图7 重组子E. coli BL21(pET29a-pgsBCAE)合成的γ-PGA水解后氨基酸分析图
3 讨论
目前对γ-PGA合成基因的研究主要集中在B. subtilis。例如Ashiuchi等[4]在1999年发现在B. subtilis IFO 3336中有3个基因(pgsB、pgsC和pgsA)参与γ-PGA的合成。2001年,他们又在B. subtilis(chungkookjang)中将pgsB、pgsC 和 pgsA基因敲除,于是突变株无法合成γ-PGA,证明这3个基因是γ-PGA合成所必需的[5]。而通常对γ-PGA合成基因的研究也仅仅是针对pgsBCA三个基因及其产物PgsB、PgsC和PgsA。PgsB具有酰胺连接酶活性,其N-端有一段疏水区,此区域与PgsB和细胞膜、PgsC、PgsA的连接紧密相关,被认为是催化合成γ-PGA的主要组分[11]。PgsA含有与细胞膜结合的位点,并可在细胞表面定位。PgsA的功能是从γ-PGA的合成酶系中转移合成的γ-PGA,并使γ-PGA的合成酶系稳定地锚定在细胞膜上,因此PgsA是γ-PGA的运输载体,并对γ-PGA的延长十分重要[5]。PgsC是γ-PGA合成酶系统中可以与细胞膜结合的组分之一,也是γ-PGA的合成所必需[12]。而在2010年,Yamashiro等[13]发现,在pgsBCA之后还有一个168 bp的ORF,能够编码一个由55个氨基酸残基组成的6.5 kD大小的蛋白,该蛋白能够促进B. subtilis菌株γ-PGA的合成,并且Zn2+能够激活该蛋白的活性。这个基因即为pgsE。本研究最初拟根据报道的B. subtilis的γ-PGA合成基因为模板设计引物,扩增B. amyloliqueficiens C1菌株γ-PGA合成基因,但是只有pgsB能够被扩增出,而pgsA、pgsC以及pgsBCA全长基因簇始终扩增不出。这可能是因 为 B. subtilis与B. amyloliqueficiens的γ-PGA合成基因存在差异。Self-Formed Adaptor PCR(SEFAPCR)是由王世明博士设计开发的一种新的PCR技术,能够由已知序列扩增其两端未知序列扩增,扩增片段最长可达6-8 kb[10]。因此,作者以已扩增出的pgsB基因序列为模板设计SEFA-PCR引物,扩增pgsB基因的上下游片段,测序后拼接获得B. amyloliqueficiens C1菌株合成γ-PGA的基因簇全长。上游序列引物为:5SP1、5SP2、5SP3,下游序列引物为:3SP1、3SP2、3SP3。本研究通过SEFA-PCR扩增,作者也在B. amyloliqueficiens C1菌株pgsBCA基因后发现了这个小片段的ORF。因此后期实验中主要针对pgsBCAE基因簇进行研究。
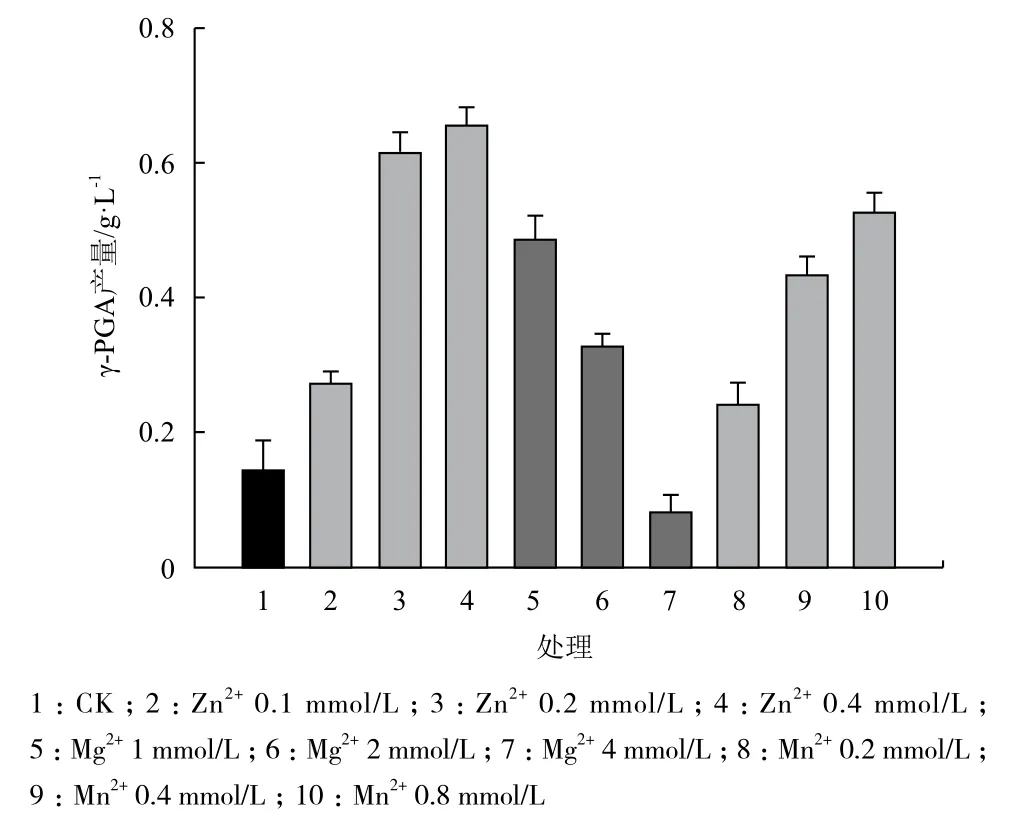
图8 金属离子及其浓度对重组子pET29a-pgsBCAE的γ-PGA产量的影响
在γ-PGA合成过程中有许多酶类参加反应,而金属离子在保持酶的活性中心构象以及维持酶活性有重要的作用[14]。培养基中金属离子浓度对γ-PGA的生产具有重要的影响,例如PgsB上有Mg2+/ATP结合位点[12]。研究发现Mn2+、Mg2+等对B. subtilis合成γ-PGA有影响[15,16]。高浓度的Mn2+抑制B. subtilis的生长,但是却可以延长细胞生存能力进而提高γ-PGA的产量[16,17]。Mn2+、Mg2+可能控制着专一性很强的D-和L-多肽合成酶系统。γ-PGA的聚合度和D-/L-构型比率都与金属离子的浓度有密切关系,不同浓度的Mn2+直接影响γ-PGA中L-谷氨酸、D-谷氨酸的比例,例如培养基中Mn2+的浓度也可改变B. licheniformis ATCC 9945A合成γ-PGA中D-谷氨酸与L-谷氨酸的比例[18]。本研究发现,Mn2+和Zn2+能够显著促进重组子E. coli BL21(pET29a-pgsBCAE)发酵合成γ-PGA的产量,并且这种促进作用随着Zn2+浓度的提高而越加显著。但是Mg2+的作用与Zn2+和Mn2+不同。Mg2+在低浓度(1 mmol/L)条件下对重组子合成γ-PGA的促进作用达到最大(0.49 g/L),之后随着Mg2+浓度的升高,这种促进作用逐渐减弱,当Mg2+浓度达到4 mmol/L时,反而抑制重组子γ-PGA的合成。此时γ-PGA的产量仅为0.08 g/L。因此在以后的发酵培养中,可以通过调节培养基中金属离子(如Mn2+、Zn2+、Mg2+)的种类和浓度对发酵菌株生产γ-PGA进行调节。
本研究将重组载体转化入E. coli BL21宿主菌中,在IPTG诱导下,使其具有了γ-PGA生物合成能力。但是由于E. coli为革兰氏阴性菌,而野生菌株(B. amyloliqueficiens C1)为革兰氏阳性菌,两者细胞膜结构不同,且蛋白质分泌系统也存在差异,可能导致重组表达的γ-PGA合成酶系统不能很好地在细胞膜上定位[19],因此表达宿主菌E. coli BL21(pET29a-pgsBCAE)的 γ-PGA产量较低。另外,载体质粒的表达体系的影响也是引起表达量较低的可能原因之一。后期研究中,为了构建高效γ-PGA生产的基因工程菌,可以从以下几点入手:(1)将γ-PGA合成酶基因转入芽孢杆菌表达系统中进行表达;(2)在重组质粒γ-PGA合成酶基因之间加上强启动子增强其表达。
4 结论
利用SEFA-PCR方法成功克隆出B. amylolique-ficiens C1合成γ-PGA的完整基因簇pgsBCAE,并将其连接到表达载体pET29a后转化宿主菌E.coli BL21,由此构建的重组菌株E.coli BL21(pET29apgsBCAE)具备合成γ-PGA的能力,产量达到0.14 g/L。且发现其γ-PGA的合成能力受金属离子的影响。
[1]Candela T, Fouet A. Poly-gamma-glutamate in bacteria[J]. Molecular Microbiology, 2006, 60(5):1091-1098.
[2]Green BD, Battisti L, Koehler TM, et al. Demonstration of a capsule plasmid in Bacillus anthracis[J]. Infection and Immunity, 1985,49(2):291-297.
[3]Candela T, Mock M, Fouet A. CapE, a 47-amino-acid peptide, is necessary for Bacillus anthracis polyglutamate capsule synthesis[J]. Journal of Bacteriology, 2005, 187(22):7765-7772.
[4]Ashiuchi M, Soda K, Misono H. A poly-γ-glutamate synthetic system of Bacillus subtilis IFO 3336:gene cloning and biochemical analysis of poly-γ-glutamate produced by Escherichia coli clone cells[J]. Biochemical and Biophysical Research Communications,1999, 263(1):6-12.
[5]Ashiuchi M, Nawa C, Kamei T, et al. Physiological and biochemical characteristics of poly-γ-glutamate synthetase complex of Bacillus subtilis[J]. European Journal of Biochemistry, 2001, 268(20):5321-5328.
[6]Birrer GA, Cromwick AM, Gross RA. γ-Poly(glutamic acid)formation by Bacillus licheniformis 9945a:physiological and biochemical studies[J]. International Journal of Biological Macromolecules, 1994, 16(5):265-275.
[7]Kunioka M, Goto A. Biosynthesis of poly(γ-glutamic acid)from L-glutamic acid, citric acid, and ammonium sulfate in Bacillus subtilis IFO3335[J]. Applied Microbiology and Biotechnology,1994, 40(6):867-872.
[8] 马婕, 王丹, 李强, 等. 基因工程大肠杆菌合成γ-聚谷氨酸[J].过程工程学报, 2009, 9(4):791-795.
[9] Jiang H, Shang L, Yoon SH, et al. Optimal production of poly-γglutamic acid by metabolically engineered Escherichia coli[J]. Biotechnology Letters, 2006, 28(16):1241-1246.
[10] Wang S, He J, Cui Z, et al. Self-formed adaptor PCR:a simple and efficient method for chromosome walking[J]. Applied and Environmental Microbiology, 2007, 73(15):5048-5051.
[11]Urushibata Y, Tokuyama S, Tahara Y. Characterization of the Bacillus subtilis ywsC gene, involved in γ-polyglutamic acid production[J]. Journal of Bacteriology, 2002, 184(2):337-343.
[12]Ashiuchi M. Amino-acid homopolymers occurring in nature[M]. Berlin:Springer-Verlag, 2010:77-93.
[13]Yamashiro D, Yoshioka M, Ashiuchi M. Bacillus subtilis pgsE(formerly ywtC)stimulates poly-γ-glutamate production in the presence of zinc[J]. Biotechnology and Bioengineering, 2011,108(1):226-230.
[14] 邵丽. 产聚γ-谷氨酸菌株的筛选[D]. 济南:山东轻工业学院,2008.
[15] Thorne CB, Gomez GC, Noyes HE, et al. Production of glutamyl polypeptide by Bacilllus subtilis[J]. Journal of Bacteriology,1954, 68(3):307-315.
[16]Leonard CG, Housewright RD, Thorne CB. Effects of some metallic ions on glutamyl polypeptide synthesis by Bacillus subtilis[J]. Journal of Bacteriology, 1958, 76(5):499-503.
[17]Cromwick AM, Gross RA. Effects of manganese(Ⅱ)on Bacillus licheniformis ATCC 9945A physiology and poly(γ-glutamic acid)formation[J]. International Journal of Biological Macromolecules, 1995, 17(5):259-267.
[18]王启军. 枯草芽孢杆菌B6-1产脂肽和聚-γ-谷氨酸及抗几种植物病原菌的研究[D]. 武汉:华中农业大学, 2008.
[19]Buescher JM, Margaritis A. Microbial biosynthesis of polyglutamic acid biopolymer and applications in the biopharmaceutical,biomedical and food industries[J]. Critical Reviews in Biotechnology, 2007, 27(1):1-19.
(责任编辑 马鑫)
Clone and Heterologous Expression of the Poly-γ-glutamic Acid Synthesis Gene pgsBCAE from Bacillus amyloliquefaciens C1
Wang Shifeng1,2He Jian1,2Chen Yilu1Zheng Tao1,2Shen Qirong3Yong Xiaoyu1,2
(1. College of Biotechnology and Pharmaceutical Engineering,Nanjing TECH University,Nanjing211816;2. Bioenergy Research Institute,Nanjing TECH University,Nanjing211816;3. College of Resources and Environmental Science,Nanjing Agricultural University,Nanjing 210095)
Poly-γ-glutamic acid(γ-PGA), a new type of biodegradable material with high molecular weight, is synthesized by many microbes; the construction of genetic engineering strain will be highly valuable to the research of synthesis mechanism and production of γ-PGA. The gene cluster, pgsBCAE, involving in the biosynthesis of γ-PGA in Bacilus amyloliqueficiens C1 were amplified by SEFA-PCR, which were then ligated in expression vector pET29a(+)and transformed into E. coli BL21(DE3)host cells. The recombinant clone, E. coli BL21(pET29a-pgsBCAE)induced by IPTG obtained the ability to synthesize γ-PGA by fermentation in shake flask, and the yield of γ-PGA was 0.14 g/L. Both Mn2+and Zn2+increased γ-PGA production of E. coli BL21(pET29a-pgsBCAE). With the increase of the concentration of Mn2+and Zn2+,this promotion became much more significantly. On the other hand, Mg2+in low concentration(1 mmol/L)also promoted γ-PGA production, the promotion decreased with the increase of Mg2+concentration, while high concentration of Mg2+(4 mmol/L)inhibited γ-PGA production of the recombinant clone significantly. The above results suggested that Bacilus amyloliqueficiens C1 contained the intact gene cluster pgsBCAE for the synthesis of γ-PGA, which can be cloned and expressed in E. coli BL21. The production of γ-PGA in the genetic engineering strain was affected by several metal ions.
poly-γ-glutamic acid;synthesis gene;SEFA-PCR;heterologous expression; metal ions
10.13560/j.cnki.biotech.bull.1985.2015.05.025
2014-09-22
江苏省自然科学基金项目(BK20130932),江苏省高校自然科学基金项目(13KJB530009)
王世锋,男,硕士研究生,研究方向:微生物发酵工程;E-mail:sg3ever@126.com
雍晓雨,男,博士,讲师,研究方向:应用微生物;E-mail:yongxiaoyu@njtech.edu.cn
