刺参内脏蛋白酶解液抗氧化活性研究
2015-10-24陶海英闫鸣艳尹利端
陶海英,闫鸣艳,尹利端
(1.山东省农业科学院畜牧兽医研究所,山东济南250100;2.中国科学院烟台海岸带研究所,山东烟台264003;3.烟台新时代健康产业有限公司,山东烟台264006)
刺参内脏蛋白酶解液抗氧化活性研究
陶海英1,闫鸣艳2,*,尹利端3
(1.山东省农业科学院畜牧兽医研究所,山东济南250100;2.中国科学院烟台海岸带研究所,山东烟台264003;3.烟台新时代健康产业有限公司,山东烟台264006)
采用小鼠D-半乳糖致衰老模型,通过测定小鼠肝脏和心脏中的超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)活性和丙二醛(MDA)含量,进一步研究了刺参内脏蛋白酶解物酶解物的抗氧化活性。表明灌胃200 mg/kg·d酶解物可明显提高小鼠肝脏和心脏中SOD和GSH-Px活力,并显著降低MDA含量。说明刺参内脏蛋白酶解物在一定程度上能够提高D-半乳糖模型衰老小鼠的抗氧化能力。
刺参;内脏,;酶解液,;抗氧化活性
刺参是一种高蛋白、低脂肪的无脊椎动物,具有很高的营养和药用价值,被列为海产“八珍”之一,深受人们的喜爱[1]。近年来,随着人们生活水平和保健意识的提高,其养殖、生产和销售规模逐渐扩大,由此产生大量的下脚料,如内脏(肠、卵等)。研究发现这些下脚料含有丰富的蛋白质[2],是制备生物活性肽的理想原料,然而这些下脚料并未得到有效利用,大部分被丢弃,造成环境污染和资源的浪费。目前已有由海参加工下脚料制备多肽的研究报道,闫鸣艳等以刺参内脏蛋白为原料通过菠萝蛋白酶以及菠萝蛋白酶和胰蛋白酶复配的方法制备了抗氧化肽,并研究了其脱色脱腥工艺[3-5];杨涛等利用碱性蛋白酶酶解海参内脏,发现其多肽具有较好的清除羟自由基和超氧阴离子自由基能力[6];曹荣、李冬燕等对海参肠的酶解工艺及多肽的体外抗氧化活性进行了研究[7-8]。然而这些研究大多集中在多肽的制备工艺上,关于多肽的生物活性方面甚少全面研究。因此,本文以菠萝蛋白酶和胰蛋白酶复配的方法制备刺参内脏蛋白酶解液,通过研究小鼠D-半乳糖模型动物实验,评价酶解液的体内抗氧化活性,为海参内脏多肽在食品、化妆品等领域的应用提供参考和依据。
1材料与方法
1.1材料仪器
刺参内脏:山东东方海洋科技股份有限公司提供,-20℃保存,实验时4℃解冻。
食品级碱性蛋白酶:广西南宁庞博生物工程有限公司;食品级胰蛋白酶:湖北康宝泰精细化工有限公司;1,1-二苯基苦基苯肼(DPPH·)、D-半乳糖:Sigma;超氧化物歧化酶(SOD)试剂盒、丙二醛(MDA)试剂盒、谷胱甘肽过氧化物酶(GSH-Px)试剂盒、蛋白测定试剂盒(考马斯亮蓝法):南京建成生物工程研究所;其他试剂均为分析纯。实验动物昆明种小白鼠60只,清洁级,30日龄~35日龄,体重28 g~31 g,雄性,由山东绿叶制药有限公司提供。
高速台式冷冻离心机(TGL-16M):长沙湘仪离心机仪器有限公司;电热恒温水浴锅(DK-S24):上海精宏实验设备有限公司;精密增力电动搅拌器(JJ-1):江苏金坛市双捷实验仪器厂;电子天平(AL204-IC):梅特勒-托利多仪器有限公司;紫外可见分光光度计(721E):上海光谱仪器有限公司;pH计(PHS-3C):上海虹益仪器仪表有限公司;DY89-1电动玻璃均浆机:宁波新芝生物科技股份有限公司。
1.2方法
1.2.1刺参内脏蛋白酶解液的制备
刺参内脏蛋白酶解液制备方法参照文献[4]。精确称取一定量的刺参内脏,用6倍的蒸馏水匀浆,混合均匀,用1 mol/L的HCl或NaOH溶液调节至pH 6.3,加入菠萝蛋白酶和胰蛋白酶(总加酶量8 000U/g,二者酶活力配比为1∶3),在35℃条件下搅拌,水解2 h。水解结束后,沸水浴灭酶10 min,终止反应,然后冷却至室温,置于离心机中,8 000 r/min离心30 min,收集上清液,通过10 kDa的赛多利斯超滤膜后减压浓缩,冻干得到刺参内脏蛋白酶解物。
1.2.2动物实验
1.2.2.1昆明种小鼠亚急性衰老模型的建立
将昆明种小鼠60只适应性饲养7 d,随机分组分为正常对照组,衰老模型组,阳性对照组和酶解物给药高、中、低剂量组,每组10只。酶解物给药组、阳性对照组与衰老模型组按100 mg/kg bw·d每日颈背部皮下注射D-半乳糖,注射量为0.1 mL/10g·bw,正常对照组每天注射等量生理盐水,连续注射42 d。造模同时灌胃给药。酶解物给药组每天按200、100、50 mg/kg·d高、中、低3个剂量灌胃给药,灌胃体积均为25 mL/kg;阳性药物组(VE)每天50 mg/kg·d灌胃给药;衰老模型组与正常对照组每日灌服等量生理盐水。每周根据体重调整给药量,每日给药1次,连续42 d。
1.2.2.2一般情况观察
每天观察动物外观体征、被毛、精神状态、行为活动、腺体分泌、呼吸、粪便性状、生殖器、死亡等情况并作记录。每周称量1次体重。
1.2.2.3抗氧化指标检测
实验小鼠于末次给药后,禁食16 h脱臼处死。迅速取肝脏、心脏置于4℃生理盐水中,洗净表面残留血迹,用滤纸吸干,立即称湿重,加入预冷的生理盐水,高速匀浆,离心取上清液,检测SOD、GSH-Px活性和MDA含量。
SOD的测定采用黄嘌呤氧化酵法。黄嘌呤-黄嘌呤氧化酶反应系统将产生超氧自由基(O2-),后者氧化轻胺形成亚确酸盐,通过显色剂的作用呈现出紫红色。当被测样品中含超氧气化物歧化酶时,则对超氧自由基有专一性的抑制作用,减少其亚稍酸盐的生成,比色时对照管吸光度值高于测定管吸光度值,通过计算公式可得出样品的SOD活力。将已经处理好的10%组织匀柴上清液,用生理盐水将其稀释为1%,根据试剂盒的要求操作,依次加入各试剂、样品于10 mL的EP管中,祸旋仪混勾。立即放入37℃恒温水浴锅中40 min(秒计时),取出后迅速加入显色剂混匀于室温静止10 min后于波长550 nm比色测定其吸光度值。
GSH-Px可促进过氧化氧(H2O2)与还原型谷胱甘肽(GSH)反应生成水(H2O)及氧化型谷胱甘肽,用酶促反应的速度来表示其GSH-Px的活力。测定此酶促反应中还原型谷胱甘肽(GSH)的消耗,则可通过计算得到酶的活力。最佳取样浓度可分别取用10%、5%、1%、0.5%、0.2%、0.1%的组织匀浆200 μL进行预试验,按照试剂盒操作说明,从不同的浓度组织上清液中取出0.2 mL进行检测,得出最佳浓度为1%。制备好最佳浓度1%的各组织上清液,根据试剂盒的操作加入各试剂和样本,充分混匀,离心(4 000 r/min,10 min),取出上清液1 mL作显色反应。其显色反应中需加入GSH标准品应用液及试剂盒的其他各试剂,涡旋仪混匀,于室温静止15 min后,412 nm测定各管的吸光度。
MDA的测定釆用TBA法。发生脂质过氧化反应过程中最后产物(MDA)能与硫代巴比妥酸结合,在此过程中产生的红色产物于532 nm处具有最大吸收峰。根据试剂盒的说明操作,在测定管中加入0.1 mL准备好的组织匀浆的上清液标准管中,加入相同体积的浓度为10 nmol/mL的标准品,其空白管则加入无水乙醇,然后依次加入各试剂,涡旋仪混匀后,盖上盖子,放入95℃水浴锅中40 min(秒表计时),取出各管立即流水冷却离心(4 000 r/min、10 min)。轻吸上清(请勿吸到沉淀),在532 nm处测定各管的吸光值。
1.3数据统计分析
2结果与分析
2.1刺参内脏蛋白酶解物对小鼠生长和体重的影响体重是机体健康的重要指标,它也是反映疾病严重程度的重要指标,体重增加或减少过快都说明身体健康指数下降。体重在短期内丢失10%以上,很有可能有潜在的肿瘤发生。试验期间,所有给药组动物一般状态良好,试验期间,模型组与正常对照组、各给药组与模型组动物体重比较,未见统计学差异(见表1)。说明刺参内脏蛋白酶解物未影响小鼠的正常生长,没有任何毒副作用,同时皮下注射D-半乳糖没有导致小鼠发生严重病变,注射剂量合适。
表1 小鼠试验期间体重变化(±SD)Table 1Weight changes of mice during the experiment(±SD)
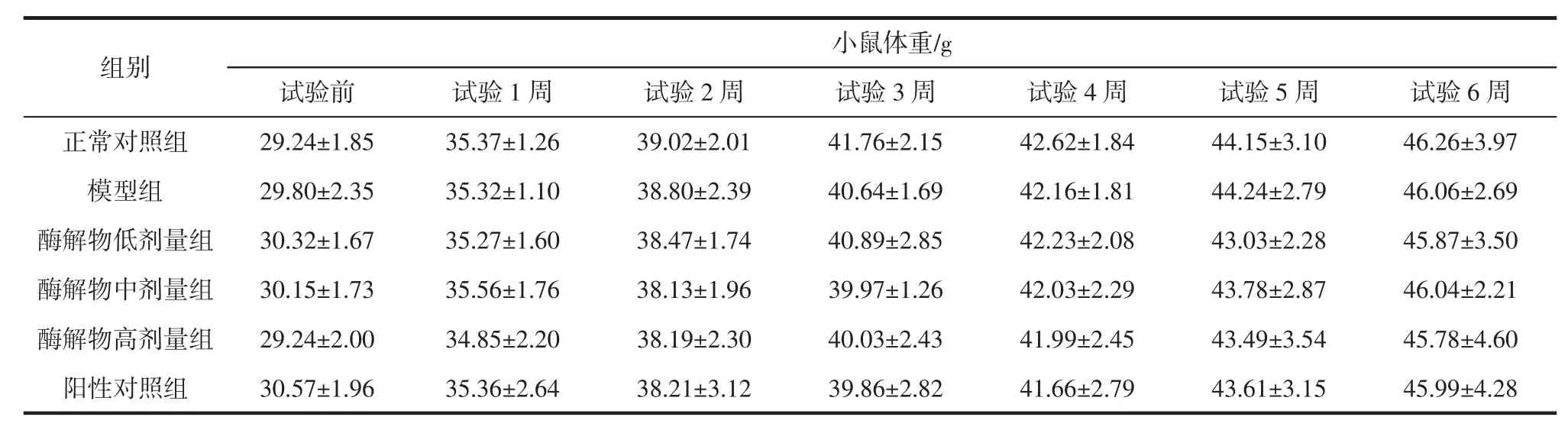
表1 小鼠试验期间体重变化(±SD)Table 1Weight changes of mice during the experiment(±SD)
小鼠体重/g试验前试验1周试验2周试验3周试验4周试验5周试验6周正常对照组29.24±1.8535.37±1.2639.02±2.0141.76±2.1542.62±1.8444.15±3.1046.26±3.97模型组29.80±2.3535.32±1.1038.80±2.3940.64±1.6942.16±1.8144.24±2.7946.06±2.69酶解物低剂量组30.32±1.6735.27±1.6038.47±1.7440.89±2.8542.23±2.0843.03±2.2845.87±3.50酶解物中剂量组30.15±1.7335.56±1.7638.13±1.9639.97±1.2642.03±2.2943.78±2.8746.04±2.21酶解物高剂量组29.24±2.0034.85±2.2038.19±2.3040.03±2.4341.99±2.4543.49±3.5445.78±4.60阳性对照组30.57±1.9635.36±2.6438.21±3.1239.86±2.8241.66±2.7943.61±3.1545.99±4.28组别
2.2刺参内脏蛋白酶解物对小鼠脏器SOD活力的影响
超氧化物歧化酶(SOD)活力可以间接反映机体清除自由基的能力,它是体内重要的抗氧化酶,能专一性清除超氧阴离子自由基,当其活性下降时,会引起自由基产生过量,加速机体衰老[9]。表2为各实验组小鼠肝脏和心脏中SOD活力测定结果。
表2 刺参内脏蛋白酶解物对小鼠脏器SOD活力的影响(±SD)Table 2Effect of protein hydrolysates from sea cucumber viscera on SOD activities in mice organs(±SD)
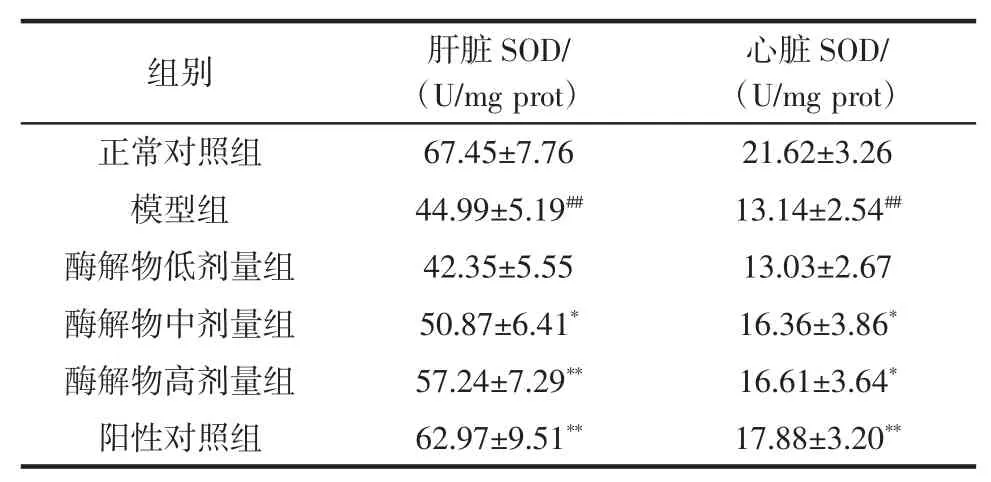
表2 刺参内脏蛋白酶解物对小鼠脏器SOD活力的影响(±SD)Table 2Effect of protein hydrolysates from sea cucumber viscera on SOD activities in mice organs(±SD)
注:与正常对照组比较,##P<0.01;与模型组比较:*P<0.05,**P<0.01。
心脏SOD/(U/mg prot)正常对照组67.45±7.7621.62±3.26模型组44.99±5.19##13.14±2.54##酶解物低剂量组42.35±5.5513.03±2.67酶解物中剂量组50.87±6.41*16.36±3.86*酶解物高剂量组57.24±7.29**16.61±3.64*阳性对照组62.97±9.51**17.88±3.20**组别肝脏SOD/(U/mg prot)
可以看出模型组小鼠脏器SOD活力极显著低于正常对照组(P<0.01),表明实验中小鼠衰老模型制备成功。同时酶解物中剂量组小鼠肝脏的SOD活力显著高于模型组(P<0.05),高剂量组极显著高于模型组(P<0.01),并与阳性对照组相当;另外酶解物中高剂量组小鼠心脏的SOD活力也显著高于模型组(P<0.05),表明刺参内脏蛋白酶解物在一定剂量下有提高SOD活力的作用。
2.3刺参内脏蛋白酶解物对小鼠脏器GSH-Px活性的影响
谷胱甘肽过氧化物酶(GSH-Px)是机体内广泛存在的一种重要的催化H2O2分解的酶,有清除过氧化物和保护细胞免于氧化损伤的重要作用,其活性的变化可反映机体抗氧化能力的变化[10]。刺参内脏蛋白酶解物对小鼠脏器GSH-Px活性的影响如表3所示。
表3 刺参内脏蛋白酶解物对小鼠脏器GSH-Px活性的影响(±SD)Table 3Effect of protein hydrolysates from sea cucumber viscera on GSH-Px activities in mice organs(±SD)
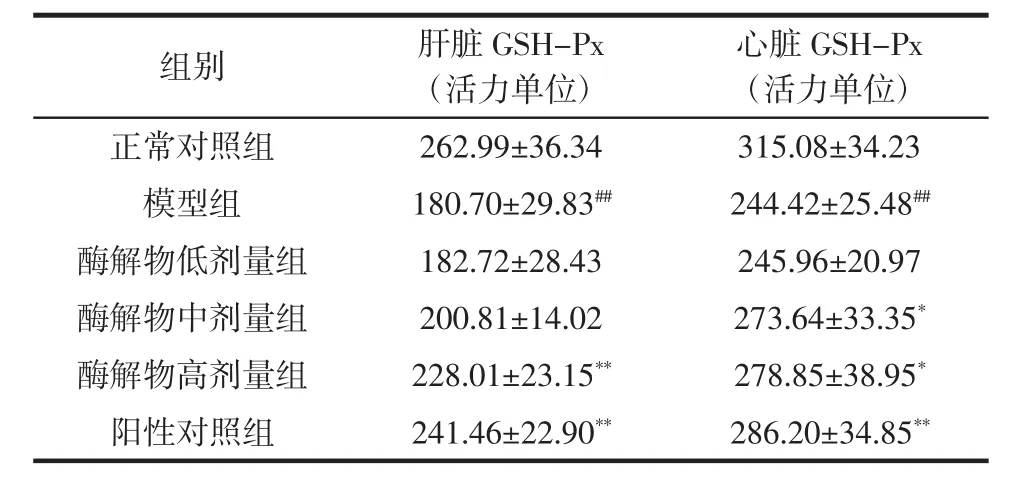
表3 刺参内脏蛋白酶解物对小鼠脏器GSH-Px活性的影响(±SD)Table 3Effect of protein hydrolysates from sea cucumber viscera on GSH-Px activities in mice organs(±SD)
注:与正常对照组比较,##P<0.01;与模型组比较:*P<0.05,**P<0.01。
心脏GSH-Px(活力单位)正常对照组262.99±36.34315.08±34.23模型组180.70±29.83##244.42±25.48##酶解物低剂量组182.72±28.43245.96±20.97酶解物中剂量组200.81±14.02273.64±33.35*酶解物高剂量组228.01±23.15**278.85±38.95*阳性对照组241.46±22.90**286.20±34.85**组别肝脏GSH-Px(活力单位)
模型组小鼠肝脏和心脏GSH-Px活性极显著低于正常对照组(P<0.01),进一步表明实验中小鼠衰老模型制备成功。酶解物高剂量组小鼠肝脏GSH-Px活性极显著高于模型组(P<0.01),并与阳性对照组相当,但均低于正常对照组;同时酶解物中高剂量组小鼠心脏GSH-Px活性显著高于模型组(P<0.05),表明刺参内脏蛋白酶解物在一定剂量下可延缓GSH-Px活性的降低。
2.4刺参内脏蛋白酶解物对小鼠脏器MDA含量的影响
刺参内脏蛋白酶解物对小鼠脏器MDA含量的影响见表4。
3结论
以D-半乳糖诱导的亚急性衰老小鼠为模型进一步验证了刺参内脏蛋白酶解物的抗氧化活性。每天灌胃200 mg/kg·d的酶解物可明显提高小鼠肝脏和心脏中SOD和GSH-Px活力,并显著降低MDA含量。
体内抗氧化实验证实了刺参内脏蛋白酶解液具有优良的抗氧化活性,有作为活性成分添加到食品、化妆品中的应用前景。
表4 刺参内脏蛋白酶解物对小鼠脏器MDA含量的影响(±SD)Table 4Effect of protein hydrolysates from sea cucumber viscera on MDA contents in mice organs(±SD)
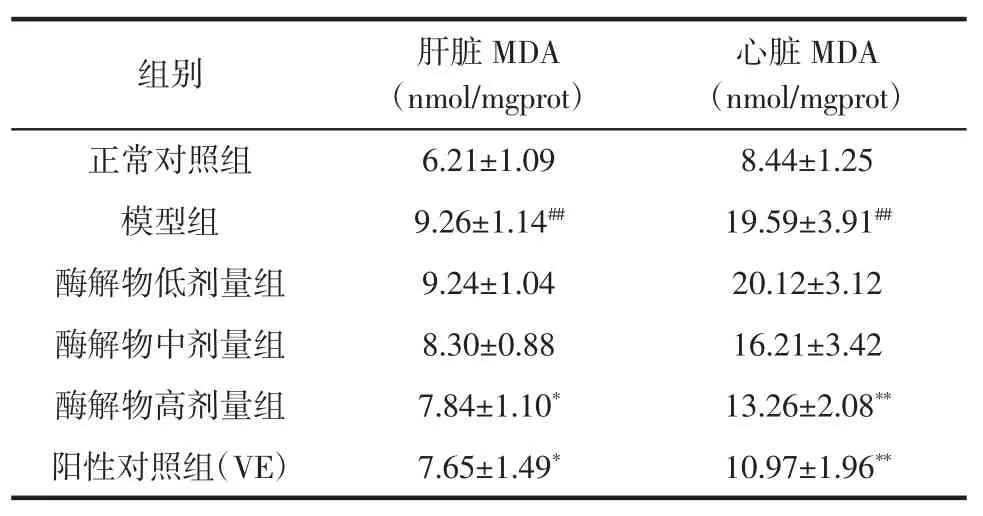
表4 刺参内脏蛋白酶解物对小鼠脏器MDA含量的影响(±SD)Table 4Effect of protein hydrolysates from sea cucumber viscera on MDA contents in mice organs(±SD)
注:与正常对照组比较,##P<0.01;与模型组比较:*P<0.05,**P<0.01。
心脏MDA(nmol/mgprot)正常对照组6.21±1.098.44±1.25模型组9.26±1.14##19.59±3.91##酶解物低剂量组9.24±1.0420.12±3.12酶解物中剂量组8.30±0.8816.21±3.42酶解物高剂量组7.84±1.10*13.26±2.08**阳性对照组(VE)7.65±1.49*10.97±1.96**组别肝脏MDA(nmol/mgprot)
丙二醛(MDA)是脂质过氧化的最终产物,是衡量机体衰老过程中脂质过氧化的重要指标,反映了机体受损程度,其含量越高,表明脂质过氧化程度越高[10]。从表4可以看出,模型组小鼠肝脏和心脏中的丙二醛含量明显高于正常组(P<0.01),分别增加了49%和132%,说明皮下注射D-半乳糖造成脂质过氧化物的严重积累,从而使机体受到损害。灌胃高剂量的酶解物可显著降低小鼠肝脏和心脏中MDA含量(P<0.05),并达到了对照物VE的水平,表明在动物体内刺参内脏蛋白酶解物是一种优良的抗氧化剂。
[1]Zhao Y,Li B,Liu Z,et al.Antihypertensive effect and purification of an ACE inhibitory peptide form sea cucumber gelatin hydrolysate[J].Process Biochemistry,2007(42):1586-159
[2]刘小芳,薛长湖,王玉明,等.乳山刺参体壁和内脏营养成分比较分析[J].水产学报,2011,35(4):587-593
[3]闫鸣艳,秦松.酶解刺参内脏蛋白制备抗氧化肽的研究[J].食品工业科技,2013,3(19):115-118,357
[4]闫鸣艳,秦松.复合酶解刺参内脏蛋白制备抗氧化肽工艺[J].食品工业,2014,35(7):50-53
[5]闫鸣艳,秦松.刺参内脏蛋白酶解液脱色脱腥工艺研究[J].食品工业,2014,35(6):62-65
[6]杨涛,万端极,吴正奇,等.海参内脏制备海参多肽工艺优化及其抗氧化测定[J].食品科技,2014,39(3):218-222
[7]李冬燕,曹荣,刘淇,等.海参肠高效酶解工艺研究[J].湖南农业科学,2012(3):84-86
[8]曹荣,李冬燕,刘淇,等.刺参肠、性腺酶解多肽体外抗氧化作用研究[J].南方水产科学,2013,9(6):47-51
[9]李玲,唐艳,农皓如,等.水牛乳多肽对衰老模型小鼠机体抗氧化作用的研究[J].食品科技,2012,37(9):62-65
[10]王常青,任海伟,王海凤,等.黑豆多肽对D-半乳糖衰老小鼠抗氧化能力的影响[J].食品科学,2010,31(3):262-266
Studies on Antioxidant Activities of Protein Hydrolysates from Sea Cucumber Viscera
TAO Hai-ying1,YAN Ming-yan2,*,YIN Li-duan3
(1.Institute of Animal Science and Veterinary Medicine,Shandong Academy of Agricultural Sciences,Ji'nan 250100,Shandong,China;2.Yantai Institute of Coastal Zone,Research China Academy of Sciences,Yantai 264003,Shandong,China;3Yaitai New Age Health Co.,LTD,Yantai 264006,Shandong,China)
D-galactose subacute aging model of mice was built up for further on studying the antioxidant activities of protein hydrolysates from sea cucumber viscerahydrolysates,the capacity of SOD and GSH-Px and MDA content of mice in liver and heart were detected.Results showed that:the levels of SOD and GSH-Px activity were obviously increased in liver and heart of mice after fed hydrolysates 200 mg/kg·d every day,and MDA content was obviously decreased,suggesting that there was a remarkable antioxidant effect of protein hydrolysates from sea cucumber viscera on D-galactose subacute aging model mice.
sea cucumber;viscera;hydrolysates;antioxidant activities
10.3969/j.issn.1005-6521.2015.11.014
2014-11-29
烟台市科技发展计划“刺参内脏抗氧化肽制备工艺及活性研究”(2011070);山东省海洋经济创新发展区域示范项目“海洋活性蛋白及其功能制品的开发与产业化”
陶海英(1977—),男(汉),畜牧师,大专,研究方向:多肽制备。
闫鸣艳,助理研究员,多肽制备。
