澄清剂对黄酒混浊蛋白去除效果的研究
2015-10-24樊世英孙军勇谢广发
樊世英,孙军勇,谢广发,陆 健,5,*
(1.江南大学工业生物技术教育部重点实验室,江苏无锡214122;2.江南大学粮食发酵工艺与技术国家工程实验室,江苏无锡214122;3.江南大学生物工程学院,江苏无锡214122;4.中国绍兴黄酒集团有限公司国家黄酒工程技术研究中心,浙江绍兴312000;5.宿迁市江南大学产业技术研究院,江苏宿迁223800)
澄清剂对黄酒混浊蛋白去除效果的研究
樊世英1,2,3,孙军勇1,2,3,谢广发3,4,陆 健1,2,3,5,*
(1.江南大学工业生物技术教育部重点实验室,江苏无锡214122;2.江南大学粮食发酵工艺与技术国家工程实验室,江苏无锡214122;3.江南大学生物工程学院,江苏无锡214122;4.中国绍兴黄酒集团有限公司国家黄酒工程技术研究中心,浙江绍兴312000;5.宿迁市江南大学产业技术研究院,江苏宿迁223800)
研究了单宁、硅胶和PolyclarRBrewbrite等澄清剂对黄酒混浊蛋白特异性去除的效果,并通过采用N-三(羟甲基)甘氨酸-十二烷基磺酸钠-聚丙烯酰胺凝胶电泳、基质辅助激光解析电离飞行时间串联质谱,研究了黄酒混浊蛋白及不同澄清剂吸附蛋白的分子量、蛋白质种类及来源,并比较了澄清剂处理前后酒样隆丁区分和非生物稳定性的变化。结果表明:黄酒混浊蛋白的主要成分为类燕麦蛋白和二聚α-淀粉酶抑制剂,主要来源于小麦,几种澄清剂对二聚α-淀粉酶抑制剂都有一定的吸附作用,且处理后的酒样稳定性得到提高,其中以单宁效果最为明显。
黄酒,澄清剂,混浊蛋白,基质辅助激光解析电离飞行时间串联质谱,蛋白稳定性
黄酒是一种成分复杂、营养丰富的胶体溶液,含有蛋白质、氨基酸、多酚、糖、金属离子等物质。在存储的过程中,黄酒受到光照、振动、氧气的影响,胶体平衡被打破而出现失光、絮凝和沉淀[1]。在黄酒的沉淀物中,蛋白质占有较大的比例,一般在30%~50%,并且在沉淀蛋白中高分子蛋白质含量都高于50%[2-5]。因此,一些研究者认为黄酒中高分子蛋白质含量高是引起黄酒非生物稳定性差的原因。然而,有的研究者认为尽管高分子蛋白质在沉淀中所占的比例大,但黄酒的稳定性并不随着黄酒中高分子蛋白质含量增高而降低,而可能与黄酒中某类容易形成混浊的蛋白质有关[6]。
提高黄酒稳定性的研究早有报道,研究者通过物理法冷冻、微滤、超滤技术去除黄酒中的部分蛋白质或使其凝聚析出,或者用化学的方法向黄酒中添加澄清剂,如单宁、植酸、PVPP、壳聚糖、膨润土等[7-10],减少黄酒中蛋白质或多酚的含量,都取得了一些成果。目前,国内的几家大型黄酒生产企业都采用了冷冻过滤的工艺来解决黄酒的稳定性问题,但是冷冻处理对混浊蛋白的选择性并不是十分理想,且存在能耗高的问题。因此,对黄酒的混浊蛋白成分进行分析,加强此类蛋白质的研究并特异性的去除该类蛋白,将是提高黄酒蛋白稳定性的最佳途径。
为了解决这一问题,本文比较了几种澄清剂对黄酒混浊蛋白的去除效果,研究了与混浊形成相关指标的变化。并且通过SDS-PAGE确定黄酒沉淀中蛋白质分子量的分布,利用基质辅助激光解析电离飞行时间串联质谱(MALDI-TOF/TOF MS)技术分析其成分及来源,为在工业化生产中控制黄酒的蛋白稳定性提供理论指导。
1 材料与方法
1.1 材料与仪器
黄酒 浙江古越龙山绍兴酒股份有限公司提供的未经稳定处理的花雕酒;硅胶1 美国PQ公司;硅胶2 Stabiquick系列硅胶,德国Stabifix公司;五倍子单宁 郑州陇海啤酒物资专营店;PolyclarRBrewbrite 美国国际特品公司;丙烯酰胺、甲叉双丙烯酰胺、三羟甲基氨基甲烷(Tris)、十二烷基磺酸钠(SDS)、N,N,N',N'-四甲基乙二胺(TEMED)、过硫酸铵(APS)、牛血清蛋白、考马斯亮蓝G-250、考马斯亮蓝R-250 上海生工进口分装产品;Tricine和蛋白质标准品(分子量4.1~45.0ku) 上海生工生物工程公司;NH4HCO3、二硫苏糖醇(DTT)、碘乙酰胺(IAA)、三氟乙酸(TFA) 美国Sigma公司;其他试剂 均为分析纯。
蛋白电泳系统(M ini-Protein 3 Cell) 美国Bio-Rad公司;高速冷冻离心机 美国Sigma公司;Ultraflextreme串联飞行时间质谱仪 德国Bruker公司;UV-2100紫外可见分光光度计 尤尼克上海仪器公司;WGZ-2-PJ浊度计 上海昕瑞仪器仪表有限公司;K2300凯氏定氮仪 丹麦Foss有限公司。
1.2 实验方法
1.2.1 黄酒混浊蛋白样品制备 取500m L酒样,自然存放一段时间,直至出现混浊沉淀,离心收集沉淀物,再将沉淀物悬浮于超纯水,离心(12000r/m in,30m in),重复上述过程,收集沉淀,超纯水洗涤2次,用2%氨水溶解,用80%饱和硫酸铵盐析,然后用3000u的透析袋于4℃下脱盐48h,冷冻干燥,即得到混浊蛋白样品[11]。
1.2.2 澄清剂吸附蛋白质样品制取[11]向澄清酒样中分别添加单宁(70mg/L)、硅胶1、2(500mg/L)、PolyclarRBrewbrite(200mg/L),离心收集沉淀,用2%氨水溶解后,离心除去硅胶和PolyclarRBrewbrite,回收上清液,向上清液中缓慢添加硫酸铵使其相对饱和度达到80%,混合搅拌形成沉淀,离心收集沉淀后,透析脱盐,冷冻干燥得到澄清剂吸附蛋白样品。
1.2.3 Tricine-SDS-PAGE电泳 将混浊蛋白和澄清剂吸附蛋白溶于0.05mol/L Tris中,考马斯亮蓝法测定蛋白浓度。凝胶配制参考曹佐武的实验方法[12]。电泳结束后将凝胶在含有50%乙醇和10%冰醋酸的固定液中固定0.5h后,在考马斯亮蓝R-250染色液中染色3h,然后用含10%甲醇和10%冰醋酸的脱色液脱色至背景清晰,电泳图谱用JD-801凝胶成像仪记录,通过捷达801图像分析软件3.3分析。
1.2.4 MALDI-TOF/TOF MS 切取凝胶上可见的蛋白条带,加入200μL的100mmol/L碳酸氢铵/30%乙腈(V/V),振荡脱至无色,加入50μL无水乙腈脱水2次,得白色胶粒。每管加入5μL胰蛋白酶液,置于4℃冰箱中30~60min,使胶粒完全吸收酶液,吸出多余酶液,加入20μL 25mmol/L碳酸氢铵溶液,37℃水浴20h。将酶解液吸出加入到新离心管中,将酶解液和萃取液旋转真空浓缩,加入TA60溶液3μL振荡复溶。吸取0.7μL样品点样,晾干后加0.7μL基质,干燥后运用质谱仪对样品进行肽质量指纹图谱分析。一级质谱数据采集模式采用正离子反射模式与自动获取数据模式,扫描范围为700~3500u。选取5~10个信号强度较好的一级质谱峰进行二级质谱分析,使用BioTools软件进行整合,Mascot软件用于质谱数据搜索,搜索数据库为NCBI,物种属为全物种,切割酶为胰酶[13]。
1.2.5 总氮及隆丁区分的测定 参照文献[14]测定。
1.2.6 稳定性实验
1.2.6.1 热处理实验 根据Juinn-Chin Hsu[15]的方法稍作修改,取澄清剂处理前与处理后的酒样各50m L,90℃水浴6h,冷却至室温,分别测定热处理前后的浊度,计算浊度增加量。
1.2.6.2 乙醇-浊度实验 取澄清剂处理前与处理后的酒样各50m L,加入25m L无水乙醇,振荡混匀,2h后测浊度,计算酒精添加前后浊度增加量[16]。
1.2.6.3 强制老化实验 取澄清剂处理前与处理后的酒样各50m L,0℃放置12h;80℃,12h为一个循环,三个循环后冷却至室温测浊度并计算浊度变化量[13]。
1.2.7 氨基酸态氮、酒精度、pH、总酸、总糖含量测定 参照文献[17]测定。
2 结果与分析
2.1 SDS-PAGE及质谱鉴定结果与分析
采用Tricine-SDS-PAGE凝胶方法来分离混浊蛋白,将混浊蛋白及澄清剂吸附的蛋白按照1.2.3的方法进行电泳,结果见图1。
通过凝胶分析软件计算图1中各条带的积分光密度及分子量,可知混浊蛋白主要分布在大约14.9ku和32.5ku处,而各种澄清剂吸附蛋白也位于这两处,由此可见,几种澄清剂对混浊蛋白都有一定的吸附作用。对明显的条带取点进行质谱鉴定,鉴定结果见表1。条带a1~a5为类燕麦蛋白,主要来源于小麦,条带b1~b5鉴定结果为二聚α-淀粉酶抑制剂,同样来源于小麦,而这两种蛋白也存在于啤酒的混浊蛋白中[18]。类燕麦蛋白是小麦中的储藏蛋白,主要存在于小麦胚乳中,属于低分子量谷蛋白,含有一定数量的半胱氨酸,分子内和分子间存在的二硫键可以形成高分子聚合体[19],影响混浊物的形成。α-淀粉酶抑制剂是普遍存在于植物种子中的一种酶抑制剂,在小麦种子中主要存在12、24、60ku 3种形式,单体的α-淀粉酶抑制剂分子量为12、24、60ku分别为二聚体和四聚体,分解后单体的分子量在13ku左右[20-21]。α-淀粉酶抑制剂可以抑制内生性淀粉酶的活性,使摄入体内的淀粉不能水解,阻断主要的能量来源,从而可以防御昆虫的侵害,并且在治疗糖尿病和高血糖方面有重要作用[22-23]。研究发现[21],α-淀粉酶抑制剂具有较好的酸碱耐受性,在pH4~11时蛋白性质结构稳定,在70℃作用30m in后酶活基本没有变化,80℃作用10min活性仅降低10%左右。据此分析,在黄酒煎酒的过程中,其热稳定性好,只有少部分的α-淀粉酶抑制剂失活变性凝固析出,大部分还存在于酒液中,经过长时间的贮存,外界环境发生变化,导致其逐渐析出形成混浊。除此之外,α-淀粉酶抑制剂可以与α-淀粉酶形成可溶性的复合体,从而使淀粉酶失去活性,降低对淀粉的分解能力,导致淀粉分解不彻底,部分糊精[5]会残留在酒液中,随着环境变化糊精会析出,加重黄酒的非生物混浊。
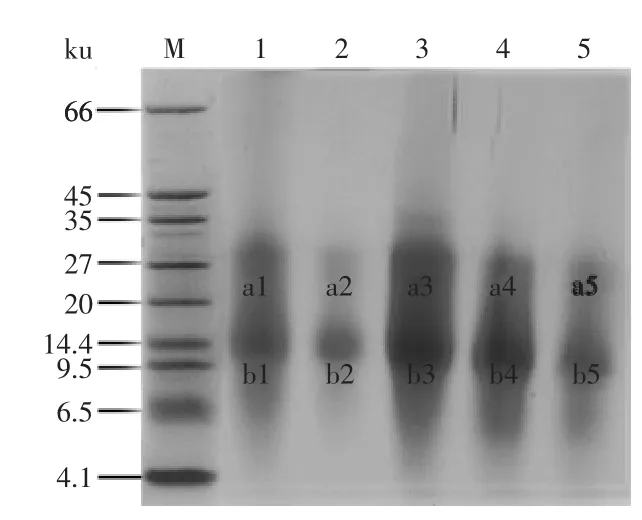
图1 混浊蛋白及澄清剂吸附蛋白Tricine-SDS-PAGE电泳图Fig.1 Tricine-SDS-PAGE electrophoresis of the proteins in haze and absorbed by fining agents
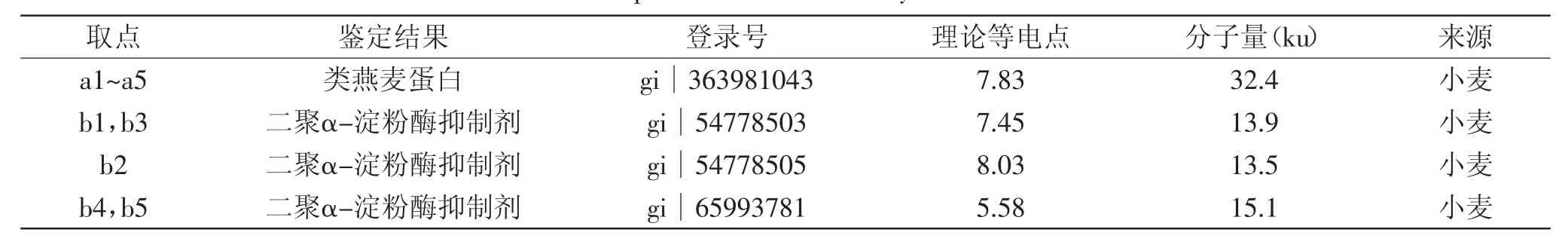
表1 蛋白质质谱鉴定结果Table 1 Results of proteins identification by MALDI-TOF/TOFMS
2.2 澄清剂处理对黄酒蛋白稳定性的影响
2.2.1 澄清剂处理前后总氮及隆丁区分的变化 隆丁区分可以反映黄酒中不同分子量段的蛋白质的组成比例。从表2分析出,未经澄清剂处理的酒样中,总氮含量最高。经过澄清剂处理后,一部分蛋白被吸附,酒体中总氮含量有所下降,但下降幅度不大,保留了原酒样中97%以上的蛋白。然而,酒样中高、中、低分子蛋白质的组成比例变化较大。其中,经过单宁和PolyclarRBrewbrite处理后,酒样的中分子蛋白分别减少了12.1%和19.6%,而低分子氮的含量变化并不明显,这说明澄清剂对酒体中的蛋白质是具有选择性的吸附,对高、中分子蛋白质具有一定的吸附效果,并且PolyclarRBrewbrite对中分子氮的吸附量大于对高分子氮的吸附量。由图1可知,处于中分子氮范围内的13ku左右的α-淀粉酶抑制剂和32.4ku左右的类燕麦蛋白是混浊蛋白的主要成分,因此,中分子蛋白质含量的减少有利于黄酒稳定性的提高。

表2 澄清剂处理前后总氮及隆丁区分变化Table 2 Total nitrogen and Lundin fraction of the rice wine before and after fining
2.2.2 稳定性实验 采用热处理法、乙醇-浊度法和强制老化法综合评价澄清剂处理前后的蛋白稳定性,结果如表3所示。澄清剂处理后,黄酒的非生物稳定性得到提高,其中以单宁处理过的酒样效果尤为明显,90℃水浴6h后浊度仅增加了1.92NTU,远远低于未进行稳定处理酒样增加的浊度(9.72NTU),而两种硅胶和PolyclarRBrewbrite处理过的酒样热稳定性提高幅度不大。乙醇-浊度法是通过加入乙醇,破坏黄酒中的蛋白质与多酚结合形成的动态平衡,使酒体的浊度产生变化,加入相同量的乙醇时,浊度变化大则稳定性差,反之亦然,是一种快速预测黄酒稳定性的新方法。向澄清剂处理前后的酒样中添加50%的乙醇,测其浊度变化,澄清剂处理后的酒样浊度增加量都低于原酒样,其中,单宁和硅胶2处理过的酒样浊度增加量较小。强制老化则是通过高低温交替存放,促进黄酒中混浊的形成,相当于快速的自然存放。强制老化3个循环后,酒样的浊度增加,单宁处理过的酒样浊度增加量最小。

表3 稳定性实验Table 3 Stabilization treatment
2.2.3 总酸、总糖、氨基酸态氮及酒精度的变化 由2.2.2的稳定性实验可知,单宁对于提高黄酒的稳定性有相当明显的效果。对单宁处理前后的酒样按照国家标准GB/T 13662-2008进行常规指标测定。结果如表4所示,单宁处理后,酒体中氨基酸态氮含量有显著(p<0.05)差异,而总糖、酒精度、总酸及pH等基本不变,且以上指标均符合国家标准。
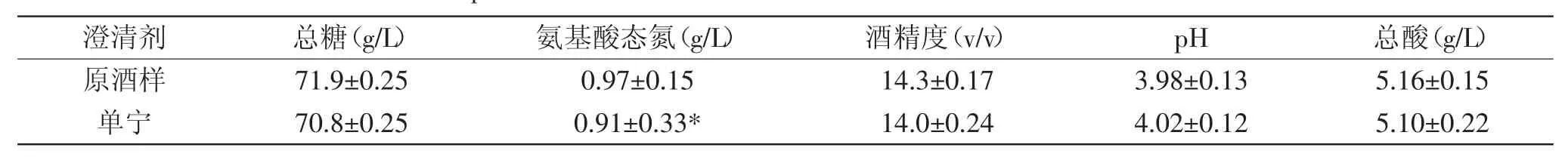
表4 单宁处理对黄酒常规理化指标的影响Table 4 Specifications of Chinese rice wine before and after tannin treatment
3 结论
通过对黄酒混浊的蛋白质成分进行分析,发现黄酒混浊蛋白主要分布于13ku和32.4ku,这与先前研究者认为混浊蛋白主要是高分子蛋白的结果不同[2,5]。应用MALDI-TOF/TOF MS技术鉴定出这两个条带的蛋白质分别为类燕麦蛋白和二聚α-淀粉酶抑制剂,理论等电点处于5.58~8.03之间,均来源于小麦。
各种澄清剂对黄酒的这两种混浊蛋白都有一定的吸附能力,经过澄清剂处理后的黄酒稳定性得到了不同程度的提高,其中,单宁的效果优于其他几种澄清剂,且保持了酒样原有的品质。
[1]顾国贤.酿造酒工艺学[M].北京:中国轻工业出版社,2012.
[2]林峰,白少勇,邹慧君.黄酒蛋白质沉淀[J].酿酒科技,2005(9):69-72.
[3]钱俊青,张笑麟,张西宁.黄酒析出物化学成分的分析测定[J].食品科学,1997(3):45-49.
[4]谢广发,孟中法,周建弟.黄酒蛋白质的测定及其沉淀原因探讨[J].酿酒科技,2002(3):64-68.
[5]谢广发,周建弟,胡志明.瓶装黄酒酒脚成分的测定[J].酿酒科技,2002(6):80.
[6]杨国军,俞关松,尉冬青.黄酒中蛋白质分布及含量与酒质稳定性关系的研究[J].中国酿造,2005(10):47-49.
[7]代同现,张艳茹.膨润土澄清剂在黄酒除浊中的应用[J].酿酒,2001(5):85.
[8]丁筑红,王准生,谭书明.壳聚糖皂土澄清剂对发酵酒澄清作用的研究[J].中国酿造,2005(11):11-15.
[9]钱俊青,蒋同隽,徐国明.应用PVP提高黄酒稳定性的研究[J].食品工业,1997(4):24-26.
[10]朱强,夏艳秋,陈静.黄酒除浊剂的筛选及除浊条件的研究[J].酿酒,2004(4):93-94.
[11]金蓓.啤酒混浊蛋白组分的分离鉴定[J].食品科学,2011,32(3):86-90.
[12]曹佐武.有效分离1kDa小肽的Tricine-SDS-PAGE方法[J].中国生物工程杂志,2004(1):74-76.
[13]谭新勇.黄酒非生物混浊的初步研究[D].无锡:江南大学,2013.
[14]管敦仪.啤酒工业手册[M].北京:中国轻工业出版社,2009.
[15]Juinn-Chin Hsu,David A.Heatherbell.heat-unstable proteins in wine.I.Characterization and removal by bentonite fininf and heat treatment[J].American Journal of Enology and Viticulture 1987,38(1):11-16.
[16]蔡小云.黄酒乙醇—浊度法及其机理研究[D].杭州:浙江大学,2008.
[17]中国国家标准化管理委员会.黄酒[M].北京:中国标准出版社,2008.
[18]Iimure,Takashi,Sato.Beer proteomics analysis for beer quality control and malting barley breeding[J].Food Research International,2013,54(1):1013-1020.
[19]魏慧.小麦中类燕麦贮藏蛋白avenin-like的基因克隆、原核表达及加工品质效应研究[D].咸阳:西北农林科技大学,2012.
[20]Silano V,FuriaM,Gianfreda L,etal.Proteinaceousα-amylase inhibitors[J].Biochimica et Biophysica Acta(BBA)-Proteins and Proteomics,2004,1696(2):12.
[21]王文蒙.α-淀粉酶抑制剂的提取、分离及性质研究[D].天津:天津商业大学,2010.
[22]Silano V,Furia M,Gianfreda L,et al.Inhibition of amylases from different origins by albumins from the wheat kernel[J]. Biochimica et Biophysica Acta(BBA)-Enzymology,1975,391(1):170-178.
[23]Iulek J,Franco OL,Silva M,et al.Purification,biochemical characterisation and partial primary structure of a new alphaamylase inhibitor from Secale cereale(rye)[J].The International Journal of Biochemistry&Cell Biology,2000,32(11-12):1195-1204.
Study on fining agents on removing the haze protein in Chinese rice wine
FAN Shi-ying1,2,3,SUN Jun-yong1,2,3,XIE Guang-fa3,4,LU Jian1,2,3,5,*
(1.The Key Laboratory of Industrial Biotechnology,Ministry of Education,School of Biotechnology,Jiangnan University,Wuxi214122,China;2.National Engineering Laboratory for Cereal Fermentation Technology,Jiangnan University,Wuxi214122,China;3.School of Biotechnology,Jiangnan University,Wuxi214122,China;4.National Engineering Research Center for Chinese RiceWine,China Shaoxing Rice Wine Group Co.,Ltd,Shaoxing 312000,China;5.Industrial Technology Research Institute of Jiangnan University in Suqian,Suqian 223800,China)
The tannin,silica and PolyclarR Brewbrite were used to remove haze protein in Chinese rice wine. Themolecular weight of protein in the haze was investigated by Tricine-sodium dodecyl sulfate-polyacrylamide gelelectrophoresis(Tricine-SDS-PAGE). The proteins in the haze of Chinese rice wine and absorbed by finingagent were identified by matrix - assisted laser desorption ionisation - time of flight / time of flight massspectrometry(MALDI-TOF/TOF MS). Lundin fraction and colloidal stability of Chinese rice wines before andafter fining were analyzed. The results showed that the main components of haze protein in Chinese rice winewere avenin-like protein and dimer α-amylase inhibitor,deriving from the Triticum aestivum. All of the finingagents were able to absorb the haze protein and improve the colloidal stability of Chinese rice wine,especiallythe tannin.
Chinese rice wine;fining agent;haze protein;MALDI-TOF/TOFMS;colloidal stability
TS201.1
A
1002-0306(2015)08-0167-05
10.13386/j.issn1002-0306.2015.08.025
2014-07-01
樊世英(1990-),女,硕士研究生,主要从事酿酒方面的研究。
*通讯作者:陆健(1968-),男,教授,研究方向:酿酒科学与工程。
973项目(2012CB720802);973项目(2013CB733602);安全食品精深加工科技创新平台建设(2012B091400030);国家自然科学基金重点项目(31130043);江苏高校优势学科建设工程资助项目;高等学校学科创新引智计划(111计划)资助项目(111-2-06)。
