两种方法检测食用油脂中的多环芳烃
2015-10-24曹梦思张立实阮丽萍王格平严卫星
曹梦思,张立实,王 君,阮丽萍,王格平,郑 超,严卫星
(1.四川大学华西公共卫生学院,四川成都610041;2.国家食品安全风险评估中心,北京100022;3.江苏省疾病预防控制中心,江苏南京210009;4.丰益(上海)生物技术研发中心有限公司,上海200137)
两种方法检测食用油脂中的多环芳烃
曹梦思1,2,张立实1,*,王 君2,*,阮丽萍3,王格平4,郑 超4,严卫星2
(1.四川大学华西公共卫生学院,四川成都610041;2.国家食品安全风险评估中心,北京100022;3.江苏省疾病预防控制中心,江苏南京210009;4.丰益(上海)生物技术研发中心有限公司,上海200137)
分别建立同位素内标定量-QuEChERS净化-气相色谱-三重四级杆串联质谱法(方法一)和GPC自动净化-高效液相色谱-荧光检测法(方法二)两种方法,为检测食用油脂中欧盟优先控制的16种多环芳烃(EU15+1PAHs)提供了快速有效的方法。分别对104份食用油脂样品进行分析比较,对比两方法检测结果。结果表明:两方法均满足国内外对食品中PAHs检测的要求,方法一、方法二精密度实验RSD值分别小于5.4%、6.81%,平均加标回收率除个别外,分别在71.3%~111.6%、93.1%~119%范围内,RSD值分别小于5.0%、5.5%;标准曲线线性方程相关系数分别大于0.998、0.990,方法一定量限范围为0.23~0.50μg/kg,方法二定量限为0.9μg/kg、检出限为0.3μg/kg;英国食品化学分析实验室能力验证(FAPAS)盲样测定结果均达到规定检测结果;两方法对104份油样的两组检测结果无统计学差异,整体分析和分不同油种比较结果基本一致。结论:建立了针对食用油中EU15+1PAHs的分析方法,两方法均满足相应检测要求,且具有良好的准确性和实用性。
食用油脂,欧盟优控,多环芳烃,气相色谱-三重四级杆串联质谱法,高效液相色谱-荧光检测法
多环芳烃(polycyclic aromatic hydrocarbons,PAHs)的性质及危害近年来已被大量研究证实,其膳食暴露危害(某物质通过饮食摄入途径进入人体对人体产生的危害,膳食暴露量=食品化学物质含量×食品消费量/人体体重)也已受到广泛关注[1-3]。研究表明,不同类别食品中都曾检出PAHs[4],而由于其具有强亲脂性,食用油脂中往往含量较高,并成为膳食暴露的主要贡献者,约占总膳食摄入PAHs的1/3[5]。目前单独针对苯并(a)芘[B(a)P]的分析方法已较为成熟,但对于PAHs混合物的分析大多仍针对美国环境保护署(United States Environmental Protection Agency,USEPA)提出的环境中应优先监测的16种PAHs[萘、菲、蒽、芘、苊、芴、苊烯、荧蒽、苯并(g,h,i)苝、苯并(a)蒽、屈、苯并(b)荧蒽、苯并(k)荧蒽、茚并(1,2,3-cd)芘、苯并(a)芘、二苯并(a,h)蒽],而近期研究发现USEPA监控的16种PAHs并不能真实反映出食品中PAHs混合物的总毒性效应,因此食品添加剂联合专家委员会(Joint Expert Comm ittee on Food Additive,JECFA)[6]依据文献研究总结了13种具有明确的基因毒性和致癌性的PAHs[苯并(a)蒽、苯并(a)芘、苯并(b)荧蒽、苯并(j)荧蒽、苯并(k)荧蒽、屈、二苯并(a,h)蒽、二苯(a,e)芘、二苯(a,h)芘、二苯(a,i)芘、二(a,l)芘、茚并(1,2,3-cd)芘、5-甲基屈]且建议加强苯并(c)芴的检测,欧盟食品安全管理局(European Food Safety Authority,EFSA)在此基础上提出了16种应优先控制的PAHs[4][下文简称EU15+1PAHs,比JECFA增加了1,12-苯并芘、环戊并(c,d)芘和苯并(c)芴],因此检测EU15+ 1PAHs更能真实反映食品中PAHs混合物的污染情况及毒性效应。
但是目前针对EU15+1PAHs的分析测定,尚属探究阶段,国内外对食品中EU15+1PAHs的分析均未规定具体方法和方法的性能指标。国外采用较多的是高效液相/荧光检测法(HPLC-FLD)和气质联用法(GC-MS/-MSMS),前处理方法依情况各异,缺乏统一的检测方法;国内对此研究极少,仍处于USEPA提出的16种PAHs阶段。鉴于此,本研究组织两实验室分别建立萃取方法——同位素内标(氘代内标)定量-QuEChERS(Quick、Easy、Cheap、Effective、Rugged、Safe的缩写)快速净化-气相色谱-三重四级杆串联质谱法(下文简称方法一)和GPC自动净化-高效液相色谱-荧光检测法(下文简称方法二)两种方法,探索其对EU15+1PAHs分析的适用性,并通过对购自市场的104份食用油脂样品进行检测分析来比较两方法的可行性和准确性。
1 材料与方法
1.1 材料与仪器
食用油脂样品 共104份油脂样品,主要采自北京、上海、广东等正规超市、农贸市场、粮油批发市场等,涉及12种常见油种,10种植物油(菜籽油、花生油、芝麻油、葵花籽油、橄榄油、大豆油、棕榈油、茶油、玉米油、稻米油)和2种动物油(猪油、牛油);正己烷、二甲基亚砜、乙腈、环己烷∶乙酸乙酯(1∶1) 均为色谱纯;水 超纯水;氘代内标标准品 德国o2si;QuEChERS混合填料 德国CNW公司;15种PAHs混合标准品 美国Accustandard公司;FAPAS棕榈油样品 编号为T0648QC,包含5种PAHs物质,FAPAS中国代理处。
万分之一电子天平;氮吹浓缩仪;涡旋振荡器;离心机;100μL、1000μL移液器 德国Eppendorf;DB-EUPAH专用色谱柱 20m×0.18mm,0.14μm,安捷伦;TSQ Quantum XLS 美国,赛默飞世尔科技有限公司;液相色谱柱 Waters PAH C185μm×4.6mm× 250mm column,Waters公司;GPC自动净化器;液相色谱仪-荧光检测器 HP100型。
1.2 实验方法
1.2.1 样品前处理 采样完成后,分别取等量分装到两套同样的棕色玻璃瓶中,编号、避光、常温、密封保存,分送两实验室待测。
方法一:称取约1g油脂样品于50m L离心管中,加入1ng/m L的混合氘代内标溶液1m L,依次加入5m L正己烷和5m L二甲基亚砜,震摇、4500r/m in离心3m in,取下层至另一50m L离心管中,依次加入5m L超纯水和5m L正己烷,摇匀、必要时4500r/m in离心3m in,取上层至8m L样品瓶中,氮气缓慢吹干,加入约0.2g QuEChERS混合填料和1m L乙腈,涡旋震摇1min以上,5000r/m in离心5m in,取上清液上机检测。
方法二:参考《食品安全国家标准 植物油中多环芳烃的测定》(GB/T 23213-2008),称取约1g食用油,加入环己烷∶乙酸乙酯(1∶1)至10m L,GPC分离。收集4m L馏分,自然晾干,加0.5m L乙腈复溶,HPLC-荧光检测。
1.2.2 检测条件 方法一:色谱条件:程序升温过程为45℃保持0.8min,以45℃/min升至200℃,再以2.5℃/min升至225℃,再以3℃/min升至245℃,随后以0.5℃/m in升至247℃,再以6℃/m in升至300℃,最后以10℃/m in升至320℃,保持4.5m in;进样口温度:280℃;进样方式:PTV不分流进样,进样量为5μL;载气为氦气,恒流模式;碰撞气为氩气。质谱条件包括,电子轰击离子源;传输线温度为320℃;离子源温度为260℃;接收极电流50μA;溶剂延迟时间10.0m in;碰撞气体为氩气[7]。
方法二:GPC条件基本同《食品安全国家标准植物油中多环芳烃的测定》(GB/T 23213-2008),流动相:乙酸乙酯+环己烷(5+5),流速:5.0m L/m in,进样量:5m L,收集时间:30m in开始收集,共收集22m in,收集4m L浓缩液;液相色谱条件基本同《动植物油脂多环芳烃的测定》(GB/T 24893-2010),流动相:乙腈/水,流速:0.4m L/m in,柱温:30℃,进样量:20μL。
1.2.3 方法学验证实验 两方法建立过程中均开展了相应的实验,包括标准曲线绘制、精密度实验、重复性实验、加标回收率实验。
1.2.4 样品分析 采用上述两方法检测条件,两实验室分别针对FAPAS棕榈油样品进行盲检,后分别检测待测样品;方法一以保留时间及碎片离子相对丰度定性、内标标准曲线定量,方法二依据出峰保留时间定性,峰面积、工作曲线外标法定量。
1.2.5 数据处理 对比两套数据,判断并剔除异常值,未检出值赋值为方法的1/2检出限,采用SPSS17.0进行统计分析,比较两方法结果。
2 结果与讨论
2.1 检测条件分析
2.1.1 前处理方法的对比 方法一采用QuEChERS净化提取后的样品(0.2g QuEChERS萃取一次),结果表明该净化法相比于其他净化法(如液-液萃取、固相萃取、浊点萃取法)操作简单、省时省力,且效果较好。近几年,该法成为国外食品PAHs分析中前处理的热门方法[8-10],但国内研究较少,且只是针对USEPA提出的16种PAHs[11-12],使用该前处理方法分析EU15+ 1PAHs还是首次。
方法二采用的凝胶渗透色谱法借鉴我国国标(GB/T 23213-2008)推荐方法,结合全自动操作,使操作更加简便省时,且降低了人为操作误差,提高了净化效率和准确度。两方法各有优缺点,可按实际实验室条件选择。
2.1.2 质谱条件的选择 根据气相色谱分离和质谱全扫描,确定15+1种多环芳烃及4种氘代内标的保留时间和母离子,选择不同的碰撞能量对母离子进行电子轰击,选择每种化合物的最佳监测离子对和最佳碰撞能量,同时对每组化合物的质谱扫描宽度和扫描时间进行优化。得到最佳的质谱分析条件。按1.2所示条件进样,在SRM模式下,10.0μg/L的15+1种欧盟优控PAHs混合标样的总离子流图见图1。
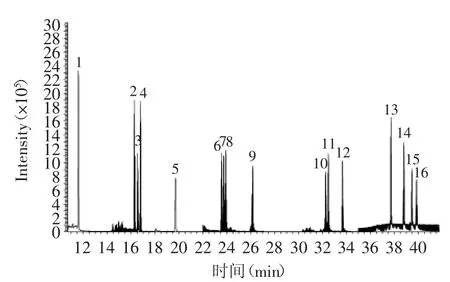
图1 15+1种欧盟优控多环芳烃混合标样SRM模式下总离子流图Fig.1 Total ion chromatogram of EU15+1PAHs standard solution
2.1.3 液相色谱条件的选择 借鉴《动植物油脂多环芳烃的测定》(GB/T 24893-2010),由于本法环戊(c,d)芘、苯并(j)荧蒽、二苯并(a,l)芘在液相色谱荧光仪器上的检测限为10μg/kg,不能满足检测要求,因此本法只能检测除这3种物质外的欧盟优控的13种PAHs;该方法13种欧盟优控PAHs混合标样的标准色谱图见图2。
2.2 方法学参数

图2 13种欧盟优控PAHs混合标样的标准色谱图Fig.2 Chromatogram of 13 EUPAHs standard solution
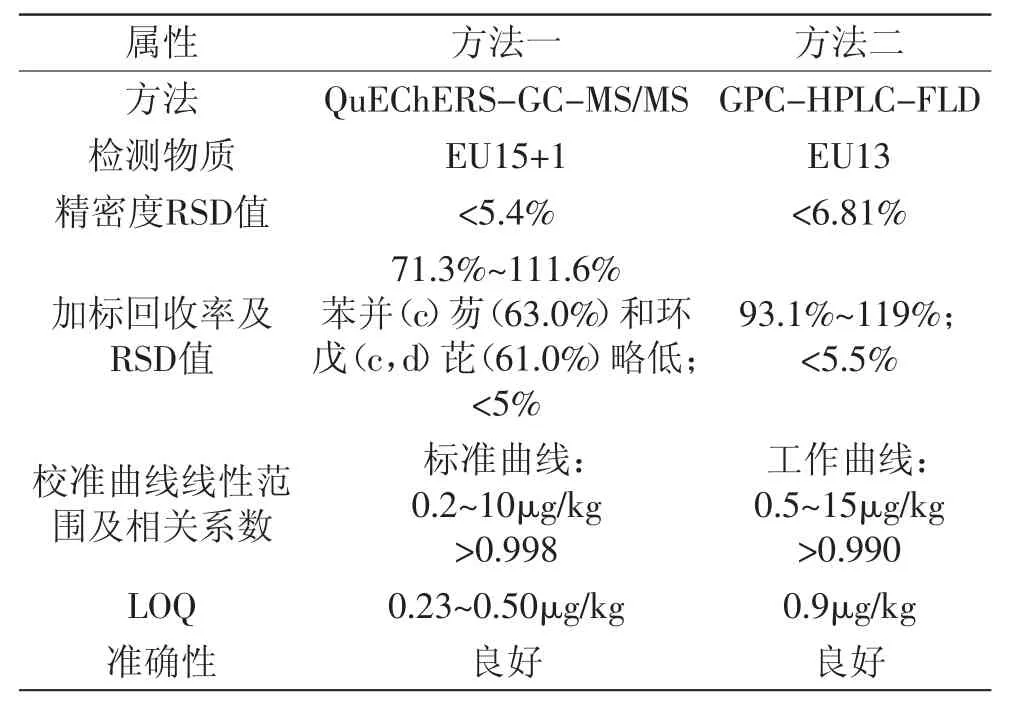
表1 两方法方法学参数Table 1 Methodology parameters of the twomethods
两种方法的主要方法学参数见表1。
由上述两套方法学参数的比较可看出,两方法均达到了我国标准《实验室质量控制规范食品理化检测》(GB/T 27404-2008)的要求,且满足欧盟(EC)No 333/2007对于B(a)P的检测要求(检出限<0.3μg/kg、定量限<0.9μg/kg、回收率在50%~120%之间)。从检测物质来看,方法一比方法二检出物质更加全面;且由于方法二只依据出峰保留时间定性,而方法一同时参考保留时间和质谱碎片离子相对丰度定性,因此方法一特异度优于方法二;从上述参数来看,方法一定量限更低,在痕量分析时更具优势(由于两方法在实验条件、设备、方法、操作人员方面完全属于两个实验系统,因此该结论不确定性较大)。而方法二较于方法一虽在某些方法学性能方面略有差异,但本法参考自国标推荐方法,具有操作简便、人工操作较少、定量准确、实验条件易于实现等优势,其中无法检测的3种PAHs,通过参考文献及方法一的结果可知其含量水平均很低,因此对整个EU15+1PAHs检测结果影响有限。
欧盟曾针对15+1PAHs组织了参比实验室测试,第一次参比测试时发现其中的环戊并(c,d)芘和某些二苯并物质[如二苯并(a,h)芘、二苯并(a,i)芘]较难分析[13];第二次则有所改善,几乎所有参比实验室都能分析出加标橄榄油中的15+1PAHs[14]。从目前状况看,本研究中的两方法已达到欧盟第一次参比测试的检测水平,因此两方法虽均可用于食用油脂中低浓度EU15+1PAHs的检测且满足检测需求,但仍存在一定的局限性需要进一步完善。
2.3 FAPAS盲样测定
两方法针对FAPAS棕榈油样品的盲检结果表明,两方法对以下5种PAHs的测定结果与标准结果差异不大,除方法二苯并(b)荧蒽检测值略高外,其他均符合FAPAS规定的可接受范围,具体结果见表2。
另,该5种物质中有3种物质为PAH 4物质[欧盟设定PAHs限量标准的指标物质,包括:B(a)P、屈、苯并(a)蒽、苯并(b)荧蒽],而由于屈污染水平往往较高,检测结果准确度也较高,因此该盲样测定结果保障了后续样品中PAH 4的准确测定。

表2 两方法检测FAPAS棕榈油样品的结果(μg/kg)Table 2 Results of the FAPAS samples(μg/kg)
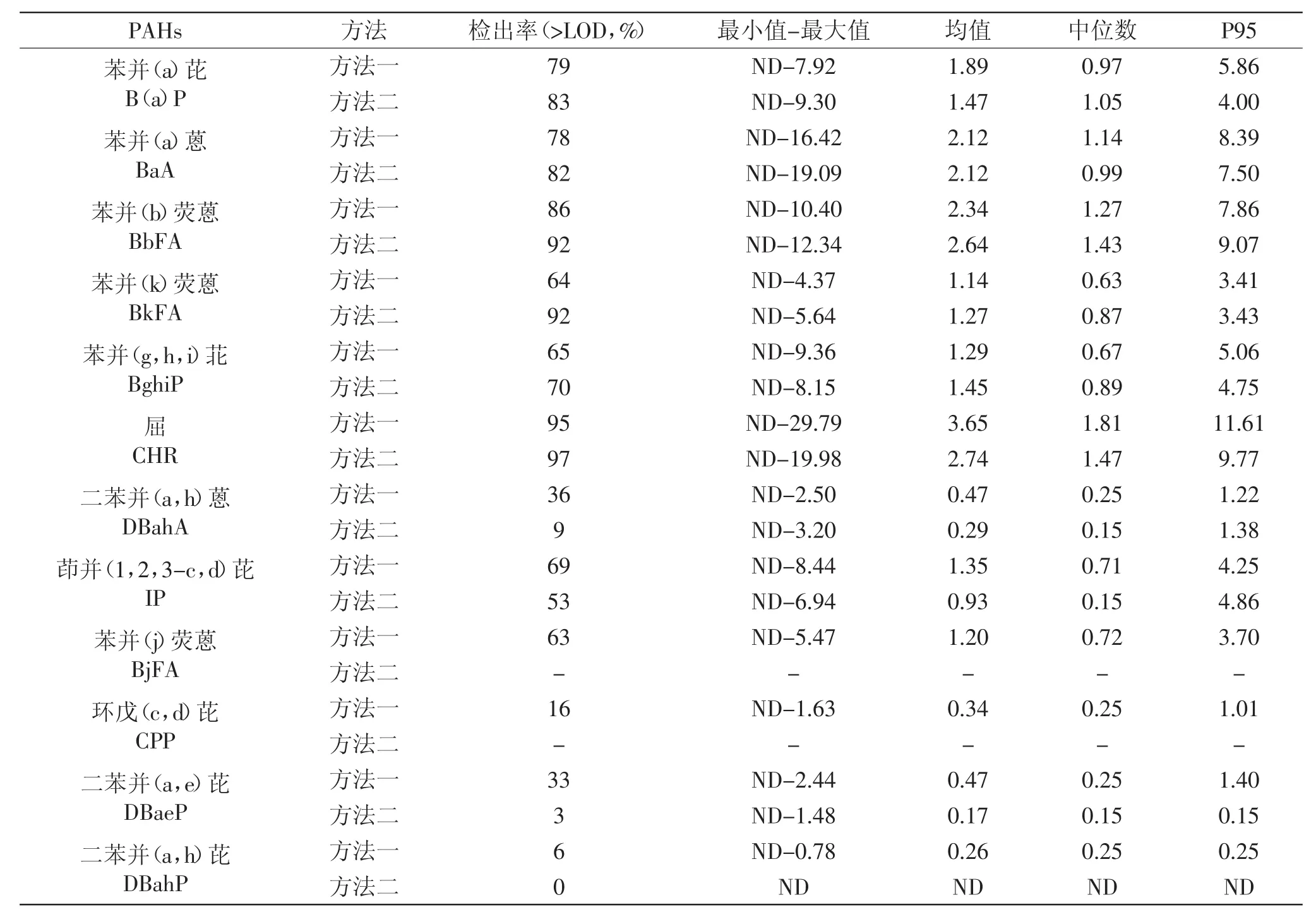
表3 104份样品两种方法检测结果(μg/kg)Table 3 Results of the 104 samples(μg/kg)
续表
2.4 实际样品测定
2.4.1 总体情况 对两种方法的检测结果进行配对设计t检验,差异无统计学意义(p>0.05)。
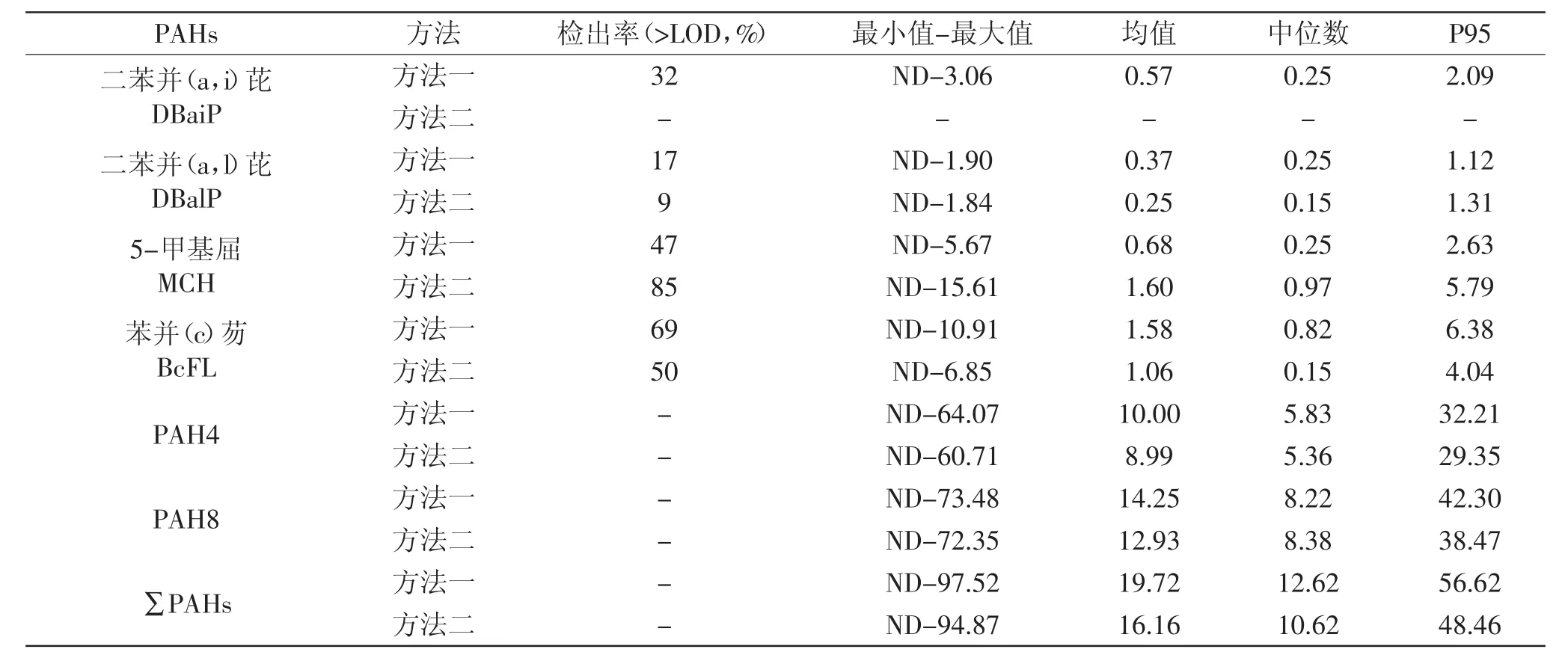
所检样品中只有3个样品EU15+1PAHs均未检出,均为稻米油样品,其余样品普遍有检出。两方法检出结果的具体比较见表3。两方法检出率范围分别为6%~95%(方法一)、0%~97%(方法二),平均污染水平范围分别为0.26~3.65μg/kg(方法一)、ND~2.74μg/kg(方法二);EU15+1PAHs中屈的污染最为严重,不论检出率还是平均值均为最高,其次是苯并(b)荧蒽、苯并(a)蒽、B(a)P,而多数二苯并物质污染水平则较轻,如二苯并(a,h)芘、二苯并(a,l)芘等,这与欧盟对食品开展的研究报告[4]情况基本一致;由于二苯并类物质含量较低且分析难度大[4],两方法检出率差别较大且测定值均极低甚至未检出,这也提示了针对EU15+1PAHs的分析方法还需加大研究,进一步改善缺陷。两方法除较难检测的物质(如二苯并物质)外其余物质检出率、平均污染水平均较为一致。

表4 典型油种中EU15+1PAHs的平均含量(μg/kg)Table 4 Results of the typical oil samples(μg/kg)
将本研究结果与国内外相关文献研究结果进行比较,发现各PAHs的平均污染水平及趋势相当。如2012年张志玮等针对江苏市售植物油的分析结果发现PAH 4和B(a)P的平均含量分别为20.50和1.95μg/kg[15],与本研究结果相当[∑PAH4在方法一和方法二中的结果分别为10.00、8.99μg/kg;B(a)P在方法一和方法二中的结果分别为1.89、1.47μg/kg];M.C.Rojo Camargo等[16]检测了巴西市售11个不同品牌的大豆油中JECFA提出的15种PAHs的含量,B(a)P检测结果在0.5~15.8μg/kg、平均值为3.0μg/kg,其他物质结果也与本文两方法结果接近。Lucie Drabova等[17]2013年对市售食用植物油(包括大豆油、芝麻油、葵花籽油、橄榄油)中EU15+1PAHs进行了检测,结果与本研究中检测结果情况基本一致,屈的含量均为最高,且二苯并芘类物质含量较低,其中二苯并(a,h)芘、二苯并(a,i)芘均为未检出。
2.4.2 重点油种检测结果 根据《中国居民营养与健康状况调查(2002年版)》我国居民消费量前3位的食用油种分别为大豆油、菜籽油、花生油[18],茶籽油是在PAHs研究中较为关注的油种,对这4种油中EU15+1PAHs检测结果平均水平的比较见表4,采用配对t检验比较两方法结果,4种油两种方法均值比较的t值均>0.05,因此两组结果无统计学差异。
3 结论与讨论
本研究中的两方法均满足国内外对食品中PAHs检测的要求。从检测物质来看,方法一比方法二检出物质更加全面;且由于方法二只依据出峰保留时间定性而方法一同时参考保留时间和质谱碎片离子相对丰度定性,因此方法一特异度优于方法二;方法学性能方面,方法一定量限更低,在痕量分析时更具优势;而方法二具有操作简便、人工操作较少、定量准确等优势,建议如不需要对EU15+1PAHs的16种物质全面分析[如只需分析B(a)P、PAH 4或PAH 8]可采用方法二。两方法均达到了我国标准《实验室质量控制规范食品理化检测》(GB/T 27404-2008)的要求,且满足欧盟(EC)No 333/2007对于B(a)P的检测要求(检出限<0.3μg/kg、定量限<0.9μg/kg、回收率在50%~120%之间)。目前我国国标规定B(a)P的最大限量值为10μg/kg,欧盟规定B(a)P为2μg/kg,PAH4为10μg/kg,上述两方法也均可满足低于这些指标值的PAHs含量的检测。
FAPAS盲样测定结果均在规定浓度范围内,进一步验证了本研究两方法的可行性和准确性。针对104份实际油样的分析,两方法结果无统计学差异,且不论是总样本整体比较还是分不同油种比较,两方法检测结果基本一致,同时也得到了国内外相关研究的验证,证实了本研究针对EU15+1PAHs探索的两方法在实际分析工作中具有良好的准确性和实用性。本研究是国内首次针对EU15+1PAHs分析技术进行的探讨,为我国分析油脂中EU15+1PAHs提供了基础。由于是初步探索,因此相比于国外,仍存在一定的局限性(如一些含量低的二苯并类物质难度较大),还需进一步研究加以完善。
[1]Ramesh A,Walker SA,Hood D B,et al.Bioavailability and risk assessment of orally ingested polycyclic aromatic hydrocarbons[J].International Journal of Toxicology,2004,23(5):301-333.
[2]岳敏,谷学新.多环芳烃的危害与防治[J].首都师范大学学报:自然科学版,2003,24(3):40-44.
[3]ATSDR(U.S.Department of Health and Human Services,Public Health Service,Agency for Toxic Substances and Disease Registry).Toxicological profile for polycyclic aromatic hydrocarbons[R].1995.
[4]EFSA.Polycyclic Aromatic hydrocarbons in food scientific opinion of the panel on contaminants in the food chain[R].The EFSA Journal,2008,724:1-2.
[5]IBANEZR,AGUDO A,BERENGUER A,etal.Dietary intake of polycyclic aromatic Hydrocarbons in a Spanish population[J].Food Pmt,2005,68(10):2190-2195.
[6]JECFA.Safety evaluation of certain contaminants in food: polycyclic aromatic hydrocarbons[R].WHO FOOD ADDITIVES SERIES:55,2006:563-744.
[7]乔晚芳,李燕艳,姜元荣,等.QuEChERS快速净化-同位素稀释内标定量GC-MS/MS法测定食用油中15+1种欧盟优控的痕量多环芳烃[C].第二十三届学术年会暨产品展示会中国粮油学会油脂分会,2014:228-234.
[8]Surma M,Sadowska-Rociek A,Cies'lik E.The application of d-SPE in the QuEChERS method for the determination of PAHs in food of animal origin with GC-MS detection[J].European Food Research and Technology,2014,238(6):1029-1036.
[9]Forsberg N D,Wilson G R,Anderson K A.Determination of Parent and Substituted Polycyclic Aromatic Hydrocarbons in High-Fat Salmon Using a Modified QuEChERS Extraction,Dispersive SPE and GC-MS[J].Journal of Agricultural and Food Chemistry,2011(15):8108-8116.
[10]Madureira T V,Velhote S,Santos C,et al.A step forward using QuEChERS(Quick,Easy,Cheap,Effective,Rugged,and Safe)based extraction and gas chromatography-tandem mass spectrometry—levels of priority polycyclic aromatic hydrocarbons in wild and commercial mussels[J].Environmental Science and Pollution Research,2014,21(9):6089-6098.
[11]王丹红,吴文晞,李捷,等.QuEChERS/高效液相色谱测定食品中15种多环芳烃[J].福建分析测试,2013,22(6):17-20.
[12]张萌萌,陈剑伟,于天祥,等.基质固相分散技术-气质联用法快速测定大米中的多环芳烃[J].食品科技,2014,39(1):327-330.
[13]EC-DG-JRC-IRMM/CRL(European Commission,Directorate General,Joint Research Centre,Institute for Reference Materials and Measurements/Community Reference Laboratory for polycyclic aromatic hydrocarbons).Report on the first inter-laboratory comparison testorganised by the Community Reference Laboratory for Polycyclic Aromatic Hydrocarbons,15+1 EU priority PAHs in acetonitrile.EUR 22696 EN,European Communities[R].2007.
[14]EC-DG-JRC-IRMM/CRL(European Commission,Directorate General,Joint Research Centre,Institute for Reference Materials and Measurements/Community Reference Laboratory for polycyclic aromatic hydrocarbons).Report on the second inter-laboratory comparison testorganised by the Community Reference Laboratory for Polycyclic Aromatic Hydrocarbons,15+1 EU priority PAHs in edibleoil and acetonitrile.EUR 23251 EN,European Communities[R].2008.
[15]张志玮,马永建,刘华良,等.江苏省市售食用植物油中多环芳烃污染状况分析[J].江苏预防医学,2012,23(5):57-58.
[16]Rojo CamargoM C,AntoniolliPR,Vicente E,etal.Polycyclic aromatic hydrocarbons in Brazilian commercial soybean oils and dietary exposure[J].Food Additives and Contaminants:Part B,2011,4(2):152-159.
[17]Drabova L,Tomaniova M,Kalachova K,et al.Application of solid phase extraction and two-dimensional gas chromatography coupled with time-of-flightmass spectrometry for fastanalysis of polycyclic aromatic hydrocarbons in vegetable oils[J].Food Control,2013,33(2):489-497.
[18]翟凤英,杨晓光.中国居民营养与健康状况调查报告之二·2002膳食与营养素摄入状况[R].2002.
The determination of polycyclic aromatic hydrocarbons in edible fats and oils with two methods
CAO Meng-si1,2,ZHANG Li-shi1,*,WANG Jun2,*,RUAN Li-ping3,WANG Ge-ping4,ZHENG Chao4,YANWei-xing2
(1.West China Public Health School of Sichuan University,Chengdu 610041,China;2.China National Center for Food Safety Risk Assessment,Beijing 100022,China;3.Jiangsu Provincial Center for Disease Prevention and Control,Nanjing 210009,China;4.Fengyi Biological Technology Research Center Co.,Ltd.,Shanghai200137,China)
The purpose was to detect EU 15+1PAHs in edible fats and oils by establishing two motheds that were the isotope internal standard quantified-QuEChERS-gas chromatog raphy-tandem mass spectrometry and the GPC-high performance liquid chromatography-fluorescence detection.104 edible oils and fats samples was detected.Then the results of the two motheds were com pared.Results:both methods met the detection requirements.The RSD of precision were less than 5.4%(Method One)and 6.81%(Method Two)and the average recoveries of spiked samples were in the range of 71.3%~111.6%(Method One)and 93.1%~119%(Method Two).The correlation coefficiency of standard curves were over 0.998(Method One)and 0.990(Method One).The quantitation limit of the two motheds were 0.23~0.50μg/kg and 0.9μg/kg respectively.The blind determination results for the samples from the Food Analysis Performance Assessment Scheme(FAPAS)were satisfactory.The results of two methods for 104 samples had no differences by statistical evaluation.Conclusion: both methods meet the testing requirements for the determination of EU 15+1PAHs in edible fats and oils.
edible fats and oils;European Union priority;PAHs;gas chromatography-tandem mass spectrometry;high performance liquid chromatography-fluorescence detection
TS201.1
A
1002-0306(2015)08-0082-06
10.13386/j.issn1002-0306.2015.08.008
2014-10-08
曹梦思(1991-),女,硕士研究生,研究方向:食品安全风险评估和标准。
*通讯作者:张立实(1956-),男,教授,研究方向:食品安全风险评估。王君(1973-),女,博士,研究员,研究方向:食品安全。
