Lcyb基因与辣椒红素合成的关系
2015-10-23田士林
李 莉,田士林
(黄淮学院生物工程系,河南 驻马店643000)
辣椒不仅是一种重要的蔬菜作物,还是天然食品色素的主要来源。成熟的辣椒果实常见的有红、黄、橙等颜色,其中红色辣椒果实是食品色素的主要来源。辣椒红素(3,3′-dihydroxy-β,k-Caroten-6′-one)是辣椒果实红色的主要成分,是一种兼具安全、营养和保健作用的天然食用色素,分子式为C40H56O3[1]。它主要存在于辣椒(Capsicum annuum L.)果皮色素母细胞中的类囊体膜上,占总类胡萝卜素含量的60%以上[2]。Lcyb是调控β-胡萝卜素合成的关键酶基因,其表达强弱直接会影响 β-胡萝卜素的合成[3,4],但Lcyb缺失或突变能否影响果实中辣椒红素含量的变化未见相关报道。为此,本文通过Lcyb沉默,探讨Lcyb对辣椒果实中辣椒红素含量的影响,旨在为辣椒红素合成调控机理的解析提供新信息。
1 材料与方法
1.1 试验材料
辣椒R15(Capsicum annuum cv.R15)由西北农林科技大学辣椒课题组惠赠。
1.2 载体构建
烟草脆裂病毒(TRV)被作为基因沉默载体,根据TRV结构,设计含有上游BamHI酶切位点(F:5’-CGCGGATCCCATTGCCCTTTAATCATTTATT-3’)和下游含有Kpn I位点(R:5’-CGGGGTACCTTCACAGAGCTAAAGGCACTAAC-3’)的引物,随后被转转化到TRV载体中。在本次实验中,cv.R15材料绿熟期的果实被用来作为病毒诱导基因沉默(VIGS)实验材料。以下是烟草脆裂病毒的结构示意图以及载体构建示意图(图1)。
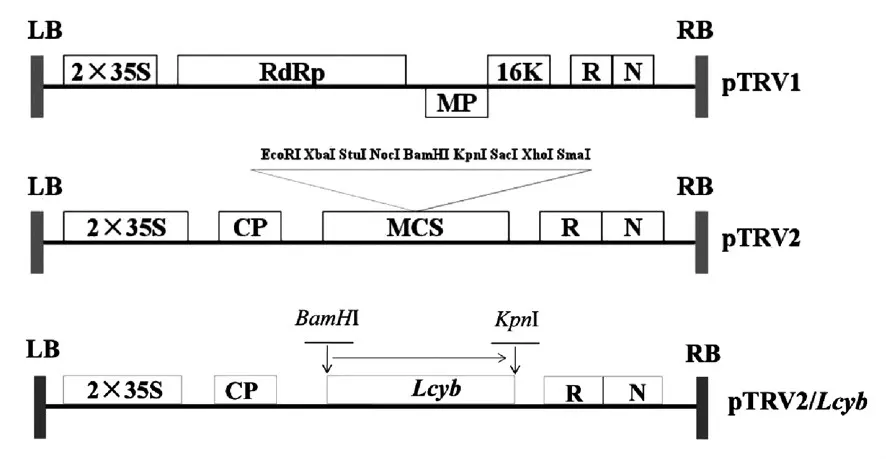
图1 载体构建结构示意图Fig.1 Construction of TRV expression vector
LB:T-DNA左边界;RB:T-DNA右边界;2×35S:35S启动子;CP:外壳蛋白;RdRp:RNA依赖性RNA聚合酶;MP:移动蛋白;16K:16 KDa蛋白;R:核酶;N:NOS终止子;MCS:多克隆位点;pTRV2/Lcyb为Lcyb基因和TRV2连接形成的重组载体。
采用Trizol方法提取果实总RNA,反转录为cDNA,cDNA被作为模板为PCR扩增。PCR扩增产物用琼脂糖凝胶电泳分离,DNA凝胶试剂盒回收目的片段,之后回收产物用T4 DNA连接酶16℃过夜连接到克隆载体pMD19-T上,然后转入大肠杆菌DH5a中。经测序检验证明无移码突变或碱基缺失,然后把目标片段从PMD19-T载体上用酶BamHI和KpnI切下来,同时将质粒pTRV2用同样的内切酶切下来。然后将目的片段和pTRV2连接起来,沉默载体构建成功。最后把pTRV1和pTRV2载体通过冻融法转入农杆菌GV3101[5],液氮保存以备后续使用。
1.3 病毒注射
将含有pTRV1、pTRV2及pTRV2/Lcyb菌液分别摇至OD600=1.0。将农杆菌(GV3101)菌液pTRV1分别与农杆菌(GV3101)菌液pTRV2及农杆菌(GV3101)菌液pTRV2/Lcyb的按照1∶1(V/V)混合。在注射前,首先选择果龄、大小、健康状况一致的辣椒绿熟期(花后25 d)果实作为处理和对照材料。然后用注射器针头在辣椒果柄基部扎一个孔,孔的深度为果柄直径的1/2,然后将含有pTRV1、pTRV2(空载体,用TRV/00表示)的菌液及含有pTRV1、pTRV2/Lcyb(携带目的基因的载体,用TRV/Lcyb表示)的菌液用去掉针头的注射器分别注射到绿熟期辣椒果实的果柄中。然后将辣椒连盆放入人工气候室中(温度18℃,相对湿度35%)暗培养两天,然后将人工气候箱调为(23℃,16 h光照)/(20℃,8 h黑暗)的光周期,相对湿度为35%的环境条件下进行培养,15天后,对照组(TRV/00)和沉默组果实(TRV/Lcyb)分别采摘用于后续基因表达和辣椒红素含量的分析。
1.4 基因表达的检测
采用Trizol法分别从对照和沉默组提取辣椒果实的总RNA[6]。用实时定量反转录试剂盒(TaKa-Ra,宝生生物公司,中国)合成第一链cDNA,具体步骤参考试剂盒说明书。基因表达水平的高低采用实时定量PCR技术,用SYBR作为荧光染料,染料购自TaKaRa中国大连宝生生物公司。实时定量PCR采用20μl反应体系,包括10.0μl SYBR Premix Ex Taq II,2.0μl cDNA模板,上下游引物各:6.4μl ddH2O 0.8μl。PCR扩增循环体系为95℃,1 min;95℃,10 s;48℃,30 s;72℃,20 s;总共45循环。Ubi3(AY486137.1)被作为内参基因[7],正向引物序列F:5’-CATTGCCCTTTAATCATTTATT-3’,反向引物序列R:5’-TTCACAGAGCTAAAGGCACTAAC-3’。基因相对表达水平的计算参考Livak等的方法[8]。所有样品一式三份,每个处理三次生物学重复。
1.5 辣椒红素含量的测定
辣椒红素含量的测定采用Tian等(2014)的方法[5]。辣椒红素的抽提具体如下:取5.0 g辣椒果皮组织,加入5 ml丙酮(0.1%BHT)于研钵中,将研钵置于冰上在暗中研磨成糊浆,将研磨后的辣椒组织倒入50 ml的具塞离心管中在3 500 rpm离心10分钟,然后将抽提物转入一个干净的离心管中,样品再用5.0 ml丙酮重复抽提2次,直至残渣为白色为止。合并抽提液于一个新的离心管中,在旋转蒸发干燥器中常温暗光离心蒸干,然后密封管口,用锡箔纸裹包严实后存放于20℃冰箱中以备HPLC检测用。HPLC分析方法参照Tian等(2014)的方法[5]。液相色谱上样体积为20μL,采用C-18柱(5μm,150 mm×4.6 mm)进行色素分离分析。流动相A(乙腈∶2-丙醇∶水/39∶53∶8),流动相B(乙腈∶2-丙醇/60∶40);梯度洗脱:B相0-30 min从0 to 100%;流速设定为0.3 mL/min,柱温为40℃。辣椒红素标准品(0.001-0.1 mg/mL)在454 nm作校准样。根据标样的出峰时间确定样品中的辣椒红素成分及含量。辣椒红素标样购自Extrasynthèse公司(Genay,法国)。所有的样品均在暗光下冰上操作。标样和样品用甲醇∶乙腈(1∶1,V/V)稀释[3]。每组样品测定三个重复。取三次测定的平均值作为该时刻该处理的辣椒红素含量。采用SAS(SAS Institute,version 8.2)分析软件对数据进行处理分析,采用SigmaPlot10.0软件对辣椒红素含量变化和基因表达情况进行作图分析。
2 结果与分析
2.1 VIGS沉默对Lcyb表达的影响
由以上分析得知,沉默Lcyb基因后,辣椒果色的形成受到了影响,导致无论从表型上还是从仪器分析上均说明果实颜色的形成受到了抑制。为了进一步证明VIGS沉默效果,我们对沉默后果实中Lcyb基因的表达情况进行了分析(图2),从图2可以明显地看出,经过沉默的辣椒果实Lcyb基因表达量明显低于对照。这说明采用TRV病毒的确能够起到沉默Lcyb基因的效果,沉默效率约为80%。
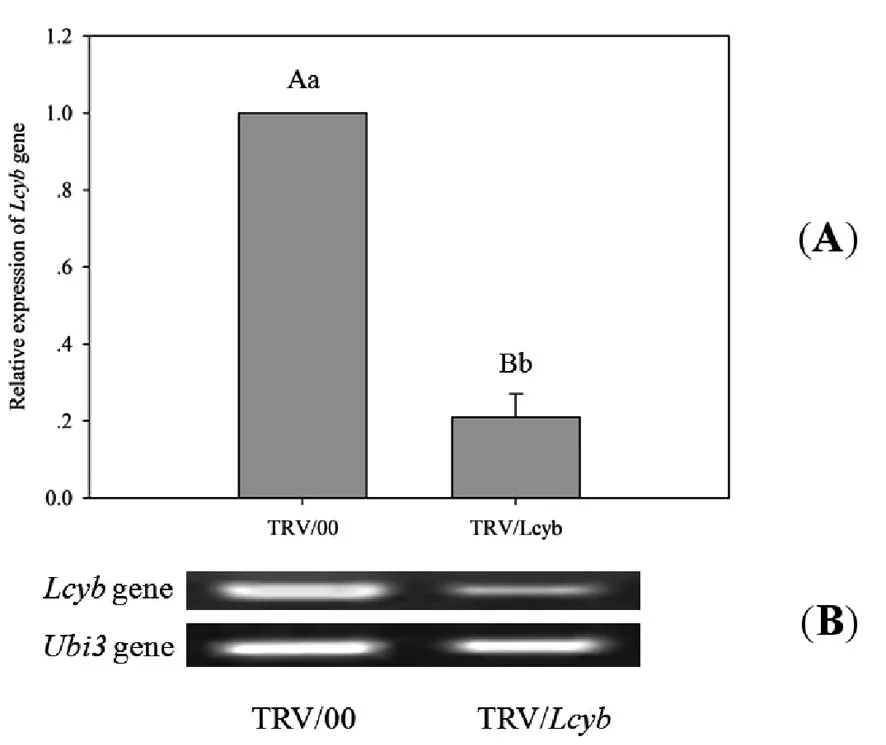
图2 沉默后基因表达量变化比较Fig.2 The change of Lcyb gene expression level by VIGS
(A)为实时定量PCR测定的基因表达量,TRV/00为空载体,TRV/Lcyb为沉默载体;(B)为半定量PCR分析。
2.2 Lcyb沉默后果实表型变化
沉默结果(图3)表明,在辣椒果实绿熟期(花后25天),果实颜色为绿色。此时我们对果实进行处理,其中TRV/00为只注射TRV病毒载体的对照果实,TRV/Lcyb为携带有Lcyb基因的重组TRV病毒载体。15天后,果色发生了明显的变化,只注射空载体的果实颜色正常转红,这说明注射烟草脆裂病毒TRV不影响辣椒果实的正常转红。而注射携带有目的基因(TRV/Lcyb)的果实颜色出现了不均匀的橙红色,果实颜色不能正常转红,通过比较发现,当沉默Lcyb基因时首先影响的是果实颜色的变化。
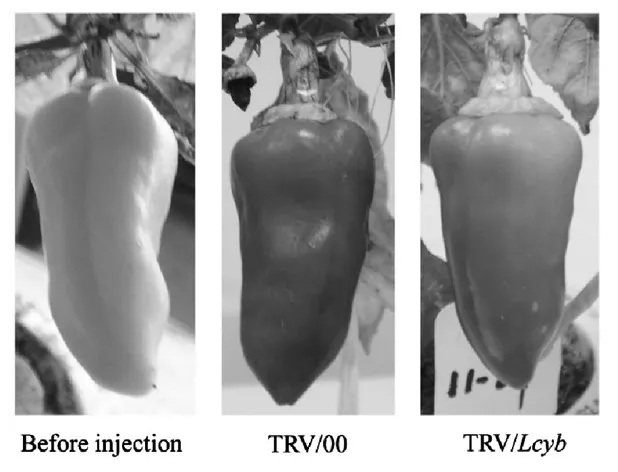
图3 基因沉默前后辣椒果色变化情况比较Fig.3 Phenotype changes in pepper fruits with Lcyb gene silencing via VIGS
2.3 VIGS沉默对辣椒果实颜色的影响
为了进一步验证沉默后果实颜色的变化,我们对果实的颜色差异进行了检测,检测结果见表1。从表1中我们可以看出,以TRV/00为对照,比较沉默组(TRV/Lcyb)果实颜色差异发现,无论△L、△a、△b和△E,相对于对照组颜色均有很大的差异。这进一步说明沉默Lcyb基因的确造成了辣椒果实颜色的变化。

表1 Lcyb基因沉默后果实色差比较Tab.1 The color variation in TRV/00 and TRV/Lcyb fruits between the phenotypes
TRV/00:注射空载体的辣椒果实,作为对照;TRV/Lcyb:注射携带Lcyb基因的烟草脆裂病毒载体(TRV);在计算△L,△a和 △b时,TRV/00的色度作为对照;每个实验材料进行三次生物学重复。
2.4 VIGS 沉默对辣椒红素含量的影响
2.4.1 HPLC测定辣椒红素出峰时间图 通过高效液相色谱技术,我们对辣椒果实中辣椒红素含量进行了测定[4,5],辣椒红素标准品购自法国Extrasynthèse公司,从图4A中可以看出,辣椒红素标样纯度较高,出峰时间集中在7.36 min,峰图犀利,可以作为测定辣椒红素含量的标准样品。B图为样品,从图4B中可以看出,在7.36 min有一个较大的峰,通过与标准样品峰图比较,这个峰应该是辣椒红素成分峰。因此HPLC在454nm可以测定辣椒红素含量的变化。
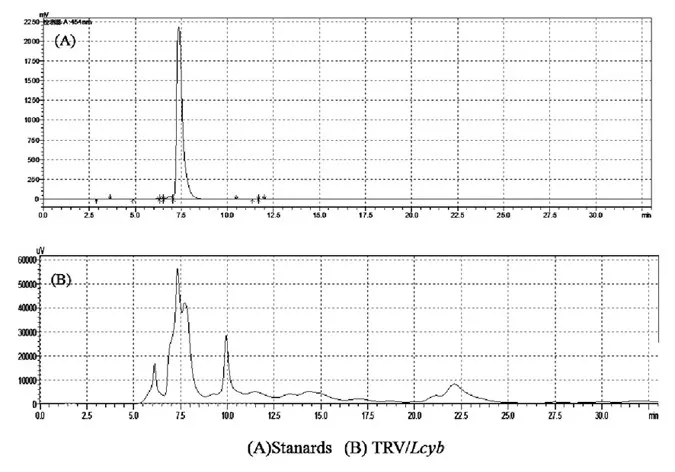
图4 HPLC检测辣椒果皮中辣椒红素含量Fig.4 Resolution of Capsicum pericarp capsanthin by HPLC
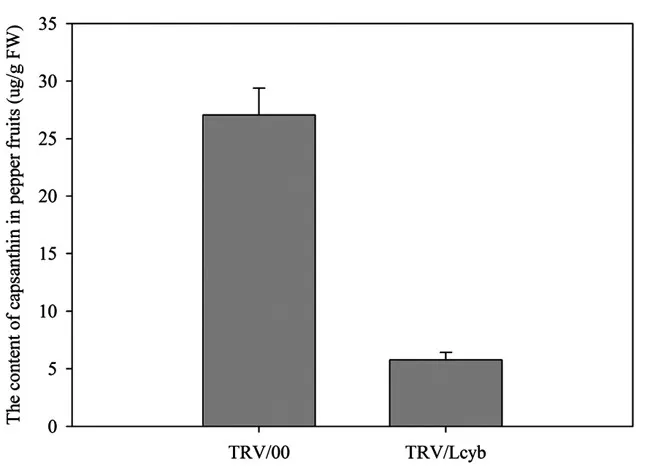
图5 沉默后辣椒红素含量变化Fig.5 Capsanthin content in pepper fruits with Lcyb gene silencing via VIGSpsanthin by HPLC
2.4.2 辣椒红素含量比较 通过分析可以看出(图5),通过病毒诱导基因沉默,沉默组辣椒红素含量明显低于对照,这说明,通过沉默Lcyb基因导致辣椒红素含量发生了变化,直接导致辣椒红素含量的降低。
3 结论与讨论
通过沉默Lcyb基因,辣椒果实颜色明显变浅(表1),与正常果实相比,辣椒红素含量下降比较明显。说明辣椒红素的合成不但与Ccs基因有关,而且也与调控β-胡萝卜素合成的Lcyb基因有关。沉默Lcyb基因间接地影响了辣椒红素的正常合成。Ccs基因的缺失或突变能够影响辣椒红素含量的变化[9],而Lcyb基因的非正常表达也同样能够导致辣椒红素含量的降低,影响成熟期辣椒果实颜色的形成。
辣椒果实红色的形成是一个复杂的过程,它涉及到很多基因的参与[5]。本实验通过病毒诱导基因对辣椒果实中调控β-胡萝卜素合成的基因进行沉默,研究该基因沉默后对辣椒红素合成的影响。研究发现通过沉默Lcyb基因,辣椒红素含量发生了大幅度的降低。这说明,Lcyb基因对辣椒红素合成有一定的调控关系,结果的获得丰富了辣椒红素调控的分子机理。
[1]Suzuki K,Mori M.Carotenoid composition of new cultivar of Capsicum annuum during maturation and its high capsanthin content[J].Journal of The Japanese Society for Food Science and Technology-nippon Shokuhin Kagaku Kogaku Kaishi.2003,50:324-26.
[2]Perez-Galvez A,Martin H D,Sies H,et al.Incorporation of carotenoids from paprika oleoresin into human chylomicrons[J].British Journal of Nutrition,2003,89:787-93.
[3]Rodriguez-Uribe L,Guzman I,Rajapakse W,et al.Carotenoid accumulation in orange-pigmented Capsicum annuum fruit,regulated at mult*iple levels[J].Journal of Experimental Botany,2012,63(1):517-526.
[4]田士林.辣椒果实中辣椒红素合成的分子机理及其调控研究[D].陕西杨凌:西北农林科技大学,2014.
[5]Tian SL,Li L,Chai WG,et al.Effects of silencing key genes in the capsanthin biosynthetic pathway on fruit color of detached pepper fruits[J].BMC Plant Biology,2014,14(314):1-12.
[6]Laura Rodriguez-Uribe,Ivette Guzman,Wathsala Rajapakse.Carotenoid accumulation in orange-pigmented Capsicum annuum fruit,regulated at multiple levels[J].Journal of Experimental Botany,2011,63:1-10.
[7]Wan HJ,Yuan W,Ruan MY,et al.Identification of reference genes for reverse transcription quantitative real-time PCR normalization in pepper(Capsicum annuum L.)[J].Biochemical and Biophysical Research Communications,2011,416:24-30.
[8]Livak KJ,Schmittgen TD.Analysis of relative gene expression data using real-time quantitative PCR and the 2(T)(-Delta Delta C)method[J].Methods,2001,25:402-408.
[9]Ha SH,Kim JB,Park JS,et al.A comparison of the carotenoid accumulation in Capsicum varieties that show different ripening colours:deletion of the capsanthin-capsorubin synthase gene is not a prerequisite for the formation of a yellow pepper[J].Journal of Experimental Botany,2007,58(12):3 135-3 144.
