黔产杜仲叶的1H-NMR指纹图谱研究
2015-12-02吴贵辉张建新
黄 滔,董 芬,吴贵辉,陈 艳,顾 伟,张建新
(贵州省中国科学院天然产物化学重点实验室,贵州 贵阳 550002)
杜仲(Eucommia ulmoides Oilv.)为杜仲科杜仲属植物,杜仲又名思仲、木棉、丝连皮等[1]。分布于陕西、甘肃、河南、湖北、四川、云南、贵州、湖南及浙江等省区,现各地广泛栽种[2]。杜仲是我国特有名贵树种,可作为药用、胶用、材用及用作保健饮料、饲料等的原料。杜仲作为药用始载于《神农本草经》,并列为药之上品,具有补中益气、强志、坚筋骨、久服轻身耐劳的功效。杜仲从开始种到剥皮一般需要10年左右,因此仅皮作为药源显的资源紧缺。杜仲的化学成分研究表明,杜仲叶的化学成分与杜仲皮基本一致[3,4],许多专家和学者证明了杜仲的叶与皮有相似的药理作用[5-7],以叶代皮的想法得到了进一步证实。现在杜仲叶已作为一种新药收入《中国药典》。本研究在前期对杜仲叶中化学成分分离纯化的基础上[8],拟采用核磁共振波谱技术建立杜仲1H-NMR(Proton Nuclear Magnetic Resonance)指纹图谱,将为杜仲叶质量控制提供一种新方法。
1 材料与方法
1.1 仪器
INOVA 400 MHz核磁共振波谱仪(美国Varian公司),谱仪控制软件VNMR 6.1C(美国Varian公司),氘代二甲基亚砜(美国Cambridge Isotope La-boratories公司),电子分析天平(德国 sartorius公司),N-1100型旋转蒸发仪(上海爱朗仪器有限公司,5 mm核磁管(美国 Wilmad-LabGlass公司)。
1.2 供试样品溶液的制备
杜仲(Eucommia ulmoides Oliv.)叶由贵阳中医学院付志明教授鉴定,采自贵阳市三江农场,对照品为绿原酸、槲皮素、紫云英苷、陆地锦苷、山萘酚(均为前期从杜仲叶中分离中得到)。称取杜仲叶粉末1.5 g,置50 mL圆底烧瓶中,加入65.0%乙醇溶液25 mL,加热回流1 h,减压旋转蒸干溶剂,称取10 mg浸膏置于5 mm核磁管中,加入0.6 mL DMSO-d6溶解,取得待测液,上机。
1.3 1H-NMR测定条件
以DMSO-d6为频率内锁,测定温度 T=25℃,操作频率399.9 MHz,脉冲序列 cpmgt2,谱宽sw=7 959 Hz,回波循环时间 d2=0.001 s,弛豫时间bt=0.1 s,采集时间at=3.744 s,脉冲延迟时间d1=10 s,采样参数为nt=128次,脉冲宽度为sw=7 959 Hz,取得1H-NMR FID数据。并利用对照品,采用“标准样品滴定”和JRES(J-Resolved)二维核磁共振波谱实验得到的数据,鉴定从黔产杜仲叶总体取物的物质。
1.4 数据处理
将测得的1H-NMR FID数据导入MestReNova软件,线性加宽因子lb=1 Hz,进行傅立叶转换,并手动调整相位和基线,对0.5~12 ppm范围内的谱图以0.04 ppm为单位进行分段积分,并以总面积进行归一化处理,然后以ASCII格式输出数据导入Excel软件中进行夹角余弦计算[9-10],得到夹角余弦值。
1.5 重复性实验
取同一批药材粉末5份,每份2 g,按上供试样品溶液的制备进行处理,再按得到5组1H-NMR FID积分数据数据,再运用Excel软件计算各组夹角余弦值,得到5组之间的相关系数。
2 结果与分析
2.1 脉冲序列的选择
分别选择谱仪自带的s2pul(standard twopulse sequence)和cpmgt2(Carr-Purcell Meiboom-Gill T2 pulse sequence)脉冲序列,采集1HNMR谱,考察脉冲序列对实验结果的影响,结果如图1所示。从谱图中可以看出,采用cpmgt2脉冲序列采集1H-NMR谱(B图)的实验条件,可以去除粗提取物中的大分子信号,简化谱图,因此选择cpmgt2序列作为杜仲叶1H-NMR指纹图谱的脉冲序列。
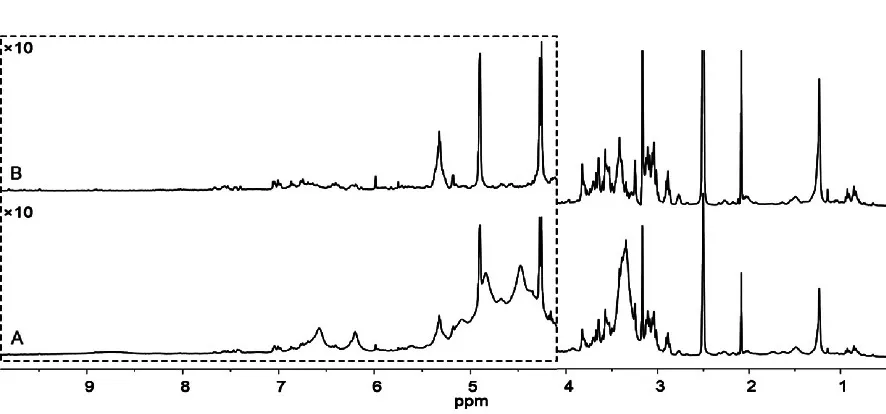
图1 提取物1H-NMRFig.1 The1H-NMR spectrum of crude extracts
2.2 杜仲叶的1H-NMR指纹图谱
本研究采用“标准样品滴定”和JRES(J-Resolved)二维核磁共振波谱实验,从黔产杜仲叶总体取物中鉴定了5个化合物(图2),分别为绿原酸、槲皮素、紫云英苷、绿原酸甲酯、陆地锦苷及山萘酚。5个特征化合物的特征信号的化学位移及多重态分别为:绿原酸:δ7.44(d,J=16.0Hz),7.04(s),6.99(d,J=8.1Hz),6.76(d,J=8.0Hz),6.21(d,J=16.0Hz). 槲皮素:δ7.67(s),7.54(d,J=9.1Hz),6.88(d,J=9.4Hz),6.41(s),6.18(s).紫云英苷:δ8.04(d,J=7.4Hz,),6.88(d,J=7.7Hz),6.43(s),6.21(s). 绿原酸甲酯 δ7.54(d,J=15.6Hz),7.16(s),7.05(d,J=7.2),6.88(d,J=7.2Hz),6.25(d,J=15.6Hz). 陆地锦苷 δ8.05(s),7.97(s),7.58(d,J=8.5Hz),6.96(d,J=8.4Hz),6.51(s)山萘酚 δ8.16(d,J=8.9Hz),7.02(d,J=8.9Hz),6.53(d,J=1.7Hz),6.27(d,J=1.8Hz)。
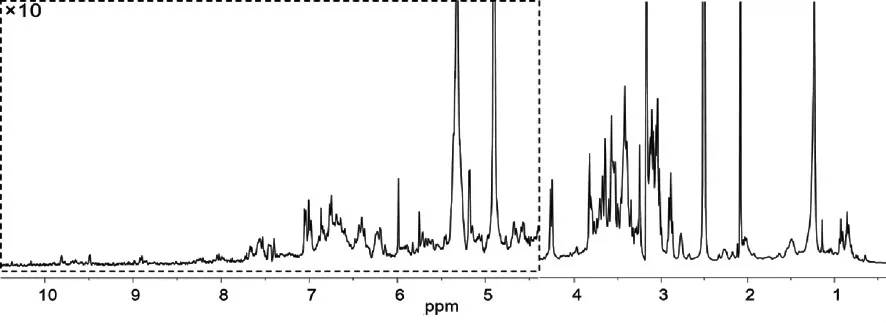
图2 杜仲叶总体取物1H-NMR谱Fig.2 The1H-NMR spectrum of crude extracts of Eucommia ulmoides Leaves
2.3 重复性实验结果
5次重复提取的相关系数值分别为0.993,0.994,0.993,0.996,1,均在 0.99 以上,表明该方法具有较好的重现性。
3 结论
本研究采用1H-NMR分析技术,全面地体现了黔产杜仲叶的化学成分,同时使用了核磁滴定和JRES二维核磁共振波谱技术,对杜仲叶中的特征化合物进行了归属。研究结果表明,与传统的高效液相色谱方法相比,基于核磁共振的分析技术能提供更全面的信息。同时选用cpmgt2脉冲序列测试1H-NMR谱,能很好的过滤掉杜仲胶等大分子信号,简化谱图。本方法样品制备简单、分析速度快,所建立的1H-NMR指纹图谱重现性好,这为杜仲叶质量控制提供了一种新方法。
[1]辛晓明,冯 蕾,王 浩,等.杜仲的化学成分及药理活性研究进展[J].医学综述,2007,13(19):1 057-1 059.
[2]中国科学院中国植物志编辑委员会.中国植物志[M].第35(2)卷.北京:科学出版社,1979:116.
[3]赵军太,张 诚.杜仲的不同部位的化学成分研究与应用[J].实用医技杂志,2003,10(9):1 025-1 026.
[4]管淑玉,苏薇薇.杜仲化学成分与药理研究进展[J].中药材,2003,26(2):124-129.
[5]宁康健,郑淑红,吕锦芳,等.杜仲叶水提醇沉液降压作用的实验研究[J].中国中医药科技,2009,16(4):283-285.
[6]邱 果,包 旭,李 颖,等.杜仲叶醇提取物对小鼠免疫功能的影响[J].中药药理与临床,2008,24(4):41-43.
[7]杨 津,董文宾,许先猛,等.杜仲叶黄酮苷抗疲劳和抗氧化活性的研究[J].陕西大学学报,2010,28(3):60-63.
[8]董 芬,范田运,张建新,等.杜仲叶的化学成分研究[J].天然产物研究与开发,2014,26(5):679-682.
[9]王龙星,肖红斌,梁鑫淼,等.一种评价中药色谱指纹谱相似性的新方法:向量夹角法[J].药学学报,2002,37(9):713-717.
[10]苗爱东,孙殿甲.Excel 2002在中药指纹谱相似度计算中的应用[J].药学进展,2003,27(1):51-54.
