基于“三重表征”方式设计的《酸的化学性质》的教学研究
2015-10-22郭超琪
郭超琪
【摘要】 酸碱盐的知识是初中化学学习最大的分化点。如何对酸碱盐的知识进行有效教学,是个值得探讨的问题。而《酸的化学性质》是学生学习酸碱盐知识的起点。本文以《酸的化学性质》为例,将“宏观——微观——符号”的三重表征的思维方式应用于酸的化学性质的学习中。探讨如何运用“三重表征”的思维方式进行酸碱盐的教学,帮助学生更好地建构酸碱盐的知识。
【关键词】 初中化学 三重表征 酸的化学性质 分阶段教学
【中图分类号】 G633.8 【文献标识码】 A 【文章编号】 1992-7711(2015)07-079-03
一、问题的提出
化学用语、溶液和酸碱盐经常成为初中化学学习的三个分化点,特别是酸碱盐部分知识因其知识点多,知识点之间的联系紧密,且与此相关的习题综合性强,因此,酸碱盐成为初中化学学习最大的分化点。初中酸碱盐的知识与高中“离子反应”等知识联系紧密,初三学生对酸碱盐知识的学习与掌握,特别是对酸碱盐反应本质的理解,有利于其高中的后续学习。
笔者在参加近5年的广州市教研中,广州市教研员李南萍老师、戴光宏老师和王季常老师都强调要做好初高中的衔接,将化学知识的学习一体化,初中化学知识的学习要为学生高中化学知识的后续学习服务。
“酸碱盐”的教学属于元素化合物的学习。对于“酸碱盐”的教学策略,如果运用“三重表征”方式进行教学,可能会收到事半功倍的效果。《酸的化学性质》是学生认识酸碱盐化学性质的开始,应用“三重表征”方式对酸的化学性质进行学习,不仅可以帮助学生更好地记忆和理解酸的化学性质,还可以帮助学生形成“三重表征”的思维方式来学习碱和盐的化学性质。本文以《酸的化学性质》为例,探讨如何运用“三重表征”的思维方式进行酸碱盐的教学,帮助学生更好地建构酸碱盐的知识。
二、理论基础
1.“三重表征”的含义
化学是一门研究物质的组成、结构、性质和变化规律的科学,由于化学学科的特点,要求学生从不同的角度去认识物质。毕华林教授认为化学学习的基本领域包括:①可观察现象的宏观世界;②分子、原子、离子等微粒构成的微观世界;③化学式、方程式、元素符号构成的符号与数字世界。因而,要从宏观、微观和符号三种水平上认识和理解物质,并建立三者之间的内在联系,从而形成化学学科特有的思维方式。这种思维方式称之为“三重表征”思维方式。
2.元素化合物教学“宏观——微观——符号”三重表征的构建方式
“三重表征”是化学中元素化合物教学的重要方法,能帮助学生通过物质的各种表征方式进行有意义的学习。运用“三重表征”进行元素化合物的教学的基本程序是,首先通过阅读材料、观看多媒体素材、观察与分析实验现象或科学探究等活动获得宏观反应事实的认识;接着通过书写化学方程式或离子方程式获得符号表征;最后运用理论模型从微观角度分析反应获得微观认识。
三、基于“三重表征”方式设计的《酸的化学性质》的教学案例
1.教学内容
此教学课例选取人民教育出版社初中化学第十单元“酸和碱”课题1“常见的酸和碱”第3课时“酸的化学性质”为教学内容,包括盐酸、硫酸的化学性质,即盐酸、硫酸能与指示剂作用、能与活泼金属反应和能与金属氧化物反应,以及盐酸、硫酸具有相似化学性质的原因。
2.教学目标
①知道酸溶液中都存在H+,推测酸具有一些相似的化学性质;
②通过分组实验完成盐酸、硫酸与指示剂的实验,能够说出盐酸、硫酸与指示剂反应的现象,理解不同酸溶液能使酸碱指示剂显现相同颜色的原因,建立酸与指示剂反应的三重表征。
③通过回忆金属与反应的条件,能够说出Mg、Zn、Fe与盐酸、硫酸的现象,写出相应的化学方程式,理解不同酸溶液能与活泼金属反应的原因,建立酸与金属反应的三重表征。
④观察铁锈、氧化铜与盐酸、硫酸反应并说出反应的现象,写出相应化学方程式,理解不同酸溶液能与金属氧化物反应的原因,建立金属氧化物与酸反应的三重表征。
⑤通过对酸化学性质的学习,感受“组成(结构)决定性质、性质反映组成(结构)”的学科思想。
3.教学重难点
重点:酸的化学性质
难点:利用微粒观让学生体会不同的酸具有相似的化学性质的原因
4.教学过程
【引入】蚀刻工艺:酸吃掉金属
环节1:酸在水溶液中都能电离出H+和酸根离子,推测酸具有一些共同的化学性质
【提问】请同学们观察实验桌上所摆放的盐酸和硫酸两瓶无色溶液,你能说出它们的微观组成吗?
【讨论】展示这两种溶液的微观示意图,并讨论以下问题:
(1)从物质的类别看,它们是否属于同类物质?为什么?
(2)这两种物质是否会具有一些相似的化学性质?
【微观表征】阴离子分别是Cl-和SO42-.但阴离子都是H+,故它们都属于酸。两种溶液中都含有H+,所以推测它们可能会具有一些相似的化学性质。
设计意图:创设教学情境,引起学生学习的兴趣。通过回忆盐酸、硫酸的微观组成,展示盐酸、硫酸的微观粒子图,分析盐酸、硫酸微观组成的共同之处,使得学生在头脑中形成盐酸、硫酸这两种物质的“微观表征”的表象。
环节2:通过学生分组实验,引出酸化学性质之一:能使酸碱指示剂显示不同的颜色,建立酸与指示剂反应的三重表征
【分组实验】盐酸、硫酸分别与两种指示剂的反应。
【宏观表征】学生边实验边记录现象
【讨论】两种溶液都能使紫色石蕊溶液变红色,无色酚酞溶液不变色,究竟是溶液中的哪种粒子引起的上述变化呢?
【微观表征】盐酸和硫酸两种溶液中都含有的H+,应该是H+引起的变化。
设计意图:学生通过分组实验,获得盐酸、硫酸与石蕊、酚酞反应的“宏观现象”,通过回忆盐酸、硫酸的微观组成,讨论盐酸、硫酸为什么能使紫色石蕊溶液变红色,无色酚酞溶液不变色。实现由“宏观表征”到“微观表征”的转换,学会从微观的角度解释宏观现象。
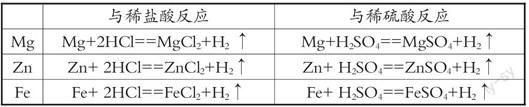
环节3:通过游戏回忆金属与酸反应的条件,引出酸化学性质之一:酸能与活泼金属反应,建立酸与活泼金属反应的三重表征
【游戏】“寻找灰太狼”的游戏回忆金属与酸反应的条件
【宏观——符号表征】回忆镁、锌、铁与盐酸、硫酸反应的现象,并书写镁、锌、铁与盐酸、硫酸反应的化学方程式
【讨论】上述反应的反应物和生成物有什么共同之处?
【宏观表征】反应物都是金属和酸,生成物都有氢气
【教师小结】镁、锌、铁等活泼金属能与盐酸、硫酸反应生成氢气,说明酸能与氢前的金属发生置换反应。
【讨论】盐酸、硫酸都可以与活泼金属反应产生氢气。究竟是酸溶液中的哪种粒子引起的上述变化呢?
【微观表征】盐酸和硫酸两种溶液中都含有的H+,应该是H+引起的变化。
设计意图:通过“寻找灰太狼”的游戏回忆金属与酸反应的条件,回忆镁、锌、铁与盐酸、硫酸反应的现象,书写镁、锌、铁与盐酸、硫酸反应的化学方程式,实现由“宏观表征”到“符号表征”的转换,通过讨论盐酸、硫酸为什么都能与活泼金属反应,实现由“宏观表征”到“微观表征”的转换。
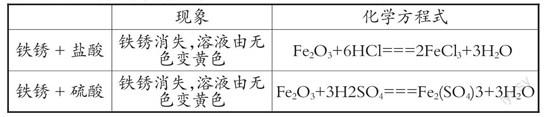
环节4:观察铁锈与盐酸、硫酸的反应,建立碱与非金属氧化物反应的三重表征
【学生回忆】铁生锈会产生哪种物质?化学式是什么?在物质的分类中属于什么?
【教师设问】当铁锈遇到稀盐酸,会发生反应吗?
【学生可能的回答】可能会反应
【演示实验】铁锈与盐酸、硫酸分别发生反应
【宏观——符号表征】请同学们描述所观察到的现象并试着写出反应的化学方程式
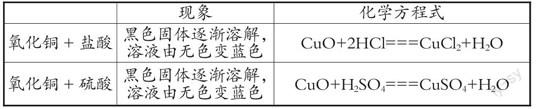
【教师讲述】盐酸、硫酸不仅可以与铁锈发生反应,还可以与氧化铜发生反应
【补充实验】氧化铜与盐酸、硫酸分别发生反应
【宏观——符号表征】请同学们描述所观察到的现象并试着写出反应的化学方程式
【讨论】上述反应的反应物和生成物有什么共同之处?
【学生可能的回答】反应物都是金属氧化物和酸,生成物都有水。
【宏观表征】金属氧化物能与盐酸、硫酸反应生成水。
【讨论】盐酸、硫酸都可以与金属氧化物反应产生水。究竟是酸溶液中的哪种粒子引起的上述变化呢?
【微观表征】盐酸和硫酸两种溶液中都含有的H+,应该是H+引起的变化。
【讨论】利用上面的反应可以清除铁制品表面的锈,除锈时能否长时间浸在酸中?为什么?
【学生可能回答】不能;当铁钉表面的铁锈被清除完,酸将与铁发生反应。会腐蚀金属。
设计意图:学生通过观察实验现象获得对铁锈、氧化铜与酸反应的“宏观表征”,通过书写反应的化学方程式获得铁锈、氧化铜与酸反应“符号表征”,最后通过讨论为什么盐酸、硫酸都能与金属氧化物反应,实现“宏观表征”与“微观表征”的切换。
环节5:总结酸的化学性质,知道酸具有相似化学性质的原因:酸溶液中都有H+
【微观——宏观表征】由于不同的酸溶液中都含有相同的H+,因而具有一些相同的化学性质
1. 酸溶液能使酸碱指示剂显示不同的颜色
2. 酸溶液能与活泼金属反应
3. 酸溶液与金属氧化物反应
【练习】“蚀刻”福娃印刷模板
“蚀刻”是制作印刷模板的一种方法.现用“蚀刻”的方法制作“福娃”的印刷模板,制作过程如下:
①用稀盐酸除去金属板表面的“锈斑”,再进行打磨处理;
②在金属板上镀一层防酸材料——蜂蜡;
③在上面刻出“福娃”图象;
④用稀盐酸对其表面进行处理,稀盐酸就能“吃掉”金属;
⑤除去蜂蜡镀层,金属板上显出“福娃”。
根据上述制作过程回答下列问题:
(1)制作印刷模板的金属可选用 (选填“铁”、“银”或“铜”)。
(2)制作此模板依据的原理是 。
(3)写出制作过程①中发生反应的化学方程式
。
设计意图:通过总结酸的化学性质,使得学生在头脑中建立起酸的化学性质的认知图式,建立起酸的化学性质的三重表征。习题的设计呼应课前创设的情景,也是学生对酸的化学性质的巩固。
四、基于“三重表征”方式设计的《酸的化学性质》的分阶段教学
新课的教学是对酸的化学性质学习的第一阶段,学生学习了这节课之后在学生的脑中对酸的化学性质会留有这样的印象:盐酸、硫酸之所以有共同的化学性质是因为它们的水溶液中都有H+。例如,2012年广州市中考题第25题就是对酸的共性的考查。题目中首先让学生书写三氧化二铁与盐酸反应的化学方程式和现象,再告诉学生白醋、柠檬酸溶液也能与三氧化二铁发生类似反应,让学生从微观角度解释反应的原因。
例1:实验室有盐酸、白醋、柠檬酸三种溶液,回答下列问题:
(1)向三氧化二铁中放入足量盐酸,充分反应后,观察到的现象是 ,
反应的化学方程式是 。
(2)白醋、柠檬酸溶液也能与三氧化二铁发生类似反应,说明白醋、柠檬酸溶液和盐酸中都含有的离子是 。
大部分学生在学习新课之后,对酸的共性的理解并不存在障碍。但是对酸的个性的理解是存在障碍的。因此,酸的化学性质第三阶段的学习就是对酸的个性通过习题进行巩固练习,适合在中考复习课中进行。教师可以设计几道对酸共性和个性考查的题目,学生通过对比来学习酸的共性和个性。例如,2013年广州市中考题第21题就是对酸的共性和个性的考查。题目中首先让学生书写稀硫酸与铁粉、碳酸钠和氯化钡的化学方程式,再让学生选出哪些反应属于酸的共同的化学性质。要正确地解答这道题,学生必须要思考一个问题:硫酸的化学性质是否全部都是因为H+引起的。硫酸在水溶液中不仅可以电离出H+还可以电离出SO42-.其实硫酸与氯化钡之所以能够发生反应中,是因为生成了BaSO4白色沉淀。所以,“SO42-”才是正真的主角。
例2:硫酸、盐酸是重要的化工原料。
(1)浓硫酸在实验室常用作干燥剂,因为浓硫酸有 性。
(2)写出稀硫酸与下列物质反应的化学方程式:
①与铁粉反应: ;
②与碳酸钠溶液反应: ;
③与氯化钡溶液反应: ;
上述反应中,属于酸的共同性质的是 (填编号)
(3)盐酸的下列用途中,不能用硫酸代替盐酸的是 (填编号)
①金属表面除锈②制造药物氯化锌③除去NaCl中的少量NaOH
无论是对酸的共性的分析,还是对酸的个性的分析,学生都可以运用“宏观——微观——符号”的三重表征方式进行。主要的分析过程为:先写出反应的化学方程式(符号表征),再描述出反应的现象(宏观表征),再根据方程式和现象,从微观角度来分析产生宏观现象的原因(微观表征)。
五、基于“三重表征”方式设计的《酸的化学性质》的教学思考
酸的化学性质的教学采用“三重表征”的方式进行,让学生通过不同角度对酸的化学性质进行了意义建构,有利于他们对酸的化学性质的整体理解和把握。“三重表征”教学同样适用于“碱的化学性质”、“中和反应“和“盐的化学性质”的教学。
通过第一阶段《酸的化学性质》的新课学习和第二阶段酸的共性的习题巩固,学生初步形成“宏观——微观——符号”的三重表征的思维方式,那么,在碱和盐化学性质的学习中,学生就可以遵循三重表征的思维方式去学习碱和盐的共性。
《酸的化学性质》应用“宏观——微观——符号”的三重表征的思维方式进行教学,碱和盐的化学性质的学习是对酸的化学性质学习方式的延续和巩固。相对固定的教学模式,有利于培养学生形成“宏观——微观——符号”的三重表征的思维方式,帮助学生从不同角度对酸碱盐的知识进行建构,启发学生形成酸碱盐的学习思路,突破酸碱盐的学习难点。
(此论文是广东教育学会2014年度教育科研规划小课题(课题编号:GDXKT2927)的研究成果)
[ 参 考 文 献 ]
[1]毕华林,黄婕.国外关于化学学习水平的界定与研究进展[J].全球教育展望.2007.
[2]纪新慧.高中生化学三重表征思维方式的培养研究[D].山东师范大学.2009.
[3]叶静怡.“酸碱盐”的分阶段模式支持下的有效教学[J].中学化学教学参考.2011.
[4]郭建虹.初中化学酸碱盐教学策略有效性的研究[J].中学化学教学参考.2013.
[5]李友银,蒲绪凤.基于三重表征方式设计“铝的重要化合物”教学[J].中学化学教学参考.2011.
[6]课程教材研究所.义务教育课程标准实验教科书·化学九年级下册[M].人民教育出版社:2012.
[7]广州市教育局教学研究室.广州市义务教育阶段学科学业质量评价标准.广东省出版集团:2013.
