人工湿地植被根区土壤性质及其净化水质季节效应分析
2015-10-22周旭丹孙晓刚赵春莉王薇杨红立
周旭丹,孙晓刚,赵春莉,王薇,杨红立
吉林农业大学园艺学院,吉林 长春130118
人工湿地是土壤、河砂、炉渣和粉煤灰等按一定比例构成的选择性地植入植被的自适应生态系统(Zhang等,2010;Faulwetter等,2013;Xiong等,2011),包括水体、基质、水生植被和微生物等四大基本要素,该系统四大基本要素通过一系列理化、生物途径能够对特定污染物高效的去除(Zhang等,2010;Faulwetter等,2013;Xiong等,2011)。人工湿地是20世纪70年代才蓬勃兴起的一种处理污水的方式,具有低投资、低运行费用、低耗能和美观等特点,广泛应用于各类不同水体的水质净化和水环境富营养化的防治中,已有不少地区取得了良好的环境效果和经济效益(Bavor等,2011;Zhang 等,2012;Elsaesser等,2011)。随着城镇化水平的加快,我国水质污染和水资源浪费现象十分严重,据统计,全国年排废水量越400亿t以上,生活污水排放量日益增多,大部分未经任何处理直接排入生态系统,加重了水资源的短缺,合理开发利用水资源及净化水质具有现实和长远意义(Gleick,2014;Kneese,2013)。目前关于人工湿地净化水质的研究主要集中在生物量较大的水生植被方面,大多数局限于单一湿地类型和缺乏长期的效应分析(Zhang等,2010;Faulwetter等,2013;Xiong等,2011),并且人工湿地植被土壤微生物学动态研究尚不多见。潜流式人工湿地面积较小、净化水质能力强、操作和运行方便等优点,选择适当的湿地植被是构建人工湿地和恢复重建自然湿地的关键措施(Zhang等,2010;Faulwetter等,2013;Yue,2013;Abe等,2014)。有鉴于此,本试验构建潜流型人工湿地,通过对比研究人工湿地植被根区土壤微生物数目及酶活性及其生活污水中 BOD5、CODCr、NH4+-N、TN、TP的去除能力的季节效应,探讨人工湿地植被净化水质的机理和过程,为恢复湿地植被、构建人工湿地、控制水体污染和富营养化提供理论依据和实践措施。
1 材料与方法
1.1 人工废水的配置
人工废水配置,TN:8.13 mg·L-1,TP:0.15 mg·L-1,CODCr:315.5 mg·L-1,BOD5:98.7 mg·L-1,NH4+-N:6.13 mg·L-1;高锰酸钾指数:9.50 mg·L-1;pH值为7.04。
1.2 人工湿地设计与流程
垂直流人工湿地结构:试验区位于吉林农业大学园艺学院的大棚内,共设3个人工湿地结构单元,每个单元长×宽×深=25 m×3.0 m×1.0 m,单元之间用1 m宽的土埂隔开,底部为集水区,其上铺放尼龙网,防止填料下漏,每个单元沿对角线埋入直径为12 mm的PVC管,使人工湿地中的循环水能够流入PVC管,以便于实验样品的采集。
人工湿地填料:底层大粒径砾石作为排水层,上部填砂,其主要成分为SiO2,基质铺设相同,底层均选用砾石,直径为1~3 cm,厚度为18 cm,中层选用当地较好的炉渣,直径为0.8 cm,厚度为20 cm,上层选用当地的泥沙,直径为0.5 cm,厚度为18 cm。
人工湿地植被:选取株型大小、生物量基本一致的美人蕉(Canna indica)作为人工湿地植被,2012年 3月均匀在人工湿地中进行培植,密度为9~12 株/m,每个单元3个重复,植被栽上后,加自来水至砂子基质饱和,地下水培养1个月,并保持其上2~3 cm薄水层,稳定半个月,其间换水5次,同时将污水经配水池缓慢放入人工湿地(水深80 cm),由于水流通过水管均匀流入人工湿地,污水通过布设在人工湿地的布水管流入,缓慢向下渗滤,放水12 h后,停止注水,水力负荷控制0.75 m3·m-2·d-1,控制每个单元具有相似的生长环境。进水为上述配置的污水,经过人工湿地处理后的水从底部 PVC管排出,在人工湿地不同季节分别取进水口和出水口的水进行水质化验分析,计算其对各指标的去除率。具体公式如下(Sharma等,2013):
不同季节取出水口水质实验室测定分析,各指标的去除率=(进水口值-出水口值)/出水口值×100%。
1.3 测定方法
人工湿地运行一年后,分别于2013年4个季度(3月、6月、9月、11月)进行水样采集与测试,统计每种人工湿地1 m2样方中植株数目、株高等生长性状,并将其收割分为地上和地下部分烘干测定其生物量,分别对地上和地下植被样品粉碎后用H2SO4-H2O2消煮制备成溶液,植被TN用过硫酸钾氧化吸光光度法测定,TP用钒钼蓝法测定,同时在每个单元选择健壮植株取根区土壤测定微生物数目及酶活性。
植被N、P积累量(PA)=植被体内N、P质量浓度(PC)×植被生物量(PB)。
土壤微生物数量(Van等,2012):采用平板梯度稀释法,其中细菌培养基为牛肉膏蛋白胨琼脂培养基,真菌培养基为马丁氏培养基,放线菌培养基为高氏一号琼脂培养基。
土壤酶活性参照文献(Faulwetter等,2013;Xiong等,2011;German,2011):土壤酶活测定用分光光度计进行比色法测定,测定酶活种类为蔗糖酶(1 g土样24 h内分解产生1 mg蔗糖所需的酶量)、转化酶(1 g土样24 h内分解产生1 mg葡萄糖所需的酶量)、脲酶(1 g土样24 h内分解产生1 mg氨基氮所需的酶量)和酸性磷酸酶(1 g土样24 h内分解产生1 mg P2O5所需的酶量)。
水质指标:BOD5采用稀释接种法;CODCr采用重铬酸钾氧化法;NH4+-N采用纳氏试剂分光光度法;TN采用过硫酸钾-紫外分光光度法;TP采用钼锑抗分光光度法;高锰酸盐指数采用酸性KMnO4法(Zhang等,2010;Faulwetter等,2013;Xiong等,2011)。
1.4 数据处理与分析
所有数据采用平均值±标准误差表示(mean±SE),SPSS 18.0和Excel 2003对数据进行统计和分析,单因素方差分析(One-way ANOVA),LSD法(最小显著性差异法)比较其差异显著性,Origin 9.2作图。
2 结果与分析
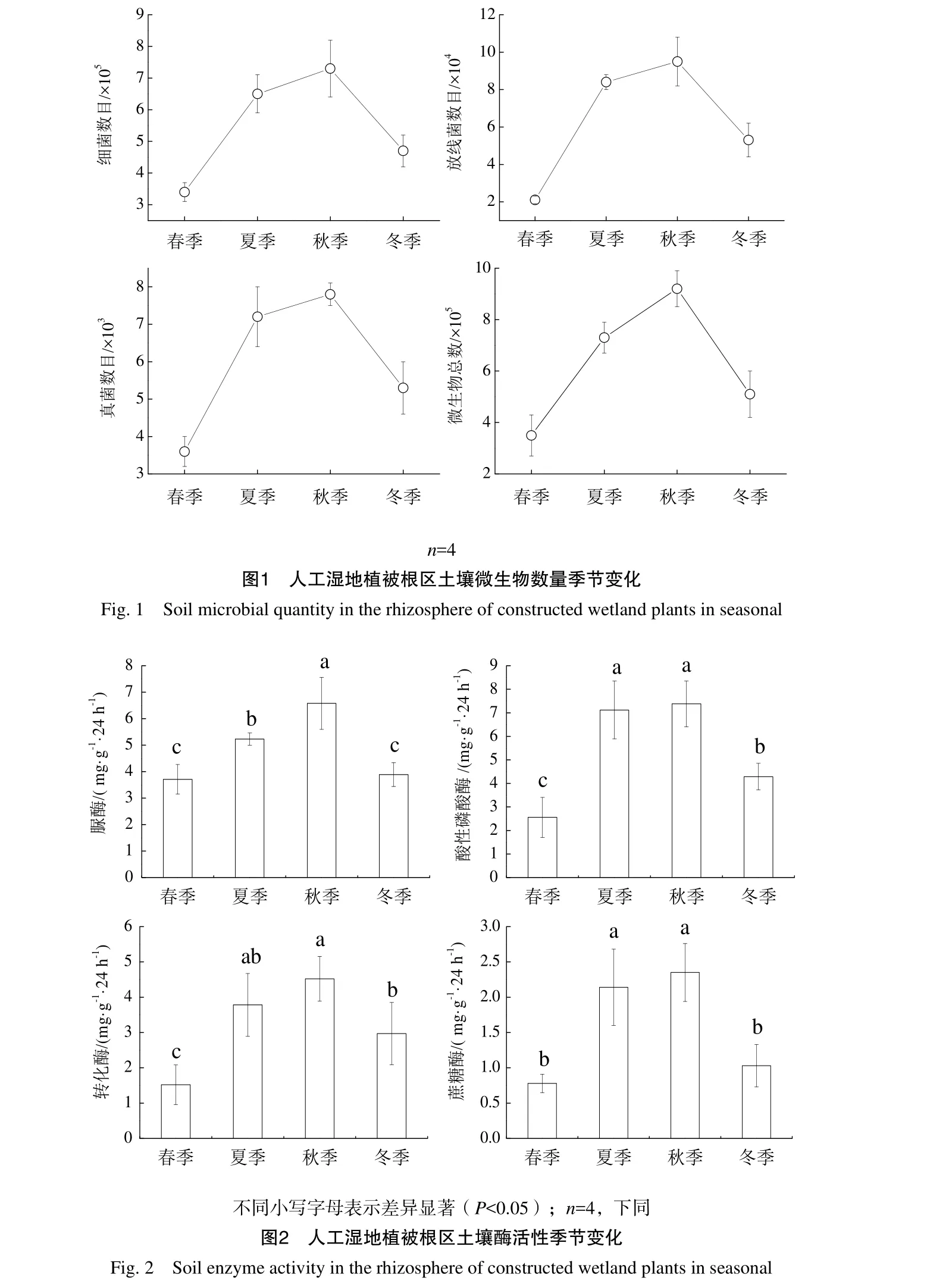
2.1 人工湿地植被根区土壤微生物数量季节变化(代表1 g土壤中所含微生物数目)
人工湿地植被根区土壤微生物数量季节变化如图1所示,图1的结果表明,人工湿地植被根区土壤微生物数量以细菌最多,占到90%以上,其次是放线菌,真菌数目最少,其中细菌数目的变化范围为 3.4×105~7.3×105,放线菌数目的变化范围为2.1×104~9.5×104, 真 菌 数 目 的 变 化 范 围 为3.6×103~7.8×103,微生物总数目的变化范围为3.5×03~9.2×103;人工湿地植被根区土壤各微生物数目随季节呈“倒V型”变化规律,依次表现为:秋季>夏季>冬季>春季,与春季相比,夏季、秋季和冬季细菌数目增加了 91.18%、114.71%和38.24%,真菌数目增加了 300.00%、352.38%和152.38%,放线菌数目增加了100.00%、116.67%和47.22%,微生物总数目增加了 108.57%、162.86%和45.71%。
2.2 人工湿地植被根区土壤酶活性季节变化
人工湿地植被根区土壤酶活性季节变化如图2所示,图2的结果表明,人工湿地植被根区土壤脲酶活性的变化范围为 3.71~6.58 mg·g-1·24 h-1,酸性磷酸酶活性的变化范围为 2.56~7.38 mg·g-1·24 h-1,转化酶活性的变化范围为 1.52~4.52 mg·g-1·24 h-1,蔗糖酶活性的变化范围为 0.78~2.35 mg·g-1·24 h-1;人工湿地植被根区土壤酶活性随季节呈“倒V型”变化规律,基本表现为:秋季>夏季>冬季>春季,与春季相比,夏季、秋季和冬季脲酶活性增加了40.97%、77.36%和4.85%,酸性磷酸酶活性增加了178.13%、188.28%和 67.58%,转化酶活性增加了148.68%、197.37%和 95.39%,蔗糖酶活性增加了174.36%、201.28%和 32.05%;酸性磷酸酶和蔗糖酶活性夏季和秋季差异并不显著(P>0.05),春季和冬季差异不显著(P>0.05),而夏季和秋季均显著高于春季和冬季(P<0.05);脲酶活性春季和冬季差异不显著(P>0.05),但显著低于夏季和秋季(P<0.05),脲酶活性夏季和秋季差异显著(P<0.05);转化酶春季显著低于夏季、秋季和冬季(P<0.05),夏季和秋季转化酶活性差异并不显著(P>0.05)。
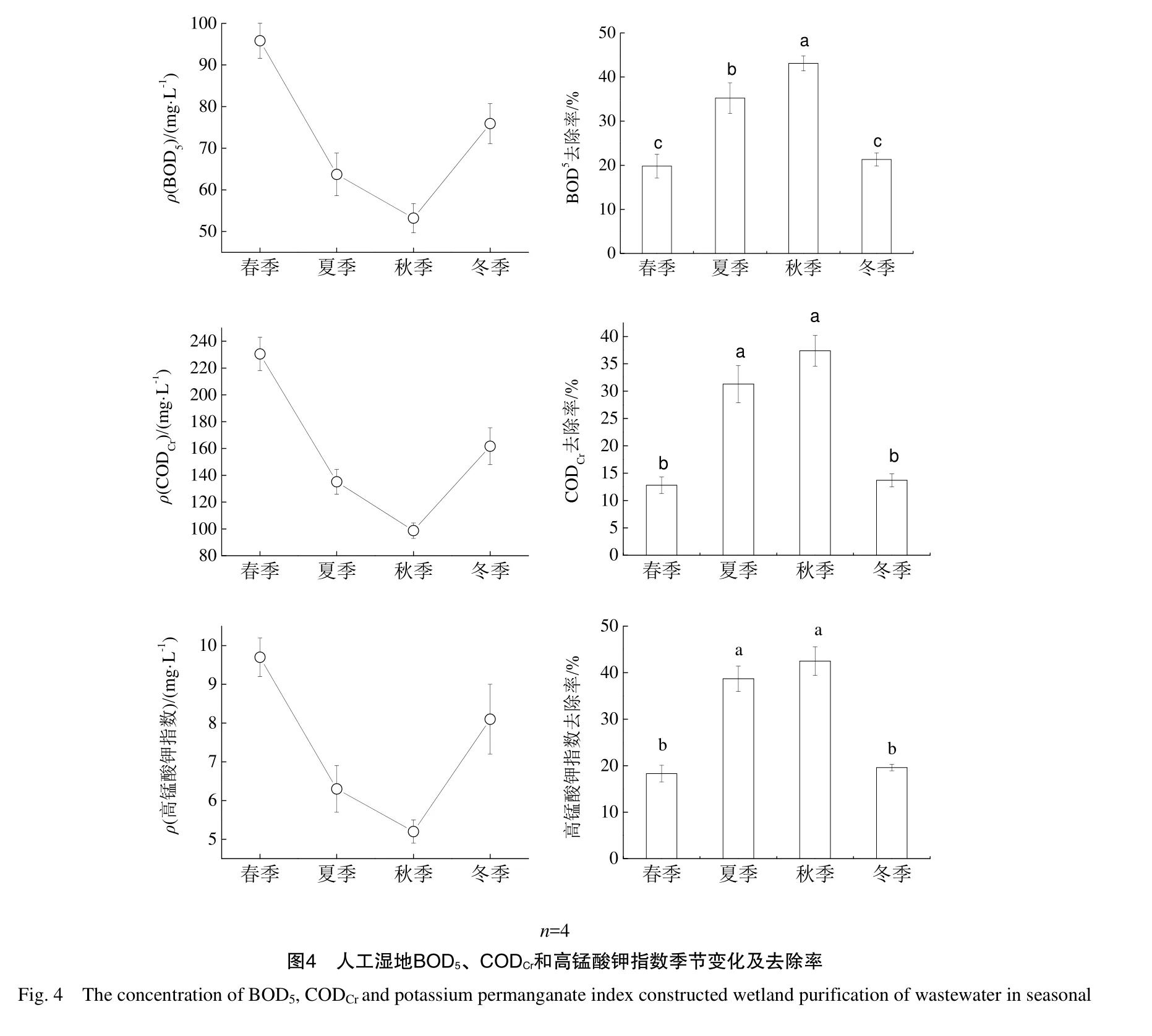
2.3 人工湿地TN、TP和NH4+-N季节变化及去除率
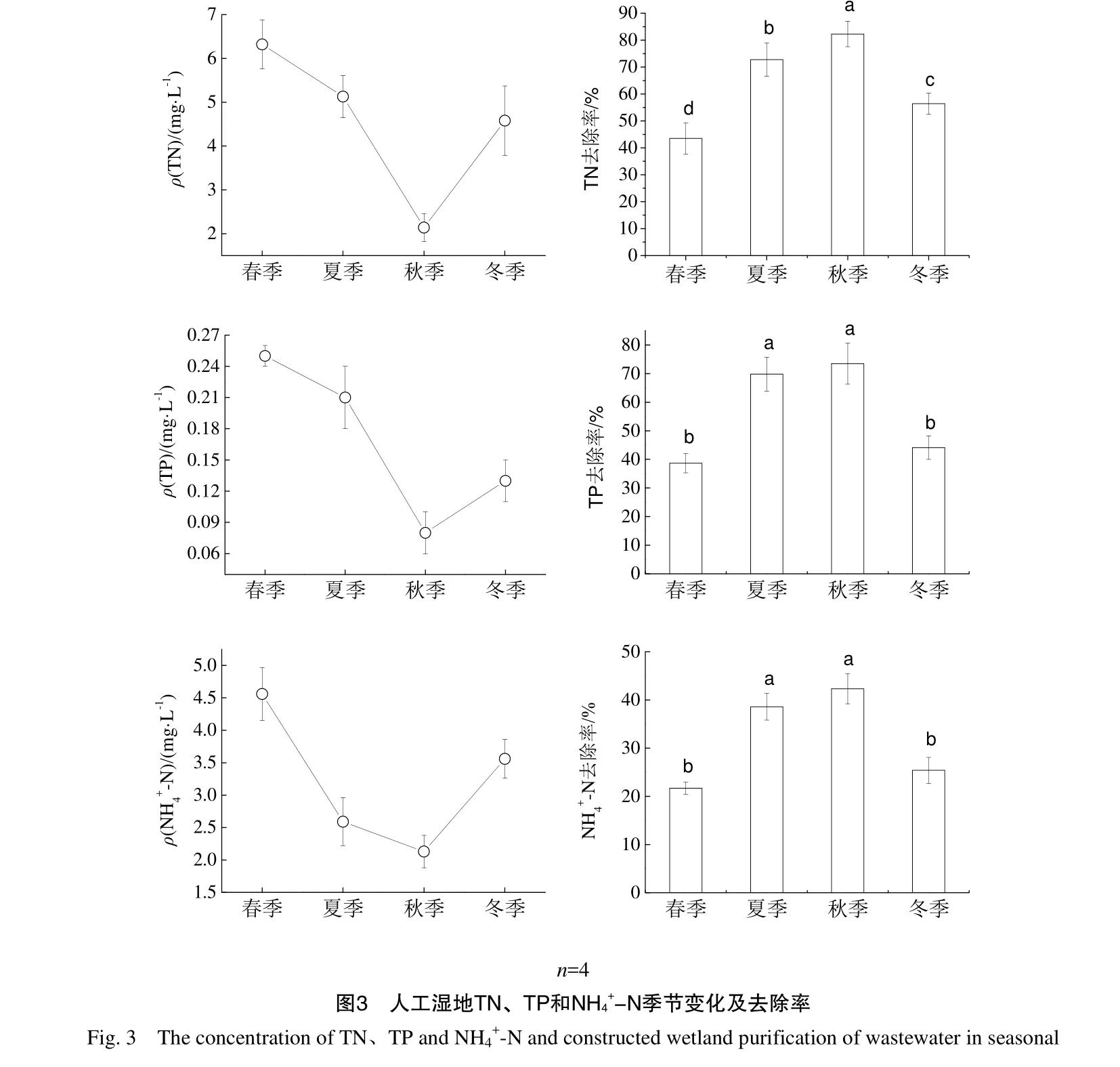
图3为人工湿地不同季节TN、TP和NH4+-N出水质量浓度及去除率变化,由图可知,人工湿地出水TN、TP和NH4+-N质量浓度总体变化为春季最高、夏季和秋季降低,冬季则有回升的趋势,具体表现为春季>夏季>冬季>秋季,呈“V字型”变化规律,人工湿地出水 TN质量浓度变化范围为2.14~6.32 mg·L-1,TP质量浓度变化范围为0.08~0.25 mg·L-1,NH4+-N 质量浓度变化范围为2.13~4.56 mg·L-1;人工湿地对TN、TP和NH4+-N去除率呈现出明显的季节差异,随季节呈“倒V型”变化规律,基本表现为:秋季>夏季>冬季>春季,人工湿地TN去除率变化范围为43.5%~82.3%,TP去除率变化范围为 38.7%~73.5%,NH4+-N去除率变化范围为21.7%~42.3%,与春季相比,夏季、秋季和冬季 TN去除率增加了 67.36%、89.20%和29.66%,TP去除率增加了80.36%、89.92%和13.95%,NH4+-N去除率增加了77.88%、94.93%和17.05%;人工湿地不同季节对 TN去除率差异均显著(P<0.05);人工湿地夏季和秋季TP和NH4+-N去除率差异不显著(P>0.05),春季和冬季TP和NH4+-N去除率差异不显著(P>0.05),而春季和冬季TP和NH4+-N去除率显著低于夏季和秋季(P<0.05)。
2.4 人工湿地BOD5、CODCr和高锰酸钾指数季节变化及去除率
图4为人工湿地不同季节BOD5、CODCr和高锰酸钾指数出水质量质量浓度及去除率变化,由图可知,人工湿地出水BOD5、CODCr和高锰酸钾指数总体变化为春季最高、夏季和秋季降低,冬季则有回升的趋势,具体表现为春季>夏季>冬季>秋季,呈“V字型”变化规律,人工湿地出水BOD5质量浓度变化范围为 53.21~95.82 mg·L-1,CODCr质量浓度变化范围为98.70~230.53 mg·L-1,高锰酸钾指数质量浓度变化范围为5.21~9.72 mg·L-1;人工湿地对BOD5、CODCr和高锰酸钾指数去除率呈现出明显的季节差异,随季节呈“倒V型”变化规律,基本表现为:秋季>夏季>冬季>春季,人工湿地 BOD5去除率变化范围为19.82%~43.10%,CODCr去除率变化范围为12.87%~37.41%,高锰酸钾指数去除率变化范围为18.33%~42.56%,与春季相比,夏季、秋季和冬季BOD5去除率增加了77.78%、117.68%和7.58%,CODCr去除率增加了144.53%、192.19%和7.03%,高锰酸钾指数去除率增加了111.48%、132.24%和 7.10%;人工湿地春季和冬季对 BOD5去除率差异不显著(P>0.05),而显著低于夏季和秋季(P<0.05),夏季和秋季对BOD5去除率差异显著(P<0.05);人工湿地夏季和秋季对 CODCr和高锰酸钾指数去除率差异不显著(P>0.05),春季和冬季对 CODCr和高锰酸钾指数去除率差异不显著(P>0.05),而春季和冬季对CODCr和高锰酸钾指数去除率显著低于夏季和秋季(P<0.05)。
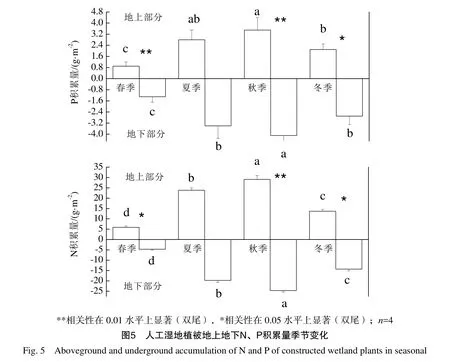
2.5 人工湿地植被地上地下N、P积累量季节变化
由图5可知,人工湿地植被地上和地下N、P积累量随季节变化具有明显的一致规律,均表现为秋季>夏季>冬季>春季,随季节呈“倒V型”变化规律。人工湿地地上 N积累量变化范围为5.93~29.10 g·m-2,P积累量变化范围为 0.91~3.54 g·m-2,地下 N 积累量变化范围为 4.72~24.74 g·m-2,P积累量变化范围为1.31~4.15 g·m-2;对于N积累量,人工湿地不同季节 N积累量差异均显著(P<0.05),并且不同季节地上部分N积累量高于地下部分N积累量,秋季地上部分N积累量极显著高于地下部分(P<0.01),春季和冬季地上部分N积累量显著高于地下部分(P<0.05);对于P积累量,不同季节地上部分P积累量低于地下部分P积累量,春季和秋季地上部分P积累量极显著低于地下部分(P<0.01),冬季地上部分P积累量显著低于地下部分(P<0.05)。
3 讨论
人工湿地主要通过植被的截流、过滤以及微生物的新陈代谢等活动净化水质,通常情况下人工湿地基质均为孔隙度较高的砾石,为微生物提供了更多的挂膜空间(Zhang等,2010;Faulwetter等,2013;Xiong等,2011;German等,2011)。本研究中人工湿地基质为炉渣和泥沙,炉渣和泥沙能够避免土壤系统表面的短流,多孔扩大了表面积,有利于微生物的代谢活动,增强了人工湿地的去除效果(Bavor,2011;Zhang等,2012;German等,2011)。微生物是土壤生态系统物质循环和能量流动的主要驱动力,土壤酶活性和微生物数量在植被-土壤生态系统中有机质的分解、养分的转化和循环等过程发挥着重要作用(German等,2011)。本研究人工湿地植被中土壤微生物均以细菌最多,占微生物总数的90%以上,其次是放线菌和真菌,不同季节微生物菌落数目和酶活性均表现为秋季>夏季>冬季>春季,这种分布主要与土壤微生态环境及植被的生长状况有关,春季植被处于萌芽阶段,微生物数目及酶活性偏低,夏季植被迅速生长和繁殖,秋季各项生长指标达到最大,通过微生物的作用和植被的输氧作用为微生物提供了各自适宜的生境,有利于微生物在人工湿地纵深的扩展,从而促进了深层基质中微生物的生长和繁殖,土壤微生物数目和酶活性达到最大,而冬季植被处于萧条期,微生物数目减少和酶活性降低(Bavor,2011;Zhang等,2012;German等,2011)。综合人工湿地植被净化污水效果来看,人工湿地净化水质效果存在着季节性差异,对TN、TP、NH4+-N、BOD5、CODCr和高锰酸钾指数的去除率呈单峰曲线,很大程度上依赖于植被及微生物的季节动态变化,说明人工湿地植被对不同污染物的去除效果和机理不同,并且人工湿地植被对TN和TP的去除率较高。人工湿地植被对TN和TP的吸收主要是通过植被的截流、过滤以及微生物的新陈代谢过程得以去除,这与前人的研究结果相吻合(Zhang等,2010;Faulwetter等,2013;Xiong等,2011)。从季节变化规律来看,人工湿地对TN、TP、NH4+-N、BOD5、CODCr和高锰酸钾指数的去除率在春季较小,春季植被生长较为缓慢,未与基质、土壤等形成完整的去污生态系统,此时人工湿地吸收作用并未表现出来,夏季植被迅速生长和繁殖,去除效果也更加明显,秋季各项生长指标均达到最大,这个时期对TN、TP、NH4+-N、BOD5、CODCr和高锰酸钾指数的去除效果最为明显,秋季以后,植被密度达到最大,缺乏有限的空间和资源,地面部分开始枯黄、根系也逐渐溃烂,净化水质效果缓慢下降等(Zhang等,2012;Zhao 等,2014;Vymazal,2011)。本研究中人工湿地植被美人蕉新生根系的须根较多,有利于根区微生物的着生,通过微生物途径净化的N数量相对较多,从长期角度出发微生物作用是人工湿地净化N的主要途径,优选根系发达的植被是提高该系统N去除率的重要措施之一(Zhang等,2012;Zhu 等,2010;Li等,2012;Bialowiec等,2012)。
本研究中人工湿地植被地上部分 N积累量高于地下部分,而地上部分P积累量低于地下部分,这种模式体现了N、P元素主要供给营养生长部位的分配特点,属于植物对 N和 P内在生长特性(Zhang等,2012;Zhu等,2010;Li等,2012;Bialowiec等,2012)。人工湿地植被N、P积累量能够反映植被对N、P的直接去除能力,营养物质的分配特点会涉及到采取的收割方式,本研究中人工湿地植被(美人蕉)基本可以通过地上和地下部分的收割去除大部分的N、P积累量,使其移出生态系统。此外,人工湿地植被的净化效果与还植被的生长速度、生长阶段、植被的生物量、植被根区微生物作用等有关,在以后研究过程中,需结合污水状况及当地气候特点有针对性地选择合适的湿地植被,最大限度地发挥湿地植被的净化作用。
4 结论
人工湿地整合和协调了土壤基质-微生物-植被的净化机理,但基质的吸附净化容量达到饱和,并且其净化作用随着植被的生长可能发生变化,因此人工湿地长期的净化效果仍有待进一步研究。此外,人工湿地通过定量收获方式可以延续其净化能力,选择生物量较大、富集污染元素较强的植被构建各种植被组合的人工湿地是净化水质的关键措施。
ABE K, KOMADA M, OOKUMA A, et al.2014.Purification performance of a shallow free-water-surface constructed wetland receiving secondary effluent for about 5 years [J].Ecological Engineering, 69(5):126-133.
BAVOR H J.2011.Application of Constructed Wetlands in Recycling,Agriculture and Agroforestry: Water Management for Changing Flow Regimes [M]//Water and Nutrient Management in Natural and Constructed Wetlands.Springer Netherlands.
BIALOWIEC A, DAVIES L, ALBUQUERQUE A, et al.2012.The influence of plants on nitrogen removal from landfill leachate in discontinuous batch shallow constructed wetland with recirculating subsurface horizontal flow [J].Ecological Engineering, 40(2): 44-52.
ELSAESSER D, BLANKENBERG A G B, GEIST A, et al.2011.Assessing the influence of vegetation on reduction of pesticide concentration in experimental surface flow constructed wetlands:Application of the toxic units approach [J].Ecological Engineering,37(6): 955-962.
FAULWETTER J L, BURR M D, PARKER A E, et al.2013.Influence of season and plant species on the abundance and diversity of sulfate reducing bacteria and ammonia oxidizing bacteria in constructed wetland microcosms [J].Microbial ecology, 65(1): 111-127.
GERMAN D P, WEINTRAUB M N, GRANDY A S, et al.2011.Optimization of hydrolytic and oxidative enzyme methods for ecosystem studies [J].Soil Biology and Biochemistry, 43(7):1387-1397.
GLEICK P H.2014.The World's Water Volume 8: The Biennial Report on Freshwater Resources [M].Island Press.
KNEESE A V.2013.The economics of regional water quality management[M].Routledge.
LI J G, REN Y B, REN N Q, et al.2012.Contributions of Microorganisms to Nitrogen Cycle of Wuyiling Wetland in Yichun in Northeast China[J].Advanced Materials Research, 418: 2286-2289.
SHARMA P K, TAKASHI I, KATO K, et al.2013.Seasonal efficiency of a hybrid sub-surface flow constructed wetland system in treating milking parlor wastewater at northern Hokkaido [J].Ecological Engineering, 53(4): 257-266.
VAN J D, CHIURAZZI M, MALLON C A, et al.2012.Microbial diversity determines the invasion of soil by a bacterial pathogen [J].Proceedings of the National Academy of Sciences, 109(4): 1159-1164.
VYMAZAL J.2011.Plants used in constructed wetlands with horizontal subsurface flow: a review [J].Hydrobiologia, 674(1): 133-156.
XIONG J, GUO G, MAHMOOD Q, et al.2011.Nitrogen removal from secondary effluent by using integrated constructed wetland system [J].Ecological Engineering, 37(4): 659-662.
YUE P.2013.Study on Purification Effect of Aquatic Plants in Complex Level Flow Constructed Wetland [J].Modern Agricultural Science and Technology, 3: 166.
ZHANG C B, WANG J, LIU W L, et al.2010.Effects of plant diversity on microbial biomass and community metabolic profiles in a full-scale constructed wetland [J].Ecological Engineering, 36(1): 62-68.
ZHANG T, XU D, HE F, et al.2012.Application of constructed wetland for water pollution control in China during 1990–2010 [J].Ecological Engineering, 47: 189-197.
ZHAO F, LIU C, RAFIQ M T, et al.2014.Screening Wetland Plants for Nutrient Uptake and Bioenergy Feedstock Production[J].International Journal of Agriculture and Biology, 16(1): 213-216.
ZHU G, JETTEN M S M, KUUSCHK P, et al.2010.Potential roles of anaerobic ammonium and methane oxidation in the nitrogen cycle of wetland ecosystems [J].Applied microbiology and biotechnology,86(4): 1043-1055.
